miR-24-3p对猪颗粒细胞雌二醇合成的作用
2024-02-01时胜洁王立光蔡传江何伟先褚瑰燕
时胜洁,王立光,高 磊,蔡传江,何伟先,褚瑰燕*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.齐全农牧集团股份有限公司,遂宁 629000)
卵泡是哺乳动物卵巢的功能单位,由膜细胞、颗粒细胞(GCs)和卵母细胞组成[1]。颗粒细胞作为卵巢卵泡中最大的细胞群,其雌二醇合成能力对卵泡的生长发育是至关重要的[2]。颗粒细胞通过分泌雌二醇维持内分泌系统平衡[3-4],抑制颗粒细胞凋亡,并促进有腔卵泡发育[5]。雌二醇的合成是以胆固醇为底物经过多种酶的催化和切割完成的[6],雌激素合成的限速步骤是StAR介导的胆固醇从线粒体外膜转运到线粒体内膜,其中细胞色素P450酶催化胆固醇侧链的裂解,通过CYP11A1转化为孕烯醇酮[7],最后芳香化酶在颗粒细胞中将睾酮转化为雌二醇。
microRNAs (miRNA)是长度约为22个核苷酸并具有调控基因表达功能的非编码小RNA分子,参与许多关键的细胞生理过程。miRNA通过结合靶基因的3′-UTR特定序列来靶向mRNA,使其降解或抑制翻译,从而在转录后或翻译水平上抑制基因表达[8]。多项研究表明,miRNA可以通过直接调控雌二醇合成过程中的关键酶或蛋白从而影响雌二醇合成,例如,在猪的颗粒细胞中miR-378直接靶定CYP19A1抑制其转录后翻译进而抑制雌二醇的合成[9]。miRNA也可以通过影响促性腺激素受体或相关信号通路等生物学过程间接调控雌二醇合成,例如,miR-31和miR-143通过靶向促卵泡素受体(FSHR)抑制牛卵泡中雌二醇和孕酮的合成[10],miR-574通过靶定TIMP3抑制p-ERK1/2信号通路从而影响颗粒细胞雌二醇的合成[11]。
microRNA-24-3p (miR-24-3p)是动物体内高度保守的非编码RNA,其成熟序列包含22个核苷酸,在不同物种组织和细胞的不同发育阶段表现出特定的表达谱[12]。miR-24-3p在多个生物学过程中发挥重要的调节作用,其研究报道多集中在癌症[13-14]、心脏纤维化[15]、细胞增殖凋亡[16]等方面。在动物繁殖领域,miR-24-3p在产仔数高(>16.4 头·窝-1)的大白母猪卵巢组织中的表达水平高于低产母猪(<7.4头·窝-1)[17]。在患有多囊卵巢综合征的女性卵泡液中miR-24-3p的水平降低[18],表明miR-24-3p对卵泡发育至关重要。优势卵泡颗粒细胞合成雌二醇的能力高于普通卵泡,有研究表明,从奶牛发情第7天的优势卵泡分离的颗粒细胞中miR-24-3p的表达高于从属卵泡[19]。前期研究发现,miR-24-3p在猪颗粒细胞中通过靶定P27促进细胞增殖并抑制细胞凋亡[20]。而且颗粒细胞的雌二醇合成能力能够影响细胞增殖与凋亡,基于以上的研究基础,假设miR-24-3p可能调节猪颗粒细胞的雌二醇合成,本研究将明确miR-24-3p在猪颗粒细胞雌二醇合成中的作用及其调控机制,提示miR-24-3p是颗粒细胞内分泌功能的关键调控因子。
1 材料与方法
1.1 主要试剂
DMEM/F12(Gibco公司),10% 胎牛血清(Hyclone公司),猪的雌二醇 ELISA试剂盒(上海酶联生物科技有限公司),蛋白裂解液RIPA(碧云天生物技术),negative control (NC),miR-24-3p-mimics,miR-24-3p-inhibitor (上海吉玛生物公司),X-tremeGENE HP DNA罗氏转染试剂(德国罗氏公司),抗体:StAR(Cell Signaling Technology公司),CYP19A1(Gene Tex),CYP11A1(Abcam公司), TOP1(abways公司),BMAL1(Santa Cruz公司),Mouse Antibody(abways公司),Rabit Antibody(Abways公司),β-actin(Cell Signalling Technology公司)。
1.2 细胞培养和试验分组
本试验中所用的颗粒细胞取样自杨凌本香集团生猪屠宰场的180日龄健康母猪的卵巢组织。从生殖系统中剪掉连接的子宫和韧带分离出健康的卵巢,立即放入含有100 IU·mL-1双抗(青、链霉素)的37 ℃生理盐水中,1 h内运回实验室。用75%酒精快速清洗3遍(酒精浸泡时间不要超过20 s),用含有双抗的37 ℃生理盐水清洗3遍,待用。在卵巢中选择直径为3~5 mm的健康卵泡,用10 mL注射器吸取卵泡中卵泡液;在1 500 g下离心10 min,弃去卵泡液上清;加入适量含有双抗37 ℃的PBS轻轻吹打离心后的沉淀,清洗其中的颗粒细胞,1 500 g离心10 min,弃去PBS上清;加入含有10% FBS的DMEM/F12培养基重悬细胞,反复轻轻吹打,直至细胞完全散开、混匀;将适量混匀的细胞接种于培养板中,置于37 ℃,5% CO2培养箱中培养;接种24 h后观察颗粒细胞贴壁生长情况,吸去培养基及未贴壁的颗粒细胞、卵母细胞;使用含有双抗37 ℃的PBS清洗贴壁的颗粒细胞,轻轻吹洗3遍,尽量将未贴壁的颗粒细胞及杂质清除干净;吸取PBS,更换新培养基,继续培养。试验对照组为mimics-NC/inhibitor-NC,处理组为mimics-miR-24-3p/inhibitor-miR-24-3p/mimics-miR-24-3p+TOP1,使用X-tremeGENE HP DNA罗氏转染试剂进行转染,24 h后细胞密度为80%时收集细胞进行检测[21]。
1.3 ELISA检测雌二醇浓度
按照ELISA试剂盒(货号:YJ002366)说明书检测培养基中的雌二醇水平,450 nm处的吸光度值表示在Multiskan TM FC (赛默飞世尔科技有限公司)上测量的激素的相对浓度,不同处理的培养基样品在2 000 g离心20 min,将稀释后的上清加入预先包被雌二醇特异性抗体的酶联免疫吸附试验条带板,然后在37 ℃下用酶标结合的雌二醇抗体孵育30 min。洗涤后,加入底物溶液以触发显色反应。使用Multiskan TM FC分光光度计在450 nm处测量(赛默飞世尔科技有限公司)吸光度[22]。
1.4 总RNA提取及实时荧光定量PCR
用TRIzol试剂 (TaKaRa公司)提取GCs中的总RNA,并使用NanoDrop 2000分光光度计(赛默飞世尔科技有限公司)测定其浓度,将总RNA (500 ng)逆转录为cDNA。StepOne Real-Time PCR仪(美国Applied Biosystems公司)进行RT-qPCR检测(引物序列见表1),用2-ΔΔCt法计算相对基因表达量,检测基因表达水平时将β-actin基因作为内参进行归一,检测miR-24-3p水平时,U6小RNA作为内参。
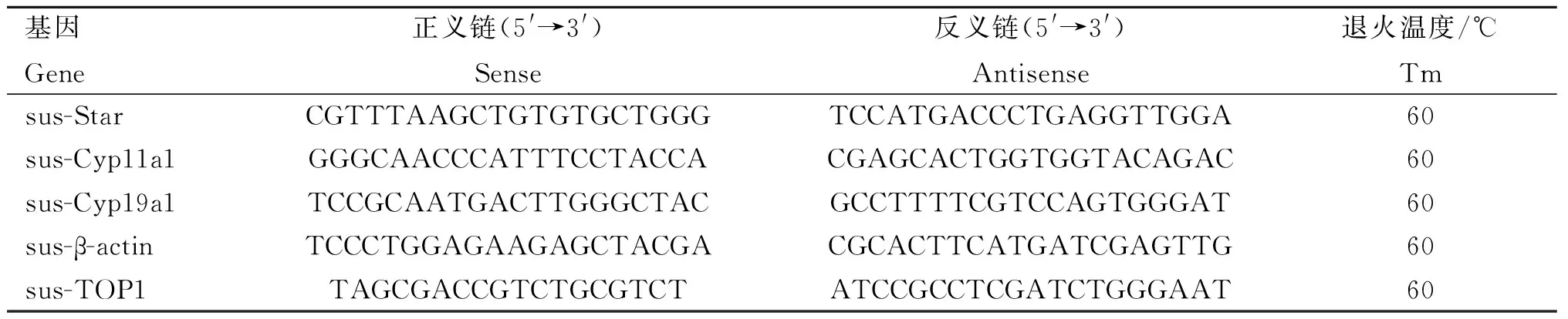
表1 RT-qPCR引物序列Table 1 RT-qPCR primer sequences
1.5 总蛋白提取及Western blot检测
使用RIPA裂解液提取颗粒细胞中的总蛋白,用BCA法(Cwbio)测定蛋白浓度,蛋白定量后取20 μg总蛋白进行SDS-PAGE,转膜后用5%脱脂奶粉封闭,用目的蛋白稀释好的一抗进行4 ℃过夜孵育,将一抗孵育完的膜用TBST洗膜4次,每次5 min,将膜置于稀释好的的二抗中,室温孵育1 h,TBST洗膜4次,将Milipore的化学发光液滴加到膜上利用FluorChemRSystem(ProteinSimple)成像软件系统分析蛋白条带。曝光完成后,利用Image Lab软件对蛋白结果进行定量分析。
1.6 双荧光素酶报告试验
使用target Scan 6.2和RNAhybrid网站预测miR-24-3p的靶基因。荧光素酶报告质粒(psi-CHECK2)购于通用生物公司,将miR-24-3p-NC或miR-24-3p-mimics与CHECK2-TOP1报告载体或突变载体共转染进HEK293T细胞,转染24 h后收取细胞。采用双荧光素酶测定系统测定荧光素酶活性(Promega, Madison, WI, USA)。
1.7 统计分析
使用GraphPad Prime 8.0对试验数据进行分析。所有数据均以3个独立试验的“means ± SEMs”表示。采用双尾非配对学生t检验对两个试验组进行比较。P<0.05、P<0.01、P<0.001、P<0.000 1分别用星号(*)、(**)、(***)、(****)表示具有统计学意义的值。
2 结 果
2.1 过表达miR-24-3p促进颗粒细胞的雌二醇合成
雌二醇合成是猪颗粒细胞重要的内分泌功能,随着卵泡腔的增大雌二醇的水平逐渐升高。miR-24-3p在猪小、中、大有腔卵泡中的表达水平有逐渐升高的趋势(图1A)。miR-24-3p-NC及miR-24-3p-mimics处理颗粒细胞后,试验结果表明在miR-24-3p-mimics处理组miR-24-3p的表达水平显著升高(P<0.001,图1B),并且促进了StAR、CYP11A1、CYP19A1的转录(P<0.05,图1D)。ELISA结果显示,过表达miR-24-3p后,培养基中的雌二醇含量显著升高(P<0.01,图1C)。此外过表达miR-24-3p可以显著促进StAR、CYP19A1及CYP11A1的蛋白表达水平(P<0.05,图1E&F)。这些结果表明miR-24-3p可以通过上调雌二醇合成关键基因的表达进而促进雌二醇的合成。
2.2 干扰miR-24-3p抑制颗粒细胞的雌二醇合成
为了反向验证miR-24-3p对猪卵巢颗粒细胞雌二醇合成的作用,在颗粒细胞中转染miR-24-3p-inhibitor达到抑制miR-24-3p表达的作用(P<0.000 1,图2A),ELISA结果表明干扰miR-24-3p后雌二醇的含量显著降低 (P<0.05,图2B)。干扰miR-24-3p可以显著下调CYP19A1、CYP11A1 mRNA和蛋白的表达水平(P<0.05,图2C-E)。以上结果表明干扰miR-24-3p可通过抑制雌二醇合成关键基因的表达进而抑制雌二醇的合成。
2.3 TOP1是miR-24-3p的直接靶基因
为了阐明miR-24-3p在颗粒细胞中的调控机制,在前期研究中使用miRDB、miRWalk、miRTarBase和TargetScan网站预测了miR-24-3p的靶基因,筛选出17个交集基因,试验验证发现miR-24-3p mimics抑制TOP1、CDC38、P27的mRNA水平,而miR-24-3p inhibitor增加其表达[20]。已有研究发现TOP1通过降低Bmal1水平抑制雌二醇合成[23]。通过BiBiServ软件预测发现miR-24-3p的种子序列可以与TOP1 mRNA 3′UTR的序列完全匹配(图3A)。接下来构建了TOP1野生型与突变型的双荧光素酶报告质粒(图3B)并与miR-24-3p mimics共转染HEK293 T细胞,发现miR-24-3p可以显著抑制野生型TOP1的活性(P<0.000 1),但对突变型的TOP1无显著影响(图3C)。这些结果表明TOP1是miR-24-3p的直接靶基因。
2.4 miR-24-3p抑制TOP1 mRNA和蛋白的表达
以上结果表明,miR-24-3p的种子序列能直接靶定TOP1的3′UTR区,接下来进一步探究miR-24-3p对TOP1 mRNA和蛋白表达水平的影响,将miR-24-3p mimics和inhibitor转染进颗粒细胞,结果表明过表达miR-24-3p可显著抑制TOP1的转录与翻译,促进BMAL1的表达(P<0.05,图4A-C),而抑制miR-24-3p则可显著提高TOP1的mRNA和蛋白水平,抑制BMAL1的表达(图4D-F)。
2.5 过表达TOP1可减弱miR-24-3p对颗粒细胞雌二醇合成的促进作用
为了进一步证明TOP1在促进miR-24-3p合成雌二醇中的作用,通过构建TOP1的过表达载体,并将其与miR-24-3p-mimics共转染到猪颗粒细胞中,pcDNA-TOP1处理组的TOP1 mRNA水平显著升高(P<0.05,图5A)。与pcDNA-3.1+miR-24-3p-mimics处理组相比,pcDNA-TOP1+miR-24-3p-mimics共转染组雌二醇浓度显著下降(P<0.05,图5B)。已有研究表明,BMAL1可以促进猪颗粒细胞的雌二醇合成[23],而TOP1能够抑制BMAL1转录[24],因此对BMAL1在不同处理组的表达水平进行检测,CYP11A1、CYP19A1和BMAL1蛋白水平显著下降(P<0.05,图5C&D),表明过表达TOP1可减弱miR-24-3p对颗粒细胞雌二醇合成的促进作用。
3 讨 论
颗粒细胞作为卵泡发育必需的细胞类型,雌二醇合成是颗粒细胞重要的内分泌功能[25]。大量研究表明,miRNA参与到雌二醇的合成调控过程。在猪卵巢颗粒细胞中过表达miR-31可以抑制FSHR和HSD17B14的表达进而抑制雌二醇合成,miR-20b可靶向并抑制HSD17B14的表达进而抑制雌二醇的合成[26],miR-495-3p能够刺激类固醇激素分泌从而影响山羊卵泡的发育[27]。目前大多数研究发现,miRNA在卵巢颗粒细胞雌二醇的合成过程中发挥着负调控作用,但仍有少部分miRNA发挥正相关的调控作用,例如miR-132参与cAMP信号通路,并通过抑制卵巢颗粒细胞中转录诱导核受体相关1(Nurr1)的翻译促进雌二醇合成[28],此外,miR-133b通过靶向Foxl2介导StAR和CYP19A1的负转录调节来从而刺激雌激素的产生[29]。已有研究表明,miR-24-3p的表达水平与母猪产仔数[17]、卵泡发育能力相关[18-19],前期研究基础也证明miR-24-3p促进猪颗粒细胞的增殖并抑制细胞凋亡[20],而且颗粒细胞的增殖凋亡等生理功能与雌二醇合成的内分泌功能息息相关[30]。因此,为了探究miR-24-3p对颗粒细胞雌二醇合成的影响,通过在颗粒细胞中过表达和抑制miR-24-3p的水平,发现miR-24-3p促进雌二醇的合成。在颗粒细胞雌二醇合成过程中,CYP11A1将胆固醇转化为孕烯醇酮,这是类固醇激素合成过程中的第一个限速反应[31],CYP19A1编码的芳香化酶将睾酮转化为雌二醇[32],本研究结果也表明,miR-24-3p通过显著上调雌二醇合成关键基因CYP11A1和CYP19A1的mRNA和蛋白水平来促进雌二醇合成。
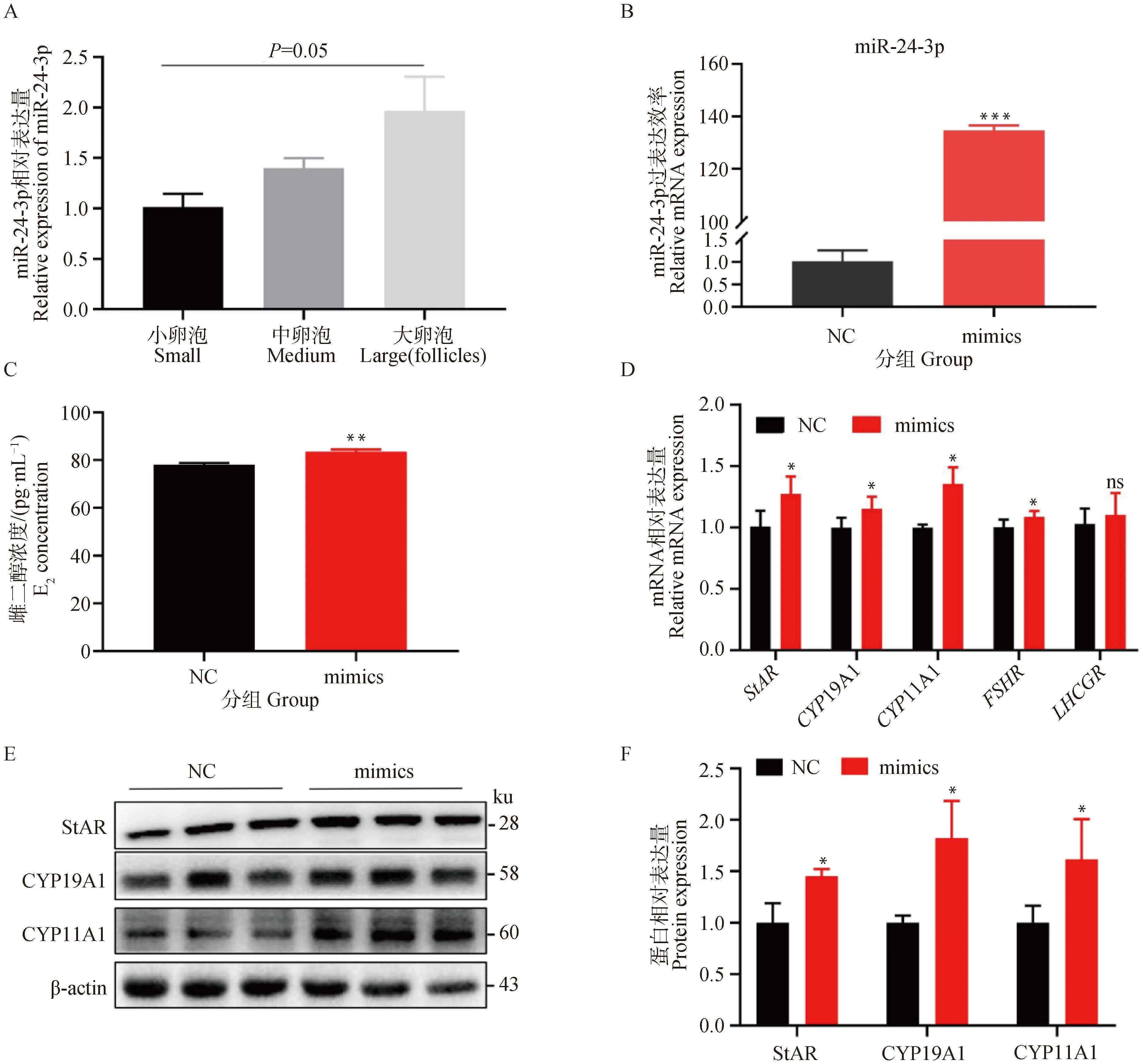
A. miR-24-3p在猪小、中、大卵泡中的表达水平;B. 转染miR-24-3p mimics后的过表达效率;C. ELISA检测miR-24-3p过表达24 h后上清中雌二醇的浓度;D. 转染miR-24-3p mimics 24 h后雌二醇合成相关基因StAR、CYP19A1、CYP11A1、FSHR和LHCGR mRNA的相对水平;E. 转染24 h后雌二醇合成相关基因StAR、CYP19A1、CYP11A1的相对蛋白水平;F. StAR、CYP19A1、CYP11A1定量蛋白分析。结果为3个独立试验的“平均值±标准误”;*.P<0.05,**. P<0.01,****.P<0.000 1,ns表示差异不显著,下同 A. The levels of miR-24-3p in porcine small, medium and large follicles; B. The overexpression efficiency of miR-24-3p mimics; C. The concentration of E2 in the supernatant after overexpression of miR-24-3p is detected by ELISA for 24 h; D. Relative levels of steroid synthesis-related genes StAR, CYP19A1, CYP11A1, FSHR and LHCGR mRNA after transfection of miR-24-3p mimics for 24 h; E. Relative protein levels of steroid synthesis-related genes StAR, CYP19A1, CYP11A1 after transfection for 24 h; F. Quantification proteins analysis of StAR, CYP19A1 and CYP11A1. Results are “means ± SEMs” of 3 independent experiments; *.P<0.05,**.P<0.01,****.P<0.000 1, ns indicate no significant difference, the same as below图1 过表达miR-24-3p促进颗粒细胞中雌二醇的合成Fig.1 Overexpression of miR-24-3p promotes E2 synthesis in granulosa cells
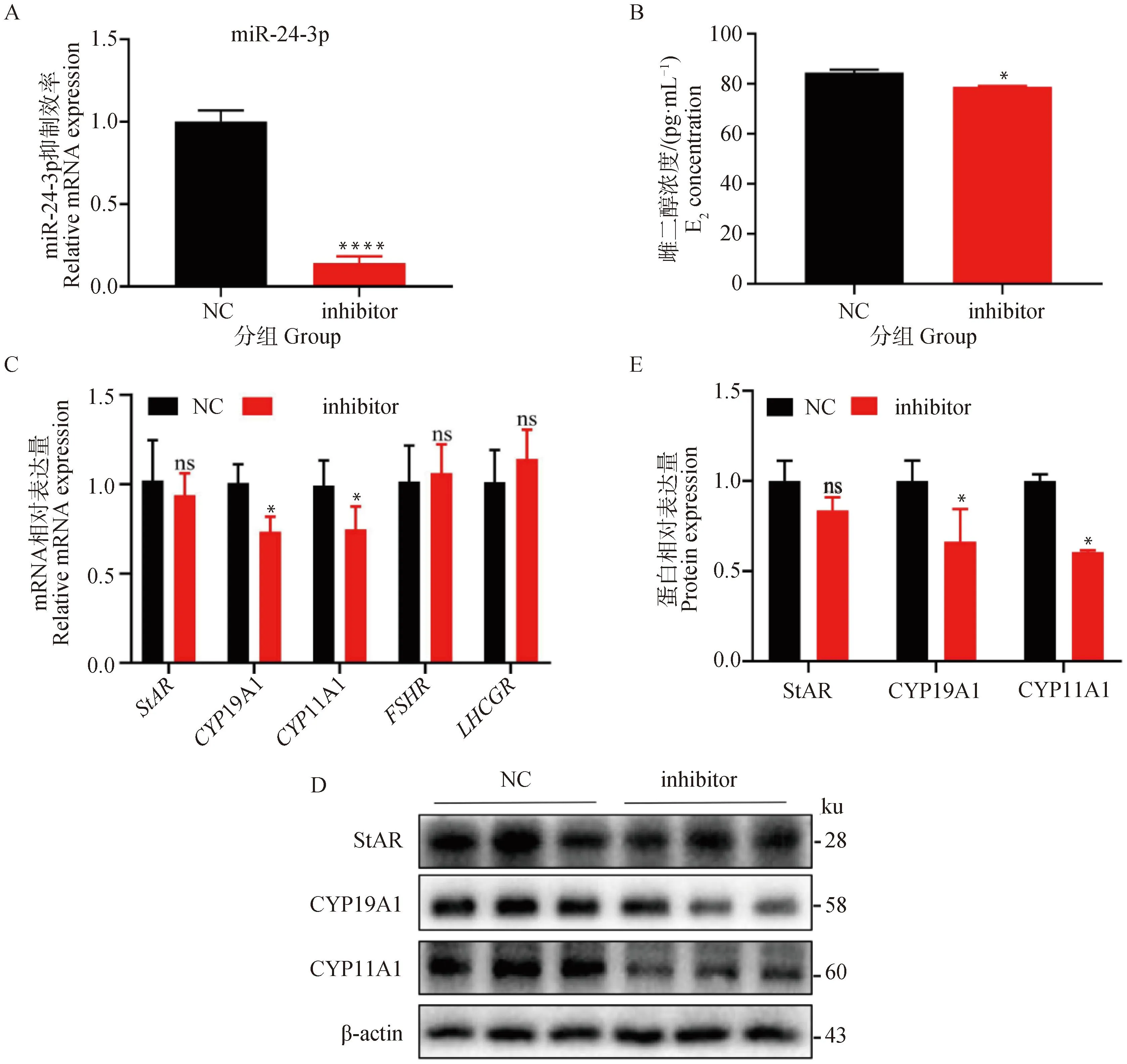
A. miR-24-3p-inhibitor与NC的干扰效率比较;B. ELISA检测miR-24-3p干扰24 h后上清中雌二醇的浓度;C. 转染miR-24-3p inhibitor 24 h后,雌二醇合成相关基因StAR、CYP19A1、CYP11A1、FSHR和LHCGR mRNA的相对水平;D. 转染miR-24-3p inhibitor 24 h后雌激素合成相关基因StAR、CYP19A1、CYP11A1的相对蛋白水平;E. StAR、CYP19A1、CYP11A1定量蛋白分析 A. Interference efficiency of miR-24-3p inhibitor compared with NC; B. The concentration of E2 in the supernatant after interference of miR-24-3p for 24 h is detected by ELISA; C. Relative levels of steroid synthesis-related genes StAR, CYP19A1, CYP11A1, FSHR and LHCGR mRNA after transfection of miR-24-3p inhibitor for 24 h; D. Relative protein levels of steroid synthesis-related genes StAR, CYP19A1 and CYP11A1 after transfection of miR-24-3p inhibitor for 24 h; E. Quantification proteins analysis of StAR, CYP19A1 and CYP11A1图2 干扰miR-24-3p抑制颗粒细胞中雌二醇的合成Fig.2 Interfering with miR-24-3p reduced E2 synthesis in granulosa cells
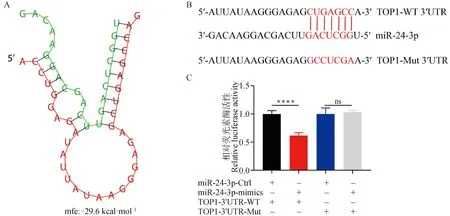
A. miR-24-3p与TOP1 mRNA 3′ UTR序列结合能预测;B. TOP1野生型和突变型双荧光素酶载体构建的序列;C. 共转染的后的双荧光素酶活性 A. Prediction of the binding energy of miR-24-3p to TOP1 mRNA 3′ UTR sequence; B. Sequence constructed by TOP1 wild-type and mutant dual-luciferase vectors; C. Dual-luciferase activity after co-transfection图3 TOP1是miR-24-3p的直接靶基因Fig.3 TOP1 is a direct target gene of miR-24-3p
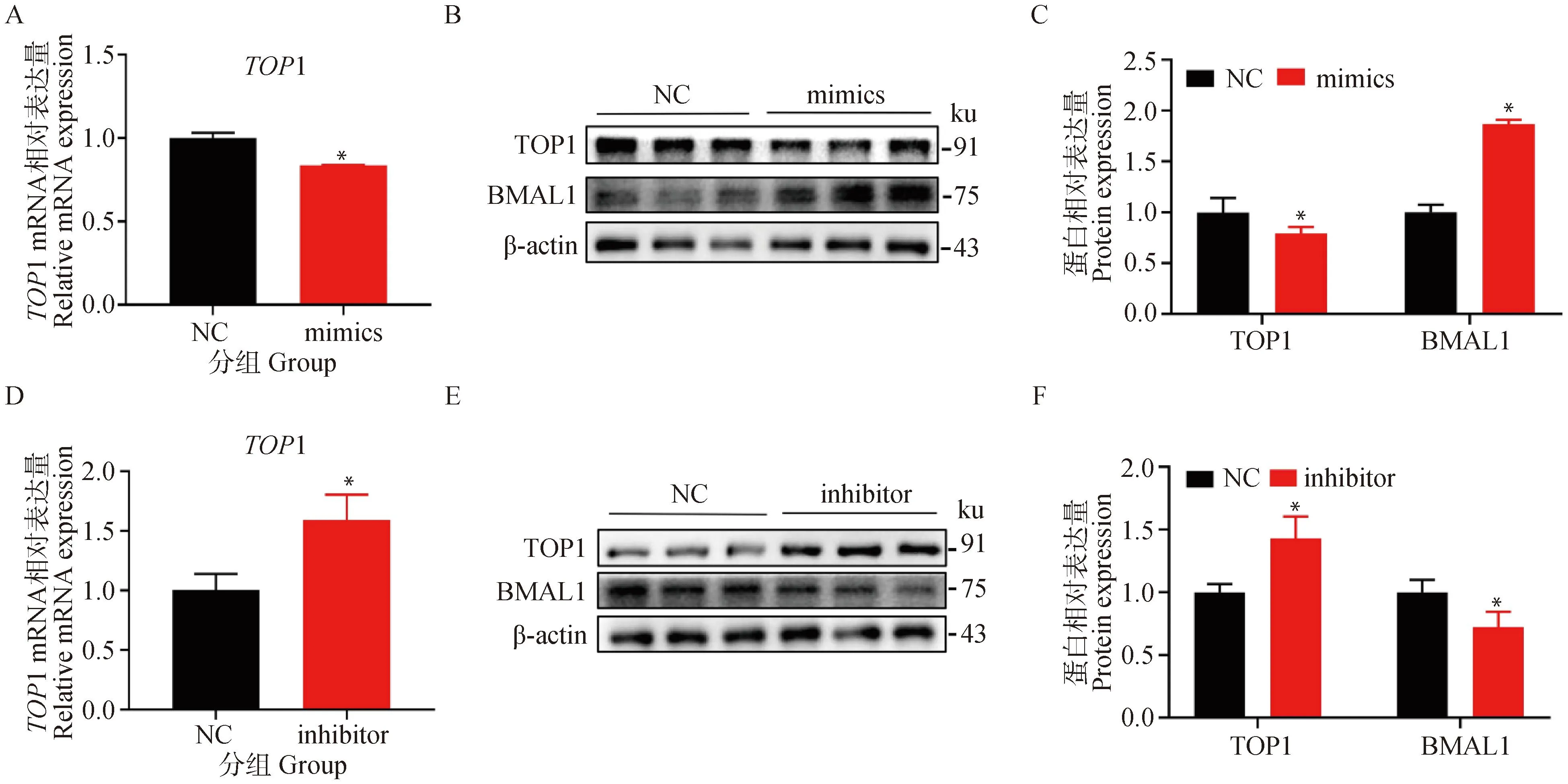
A. 转染miR-24-3p mimics 24 h后TOP1的mRNA水平;B. 转染miR-24-3p mimics 24 h后TOP1的蛋白水平;C. 蛋白结果的定量分析;D. 转染miR-24-3p inhibitor 24 h后TOP1的mRNA水平;E. 转染miR-24-3p inhibitor 24 h后TOP1的蛋白水平;F. 蛋白结果的灰度分析。结果呈现为“平均值±标准误”,*.0.01 A. pcDNA-TOP1转染进颗粒细胞的过表达效率;B. ELISA检测上清液中的雌二醇含量;C. 共转染后的CYP19A1和CYP11A1的蛋白水平;D. 蛋白的定量统计 A. The overexpression efficiency of pcDNA-TOP1 transfected into granulosa cells; B. ELISA to detect estradiol content in supernatant; C. CYP19A1 and CYP11A1 protein levels after co-transfection; D. Quantitative statistics of proteins图5 过表达TOP1减弱miR-24-3p对颗粒细胞雌二醇合成的促进作用Fig.5 Overexpression of TOP1 attenuates the promoting effect of miR-24-3p on estradiol synthesis in granulosa cells 在明确了miR-24-3p促进颗粒细胞合成雌二醇的功能基础上,进一步探究其具体的调控机制。通过靶基因预测及双荧光素酶报告试验发现miR-24-3p可能靶向TOP1, TOP1是拓扑异构酶家族的一员,在DNA复制过程中断裂,然后随着DNA链的旋转进而催化断裂链的重新连接,从而改变螺旋DNA的拓扑状态[33]。研究表明,TOP1位于BMAL1启动子上的两个RORE元件之间,TOP1结合位点是转录抑制所必需的,TOP1与远端RORE协同作用,导致BMAL1转录被TOP1抑制而下调[24]。在外周血单核细胞中,敲降Bmal1导致雌二醇合成显著减少[34],在猪卵巢颗粒细胞中,Bmal1可通过PI3K/Akt/mTOR信号通路促进雌二醇的合成[23]。因此,假设miR-24-3p通过靶向TOP1促进BMAL1的合成,从而促进雌二醇合成。通过试验进行验证,结果表明过表达miR-24-3p抑制TOP1水平,同时促进BMAL1的转录和翻译,而抑制miR-24-3p则具有相反的结果。为了证明TOP1介导miR-24-3p对雌二醇合成的作用,在过表达miR-24-3p的基础上过表达TOP1,回补试验结果进一步证实了过表达TOP1会减弱miR-24-3p对颗粒细胞雌二醇合成的促进作用。针对TOP1的研究多集中在DNA损伤修复[35]、癌细胞的药物靶点[36]、基因表达调控[37]等方面,目前尚无其他相关报道表明miRNA通过靶定TOP1在颗粒细胞雌二醇合成过程中发挥作用,但在癌细胞中已有研究表明TOP1作为miRNA靶基因发挥作用,miR-23a介导的TOP1表达抑制增强了人肝癌细胞对依托泊苷的反应[38],miR-149可能通过抑制TOP1发挥其在癌症预后中的作用[39]。 在猪颗粒细胞中,miR-24-3p通过直接靶向TOP1抑制其mRNA和蛋白水平,从而上调BMAL1的表达,提高雌二醇合成相关基因的表达水平进而促进雌二醇合成。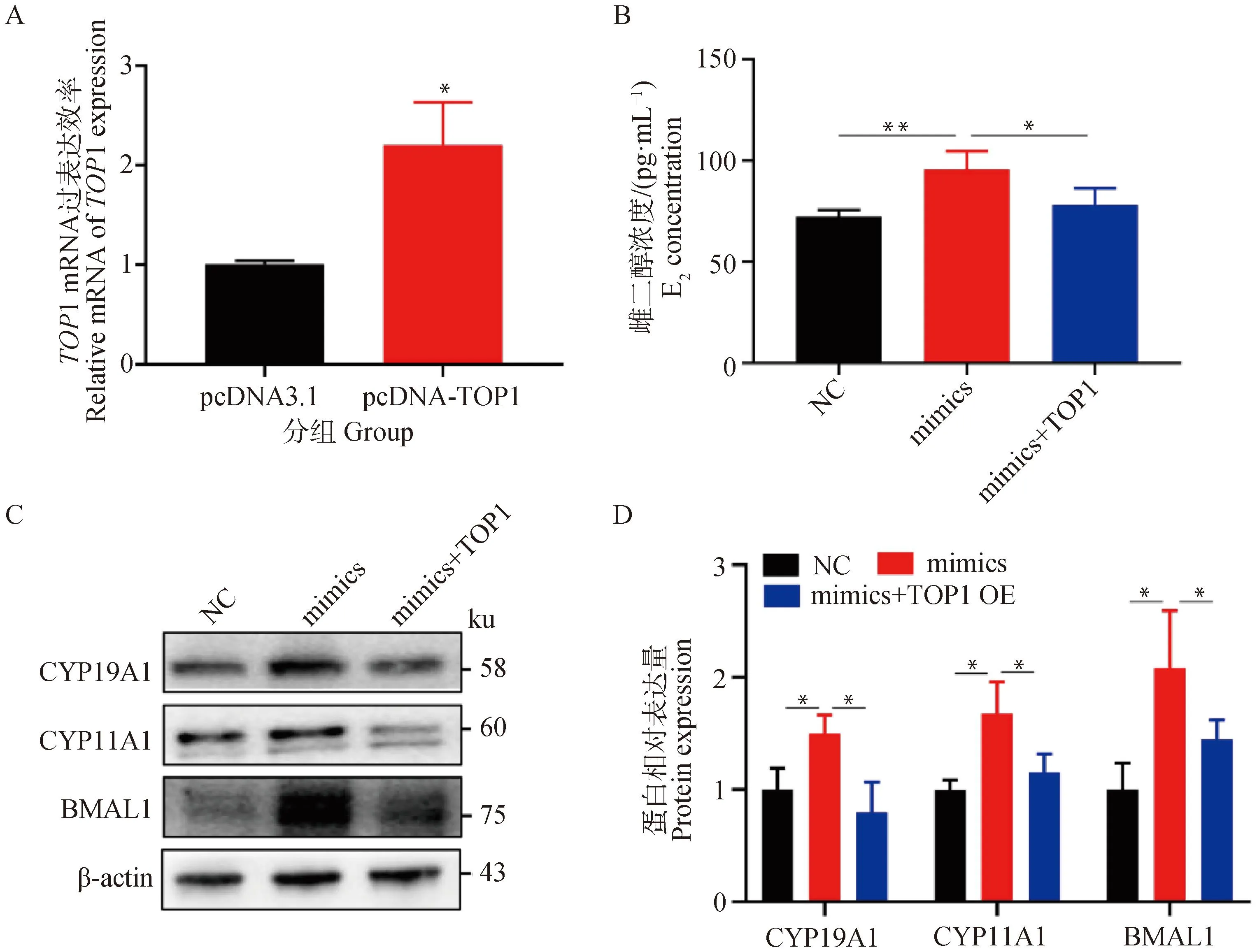
4 结 论
