肺泡上皮细胞分泌的外泌体调控巨噬细胞极化在急性肺损伤中的作用
2024-02-01王鑫鑫林树梅赵冬冬王学生
王鑫鑫,林树梅*,赵冬冬,王学生
(1.沈阳农业大学动物科学与医学学院,沈阳 110866; 2.沈阳康利生物科技有限公司,沈阳 110000)
脓毒症是指宿主以脏器发生功能障碍为特征,对侵入的病原体产生失控反应而造成有生命危险的症候群[1]。在机体众多受损器官中,肺是脓毒症最早且最容易受伤的靶器官,在脓毒症发病早期可引起急性肺损伤(acute lung injury,ALI),造成病畜呼吸系统发生功能障碍,ALI甚至是导致脓毒症动物死亡的罪魁祸首[2]。据调研发现,全国生猪感染脓毒症的概率已经超过50%,超过一半的脓毒症患畜会发展为ALI,而ALI的死亡率约为40%[3]。
“炎症因子风暴”是ALI炎症初期的主要表现,本质上是肺的急性炎症反应过程[4]。不分“敌我”的炎症因子,对动物机体造成持续性损伤。脓毒症引起肺损伤的致病机理错综复杂,涉及肺内多种细胞间的相互作用,如肺泡上皮细胞(alveolar epithelial cells,AECs)、肺泡巨噬细胞(alveolar macrophages,AMs)、中性粒细胞、T细胞等[5]。目前,对于ALI还没有特定的治疗方法。ALI的临床治疗主要包括肺保护性通气和限制性液体管理,并辅助糖皮质激素、吸入性肺血管扩张剂、神经肌肉阻滞和体外膜肺氧合[6-7]。尽管上述治疗方法能够改善ALI的症状,但是会伴有长期的后遗症,包括认知障碍、肺功能不全、肌肉无力等[8]。因此,迫切需要探寻安全有效的ALI治疗新策略。
AMs是驻留在肺组织中的主要免疫细胞,在ALI的发病中扮演着重要角色[9]。AMs通过不断地接受来自周围或其他远处细胞的外源信号,激活AMs,释放过量的炎性细胞因子,促进炎症反应的发生发展。最新研究发现,AMs与肺结构细胞密切相关[10]。AECs是具有大表面积的结构细胞,作为肺泡中病原体防御的第一道防线,在肺损伤过程中,AECs通常是最先被攻击的细胞[11]。当肺部感染病原微生物时,AECs参与包括巨噬细胞在内的各种免疫细胞和炎症介质的募集,免疫细胞在对抗病原微生物的同时,不可避免地损伤AECs,同时,受损的AECs也会以外泌体形式发出调节信息影响AMs的表型及功能。
外泌体是各类细胞主动分泌的纳米级别的细胞外囊泡,外泌体能够穿透细胞膜并靶向特定组织或细胞的能力,同时外泌体具有低免疫力原性,不会被免疫系统排斥。一些调节信息以外泌体为介质在结构性细胞与免疫细胞之间的交流中扮演着关键角色,成为细胞功能的重要调节剂[12]。研究表明,外泌体可以促进组织修复和血管生成,以促进缺血组织的重建,从而在多种疾病中显示出很好的应用前景[13-15]。而且,外泌体在炎症反应和自身免疫疾病中体现积极的作用[16-17]。还有研究表明,在ALI的发病过程中,AMs通过不断地接收来自包括AECs源性的外泌体刺激发生极化反应,从而影响ALI的发生发展。外泌体的发现为ALI的治疗开辟了新思路。
1 巨噬细胞极化在急性肺损伤中的作用
1.1 巨噬细胞极化分型
在炎症和宿主防御中,巨噬细胞在肺组织中起着核心作用,是先天性固有免疫的重要组成部分[18]。在肺组织中,巨噬细胞群有三种不同的来源:气道、肺泡和间质巨噬细胞[19]。肺中的巨噬细胞通过抗原呈递,以及吞噬吸入的颗粒、由外来病原体诱导产生的细胞因子来清除抗原及异物[20]。巨噬细胞的表型不是一成不变的,在各种环境因素或不同的病理生理条件刺激下,将一种“活化型”转化为另一种“活化型”是一个快速且可逆的过程。巨噬细胞极化主要分为两种不同的极化状态:经典活化型巨噬细胞(classically activated macrophages,M1)与选择活化型巨噬细胞(alternatively activated macrophages,M2)[21-22]。其中,M2型巨噬细胞由M2a、M2b、M2c和M2d四种亚型组成[10]。它们被不同的刺激物激活,M2a巨噬细胞主要是由白细胞介素4(interleukin-4,IL-4)和IL-13诱导产生,而M2b表型通常是由IL-1β或免疫复合物诱导形成,IL-10和糖皮质激素促进M2c巨噬细胞的合成,M2d型由腺苷A诱导2a受体激动剂和Toll样受体(Toll-like receptor,TLR)协调诱导形成[23-24]。研究显示[25],在ALI的发病过程中,表现出较强的促炎及抗原提呈能力的主要为M1型巨噬细胞;而发挥抗炎、修复组织和促进纤维化作用的主要是M2巨噬细胞。巨噬细胞这两种不同的极化状态有着截然相反的功能,甚至可以说是相互拮抗。
1.2 巨噬细胞极化的调控
巨噬细胞通过吞噬作用清除机体内“垃圾”,积极参与细胞外基质重塑、血管生成以及炎症反应等过程[26]。巨噬细胞在ALI的发病机制中起着主要作用,极化时间和程度决定了疾病的严重程度和发展方向,M1型巨噬细胞与发病初期密切相关,而M2型巨噬细胞主要与ALI炎症的恢复期有关[27]。巨噬细胞的极化可受多种因素的调节,包括miRNA、蛋白质、糖皮质激素及中草药提取物等。其中,miRNA是通过调控mRNA的稳定性和翻译过程来调节相关基因表达的一种小型非编码RNA。研究人员发现干扰素-γ(interferon-gamma,IFN-γ)或TLR受体激动剂促进巨噬细胞向M1型极化过程中,表达水平发生明显上升的为miR-155[28]。随后发现,miR-155可以靶向作用于TLR4信号通路中促进巨噬细胞向M1表型转化的髓样分化因子88蛋白,上调促炎因子表达。而在IL-4诱导巨噬细胞从M1向M2表型转变的过程中,miR-155下降明显。彭巍[29]通过miRNAs基因芯片技术筛选正常肺泡上皮细胞来源的外泌体(AEC-Exo)和脂多糖(lipopolysaccharide,LPS)诱导肺泡上皮细胞来源的外泌体(LPS-AEC-Exo)的差异miRNA表达谱,获得与炎症反应密切相关的miR-92a-3p,证明LPS-AEC-Exo通过miR-92a-3p激活AMs中的核转录因子-κB(nuclear factor-kappa B,NF-κB)炎症信号通路,诱导炎症反应。脂肪间充质干细胞外泌体传递的miR-16-5p可以通过抑制TLR4促进巨噬细胞向抗炎M2型极化来改善盲肠结扎和穿孔诱导的脓毒症小鼠的肺损伤[30]。Song等[31]证明与未经IL-1β处理的间充质干细胞来源的外泌体组相比,经IL-1β预处理的间充质干细胞来源的外泌体中miR-146a的表达显著增强,并且外泌体miR-146a转移至巨噬细胞导致其发生M2极化。Gu等[32]发现,将miR-124模拟物转染单核巨噬细胞能够通过促进甘露糖受体C1基因、壳酶蛋白、IL-10的表达促进巨噬细胞发生M2型极化。
除了miRNA之外,许多蛋白质和糖皮质激素也参与ALI中巨噬细胞极化和炎症反应调节。Mittal等[33]发现在LPS诱导的小鼠ALI模型中,观察到通过给小鼠气管滴注TSG-6(tumor necrosis factor alpha-stimulated gene-6,TSG-6)可以治疗肺损伤,其作用机制主要是促使M1型巨噬细胞向M2型巨噬细胞转变,使促炎细胞因子的释放减少,同时提高抗炎细胞因子水平。众所周知,甲基强的松龙具有抗炎特性,被广泛用于各种炎性疾病,包括ALI。已有研究证实,甲基强的松龙抗炎作用与促进AMs发生M2极化,从而有助于炎症的消退和组织的修复有关[34]。近年来,研究者从中草药提取物中分离出许多具有抗炎疗效的成分,其中有一种为苯丙素苷类化合物Smiglaside A。研究发现,Smiglaside A能够减轻LPS诱导的肺损伤,并增加小鼠的存活率。这与其在抑制巨噬细胞M1极化的同时,促进巨噬细胞M2极化有关,极化调节作用由腺苷酸活化蛋白激酶(adenosine activated protein kinase,AMPK)和过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)信号通路介导[35]。
2 肺泡上皮细胞外泌体调控巨噬细胞极化在急性肺损伤中的作用
2.1 肺泡上皮细胞的分类及作用
AECs具有较大的表面积,是保护肺免受各种侵害的物理屏障,对维持肺的完整性和生理功能起着重要作用,并积极参与肺的免疫反应[36-37]。AECs由两种主要的细胞类型形成:肺泡I型细胞(alveolar epithelial type I cells,AECI)和肺泡II型细胞(alveolar epithelial type II cells,AECII)。鳞状肺泡I型细胞占据肺泡的大部分表面积(90%以上),是一种很薄的细胞,有利于机体进行气体交换,同时也非常容易受到损伤;另一种主要的细胞类型是呈立方体细胞的肺泡II型细胞,在肺泡上皮中所占比例约为10%,主要参与肺表面活性物质的合成、分泌和贮藏[38-40]。在ALI发病时,AECI主要参与促炎反应,而作为祖细胞的AECII,在肺损伤后肺泡上皮的再生过程中发挥作用,同时,免疫细胞也可以通过多种生长因子和细胞因子的分泌而受到影响[41-42]。
2.2 外泌体介导细胞间通讯缓解急性肺损伤
细胞间通讯对于多细胞生物应对和适应环境变化十分关键,通常通过细胞间直接接触或分泌可溶性介质来完成,是免疫反应的基石。20世纪60年代末,Bonucci[43]和Anderson[44]观察到软骨细胞分泌出约100 nm的小泡,并初次对这种小泡进行描述。通过使用电子显微镜观察发现,这种直径40~100 nm小泡外观呈“圆盘状”。随着研究的逐渐开展,这种由细胞主动释放的纳米级囊泡被命名为“外泌体”。外泌体是由细胞膜以出芽方式形成的多泡体,富含特定的蛋白质、核酸、脂质,几乎所有的细胞都具有分泌外泌体的能力,如网状细胞、树突状细胞、T细胞、B细胞、上皮细胞和肿瘤细胞等[45]。细胞释放出的外泌体具有多种多样的功能,如重塑细胞外基质和向其他细胞传递信号,这种细胞间的囊泡运输在维持机体健康和疾病发生发展等许多方面发挥着关键作用,包括生长发育、免疫、组织稳态、肿瘤、神经退行性疾病等[46]。研究发现,在ALI的发生发展过程中,线粒体产生的活性氧导致线粒体DNA转录缺陷和线粒体功能障碍,受损的线粒体DNA会进一步引发肺部的不良反应[47-48],而间充质干细胞衍生的外泌体将携带的线粒体转移至巨噬细胞,能够增加巨噬细胞氧化磷酸化能力,增强巨噬细胞的吞噬能力,改善LPS诱导的肺损伤[49]。同时,Silva等[50]证实,间充质干细胞衍生的外泌体转移至AECs可以缓解LPS引发的线粒体功能障碍,并恢复了AECs屏障完整性。由此可见,外泌体可能成为ALI的潜在治疗手段。
最新发现,AECs分泌的外泌体可作为细胞间交流的通讯介质,参与肺部疾病的发生发展。Chen等[51]发现,AECs通过外泌体携带的HOX反义基因间RNA髓系(Homeobox A transcript antisense RNA myeloid-specific 1,HOTAIRM1)竞争性地与肺成纤维细胞上的miR-30 d-3p结合,促进肺成纤维细胞的增殖和分化,从而加速间质肺纤维化的发生。Yu等[52]使用卵清蛋白(ovalbumin,OVA)刺激AECs产生外泌体(OAEs),OAEs可通过上调MMP14表达和裂解CD100激活巨噬细胞,从而增强中性粒细胞和单核细胞性气道炎症。此外,由AECs衍生的外泌体在哮喘性支气管炎症状态下可以诱导未分化的巨噬细胞增殖和趋化性增加[53],在治疗以肺损伤-肺纤维化为特征的气道疾病中,AECs衍生的外泌体也表现了积极的作用[54]。因此,AECs分泌的外泌体是肺部结构细胞与免疫细胞联系的重要桥梁,成为治疗肺部疾病的新方法。
2.3 肺泡上皮细胞外泌体调控巨噬细胞极化影响急性肺损伤
AMs与肺结构细胞(AECs)存在密切联系,特别是AECs能够以外泌体方式调节AMs发生极化反应[55]。Lee等[56]发现酸诱导AECs释放的微囊泡可以引起AMs发生极化反应,且在高氧条件下,AECs衍生的细胞膜囊泡可以通过miRNA激活AMs发生M1极化,介导炎症反应。Moon等[57]发现通过传递促凋亡因子天冬氨酸特异性半胱氨酸蛋白酶-3(cysteinyl aspartatespecific protease-3,Caspase-3),可使高氧诱导AECs释放的外泌体刺激AMs发生M1极化,释放大量炎症因子,从而导致肺部发生炎症反应。
作为miRNA的载体,外泌体可以将miRNA转移至相应的受体细胞,参与细胞间通讯,影响肺部微环境,调节肺部疾病的病理过程。Liu等[58]在体外使用LPS刺激AECs来模拟炎症发生,与AMs进行共培养,发现AECs分泌的外泌体可通过携带miR-92a-3p介导AECs和AMs之间的串扰,激活巨噬细胞发生M1极化,诱导肺部炎症反应的发生。除此之外,李建军等[59]发现结核分枝杆菌感染情况下,AECII来源的外泌体可通过miR-145刺激AMs向M2型极化并抑制M1型极化,对抗炎症反应。因此,人们可通过影响AECs外泌体携带的miRNA来调控巨噬细胞的极化方向,从而减轻ALI的损伤程度(图1)。
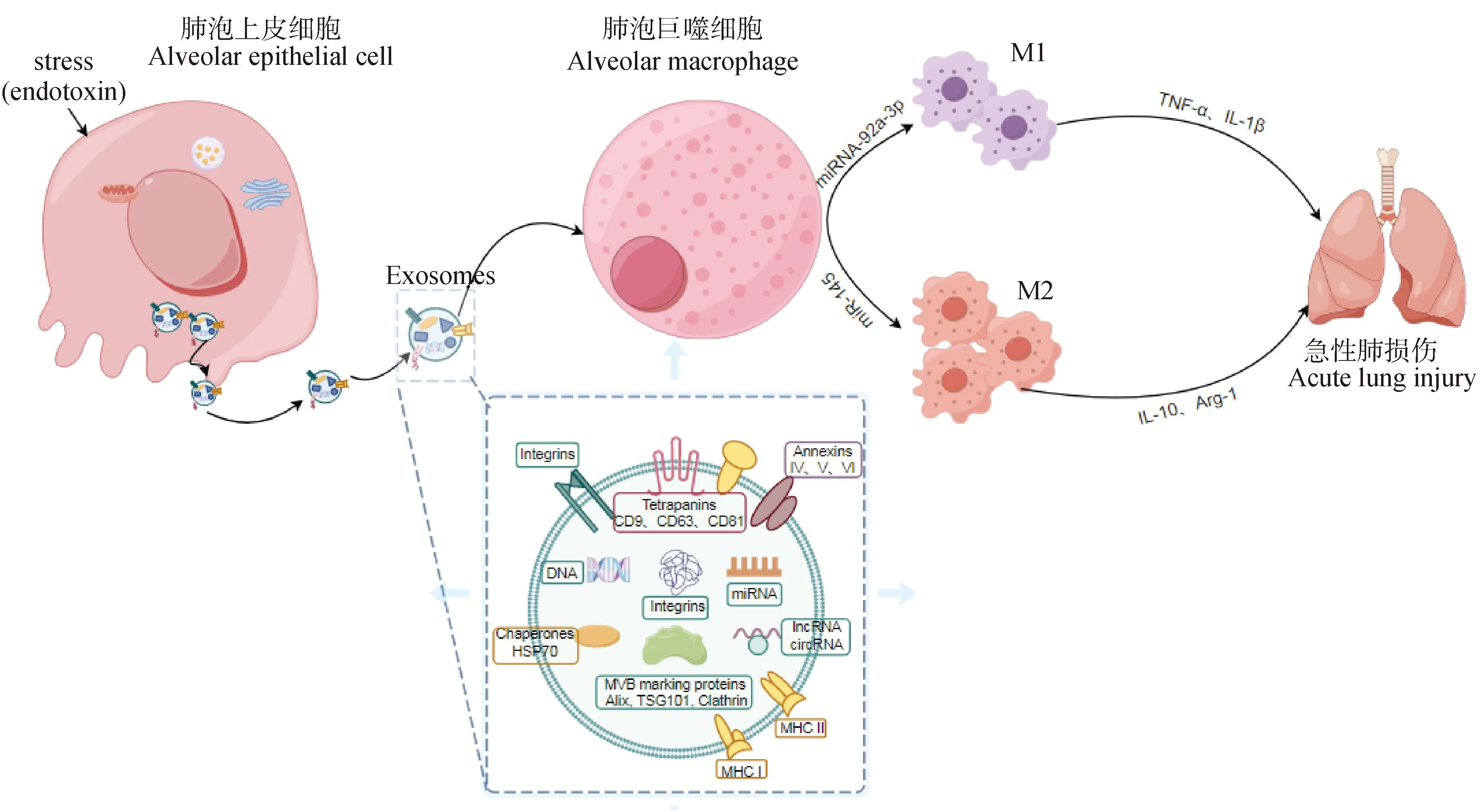
图1 肺泡上皮细胞分泌的外泌体调控巨噬细胞极化在急性肺损伤中的作用[本文图片使用在线绘图软件科研者之家(https://www.home-for-researchers.com/static/index.html)绘制]Fig.1 Role of exosomes secreted by alveolar epithelial cells in regulating macrophage polarization in acute lung injury[The images in this article are drew by using the online drawing software HOME for Researchers(https://www.home-for-researchers.com/static/index.html)]
此外,AMs对AECs的功能调节也可以通过外泌体来进行。研究表明,AMs源性的外泌体中含有与细胞因子信号传导有关的抑制蛋白(suppressor of cytokine signaling,SOCS),该蛋白可抑制炎症性转录激活因子(signal transducer and activator of transcription,STAT)信号通路[60]。AECs几乎不表达SOCS蛋白,但AECs分泌的前列腺素E2和IL-10,可增加AMs含SOCS蛋白的外泌体分泌,含有SOCS蛋白的外泌体被AECs摄取并下调细胞因子诱导的STAT活化,维持AECs处于静止状态并限制正常AECs的恶性发展[61]。因此,在AECs与AMs之间的信息交流中,外泌体可以作为一个重要的介质,从而对肺部的炎症起到调节作用。
3 小结与展望
ALI是一种严重且潜在致命的急性炎症性肺部疾病,控制“炎症因子风暴”是控制该疾病发生发展的关键。相关研究表明,来源AECs的外泌体可作用于肺组织中的结构细胞,介导肺部疾病的发病,而AMs是肺组织中主要的免疫细胞,AMs极化又是启动ALI炎症反应的关键调节因子。因此,通过调控AECs释放的外泌体成分影响AMs极化,可调控炎症反应,有望为ALI治疗开辟新思路。
