不同果型西瓜单倍体诱导技术优化
2024-02-01戴玉娟龚诗琦孙翔宇陈浩杰熊程孙小武戴思慧
戴玉娟 龚诗琦 孙翔宇 陈浩杰 熊程 孙小武 戴思慧







摘 要:西瓜未受精子房离体培养是诱导单倍体的有效方法,可缩短育种时间。为建立高效稳定的单倍体诱导体系,提高单倍体诱导率,以大果型品种雪龙1号、雪龙3号,中果型品种早蜜、红都2号和小果型品种小玉9号和黄小玉的6个杂交一代(2n=2x=22)西瓜的未受精子房为试验材料,研究不同植物生长调节剂种类和质量浓度对西瓜单倍体诱导率的影响。结果表明,6个不同基因型品种在2 mg·L-1 6-BA+1 mg·L-1 NAA和2 mg·L-1 6-BA+2 mg·L-1 NAA的诱导培养基中均能诱导出胚状体,除黄小玉以外,均获得了单倍体再生植株;其中,红都2号的胚状体诱导率最高,達63.89%;其次是早蜜,诱导率为55.56%。
关键词:西瓜;植物生长调节剂;单倍体诱导
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2024)01-018-07
Optimisation of haploid induction techniques in watermelon with different fruit types
DAI Yujuan, GONG Shiqi, SUN Xiangyu, CHEN Haojie, XIONG Cheng, SUN Xiaowu, DAI Sihui
(Engineering Research Center for Horticultural Crop Germplasm Creation and New Variety Breeding, Ministry of Education/College of Horticulture, Hunan Agricultural University , Changsha 410128, Hunan, China)
Abstract: Unfertilized ovary culture of watermelon is an effective method to induce haploids, which can shorten the breeding time. In order to establish an efficient and stable haploid induction system and improve the haploid induction rate, the unfertilized ovaries of six watermelon hybrids(2n=2x=22)of large-fruited variety Xuelong 1 and Xuelong 3, medium-fruited variety Zaomi, Hongdu 2, and small-fruited variety Xiaoyu 9, Huangxiaoyu were used as experimental materials. The effects of different plant growth regulators on the haploid induction rate of watermelon were studied . The results showed that six different genotypes of watermelon were induced in the induction medium 2 mg·L-1 6-BA+1 mg·L-1 NAA, 2 mg·L-1 6-BA + 2 mg·L-1 NAA, and haploid regeneration plants were obtained except for Huangxiaoyu. Among them, Hongdu 2 had the highest induction rate of 63.89%, followed by Zaomi with an induction rate of 55.56%.
Key words: Watermelon; Plant growth regulator; Haploid induction
西瓜(Citrullus lanatus)是中国重要的园艺作物,也是夏季主要的消暑果品之一,在全世界广泛种植。传统的西瓜育种周期长,很难产生突破性品种,获得纯合自交系需要6代以上,而双单倍体育种只需要2代。利用单倍体技术还能迅速获得个体完全纯合的双单倍体群体,为遗传分析、分子标记和数量性状分析提供理想材料。但西瓜单倍体的自然发生率低[1],雌核离体培养是一个有效的途径。
目前单倍体诱导技术已在黄瓜[2-3]、南瓜[4-5]、大葱[6]、洋葱[7]等蔬菜作物上广泛应用,在西瓜[8-13]上的应用也有报道,并已建立完整的诱导体系。Zou等[9]以中果型西瓜品种早佳为供体,通过雌核发育途径获得了西瓜单倍体植株,胚状体诱导率最高为20.67%,并选取了50株再生植株进行倍性鉴定,单倍体率为96%,二倍体率为4%,未发现四倍体与嵌合体。龚思等[10]以中果型西瓜早佳的未受精子房为试材,对影响西瓜未受精子房离体培养的条件进行了研究,发现单倍体胚状体诱导率为21.33%;其中单倍体率97%、二倍体率3%,这与Zou等[9]在西瓜单倍体培养试验中再生植株的倍性鉴定结果基本一致。李玲等[11]以大果型西瓜品种西农9号和小果型西瓜品种早春红玉、小绿黄为供体,芽点诱导率最高为17.2%,仅早春红玉获得了再生植株。李迎迎[12]以3个大果型和1个特大果型西瓜品种为试材,胚状体诱导率最高仅1.67%,且未获得单倍体再生植株。目前未见到以大、中、小3种果型在相同植物生长调节剂配方中均能诱导出单倍体植株的报道,且西瓜未受精子房诱导单倍体的研究所采用的主要材料大多为单一果型品种,虽已获得再生单倍体植株,但诱导率仍然较低[8-13]。
针对上述问题,笔者以6个不同基因型的大、中、小果型西瓜品种为试材,研究不同植物生长调节剂种类和质量浓度对西瓜单倍体诱导率的影响,并对获得的再生植株进行了倍性鉴定,以期筛选到能够诱导大、中、小3种果型的诱导培养基,建立高效稳定的西瓜单倍体诱导体系,为西瓜单倍体育种提供技术支持。
1 材料与方法
1.1 材料
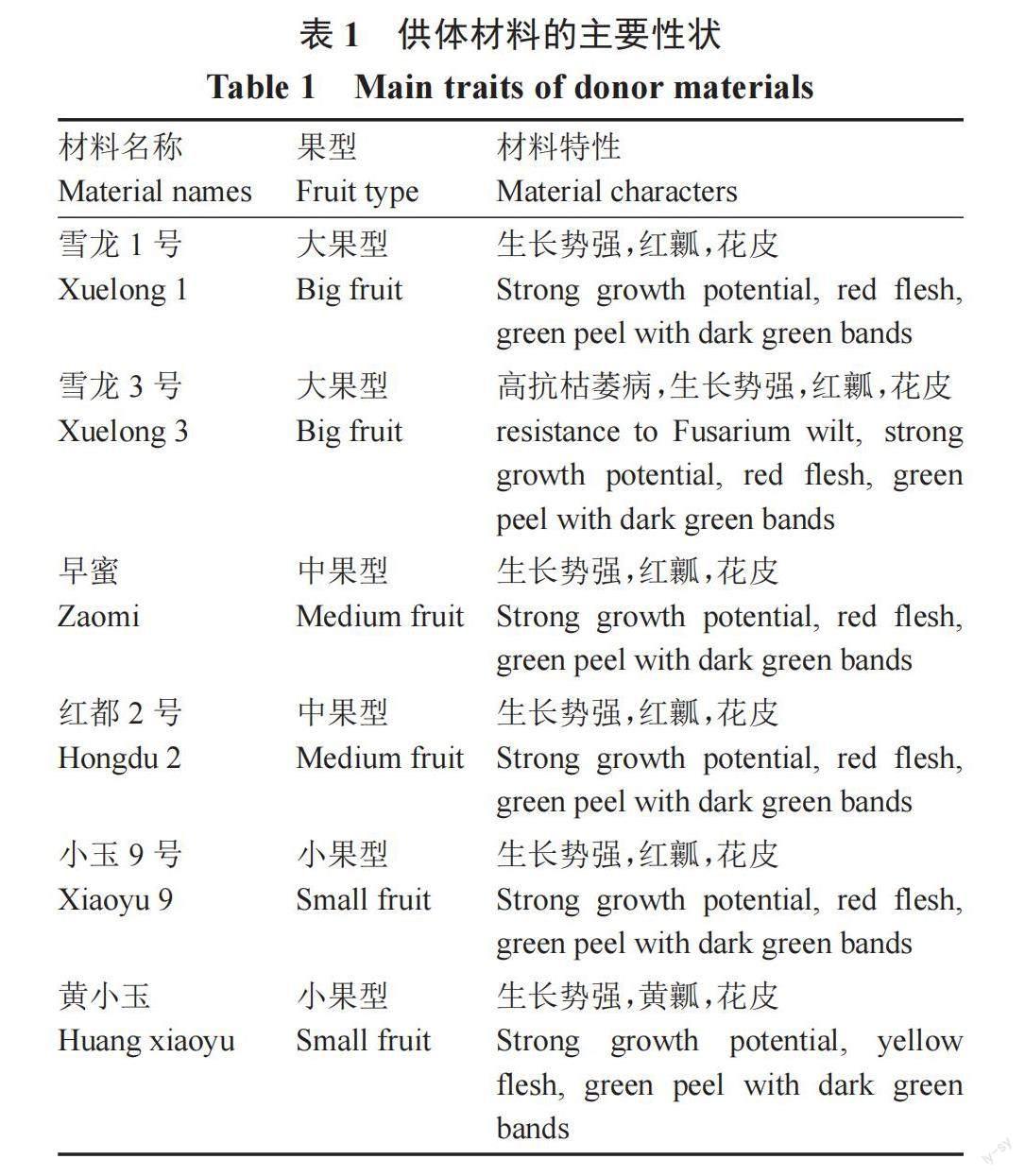
试验材料包括大果型西瓜品种雪龙1号、雪龙3号,中果型西瓜品种早蜜、红都2号和小果型西瓜品种小玉9号、黄小玉,品种均为杂交一代材料(2n=2x=22),由湖南雪峰种业责任有限公司提供,材料特点见表1和图1。试验于2022年3月至2023年6月在湖南农业大学园艺学院实验室及金山基地进行。
1.2 方法
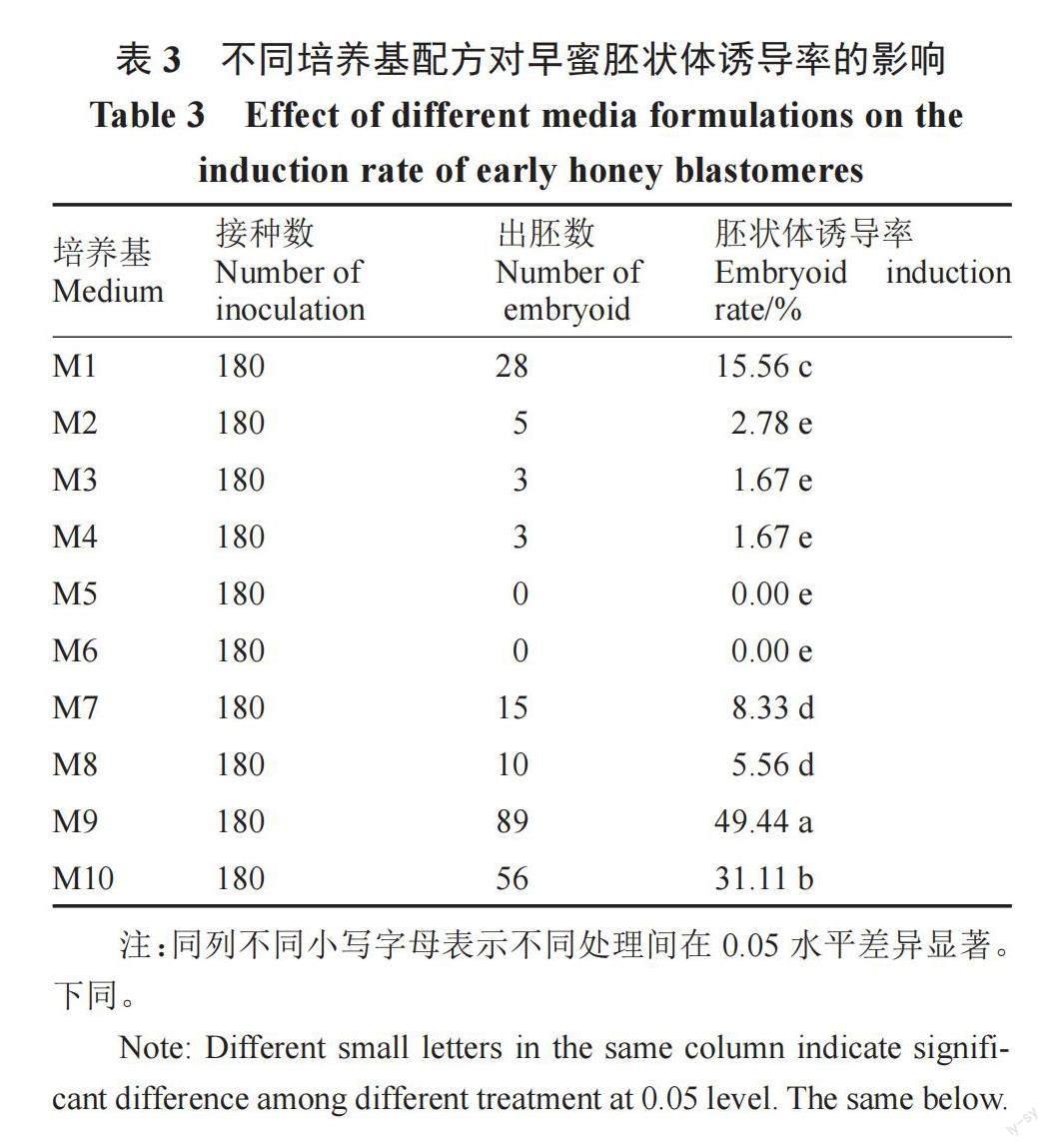
1.2.1 未受精子房离体培养与植株再生 参照Zou等[9]的方法进行子房处理。在第2朵雌花开放后采收子房,开花前一天17:00套袋,开花当天08:00前取回,取回的材料立即处理或放在4 ℃冰箱保存。首先去掉子房的花蕾和花茎,并冲洗干净表面的绒毛;然后用75%的乙醇消毒1 min、蒸馏水冲洗3次后,将子房去皮,切成1 mm左右的切片;再用1%的次氯酸钠溶液消毒1 min,蒸馏水冲洗4次;最后将切片放在无菌滤纸上吸干水分,接种至诱导培养基中培养。将中果型早蜜的子房切片接种到M1~M10诱导培养基上,研究不同培养基配方对早蜜胚状体诱导率的影响。将6个不同基因型的子房切片接种到M1、M7、M8、M9、M10等5个诱导培养基上,研究不同基因型对胚状体诱导率的影响。每个处理接种3瓶并设置3次重复,每瓶接种20片。
前4 d将接种后的培养瓶放在33 ℃的黑暗环境下进行热激处理,第5 天轉至培养室中培养,温度为25 ℃,光周期为16 h/8 h(光/暗)。经过14 d的诱导培养,将子房切片转至分化培养基中,大约35 d诱导出胚状体,胚状体诱导率/%=出胚数/接种片数×100。最后将有明显形态学上端和下端的胚状体转至MS培养基中,直至生长成完整的再生植株。再生植株率/%=完整再生植株数/出胚数×100。
单倍体诱导过程中的具体培养基配方见表2。
1.2.2 流式细胞仪检测 用刀片取0.5 cm2的再生植株幼叶,置于培养皿中,取400 µL Partec CyStain UV Precise P裂解冲液涂在叶片周围,用刀片将叶片切碎,充分提取出完整的细胞核,提取时间约为10 s,随后用后30 µm滤网过滤至样品管中,再用1600 µL的Partec CyStain UV Precise P染液染色10 s,最后用Partec CyFlow Space检测悬浮液的核DNA相对含量。样本峰值的荧光强度X-Mean(横坐标)与细胞DNA含量成正比,所以由各样本X-Mean之间的比例关系判断倍性。用二倍体(2n=2x=22)的西瓜植株为参考标准,将对照的二倍体峰调整在横坐标100位置,则单倍体峰值会出现在50,而峰值在200位置的则为四倍体。图形的纵坐标代表细胞数量,峰的高低反映了细胞比例的不同。
1.3 数据处理
采用SPSS 26.0与Excel 2019软件进行试验数据处理和统计分析。
2 结果与分析
2.1 胚状体发育及诱导成苗过程
子房切片在33 ℃的黑暗环境下热激4 d后,胚珠明显膨大(图2-a),再经过5 d的光照培养,膨大的胚珠变绿(图2-b)。培养35 d左右,胚状体长出明显的形态学上端和下端(图2-c)时转接至MS生根培养基中,生长成完整的再生植株(图2-d)。
2.2 不同培养基配方对早蜜胚状体诱导率的影响
由表3可知,早蜜在不同培养基配方中胚状体诱导率由高到低依次为M9>M10>M1>M7>M8>M2>M3、M4>M5、M6,其中M9配方胚状体诱导率最高,达49.44%,与其余9个配方呈显著差异;选用5个诱导效果较好的培养基配方进行下一步试验,即M1、M7、M8、M9、M10。
2.3 不同基因型对西瓜未受精子房胚状体诱导率的影响
由表4可知,所选用的6个不同基因型材料都能诱导出胚状体,但不同基因型之间的胚状体诱导率存在较大差异,在0~63.89%之间。大果型雪龙1号和雪龙3号胚状体诱导率最高分别为6.11%和8.89%;中果型红都2号和早蜜的诱导率最高分别为63.89%和55.56%;小果型小玉9号和黄小玉的胚状体诱导率最高分别为1.11%和2.22%。整体来看,中果型品种胚状体诱导率较高,其次是大果型品种,小果型品种的诱导率最低,其中黄小玉仅在M9和M10培养基上成功诱导出胚状体。
2.4 不同植物生长调节剂配方对西瓜未受精子房胚状体诱导率的影响
由表4可知,5种诱导培养基均能诱导出胚状体,其中M9和M10能诱导出大、中、小3种果型的胚状体,但胚状体诱导率差异大。大果型品种雪龙1号在M10中胚状体诱导率最高(6.11%),雪龙3号在M9中胚状体诱导率最高(8.89%),但均与其他诱导培养基之间无显著差异。中果型品种红都2号在M10中胚状体诱导率最高,达63.89%,M9中诱导率为43.80%,均与M1、M7、M8培养基呈显著差异;中果型品种早蜜在M9中胚状体诱导率最高,达55.56%,M10中胚状体诱导率为35.56%,均与其他诱导培养基呈显著差异。小果型品种小玉9号、黄小玉在M9中的胚状体诱导率分别为1.11%和2.22%,均与其他诱导培养基无显著差异。
2.5 胚状体成苗情况
通过对胚状体后期生长状况的观察与记录,发现部分发育不完全的胚状体(图3),包括无生长点植株、黄化苗、玻璃化植株和生长缓慢植株4种类型。共成功诱导胚状体517个,产生完整再生植株233株,再生植株率为45.07%,见表5。整体来看,2个中果型品种在5个再生培养基上均能获得完整的再生植株,再生植株率较高,其中早蜜的再生植株率在36.36%~52.00%,红都2号的再生植株率在11.11%~60.00%;大果型和小果型品种虽有一定的再生植株率,但本身出胚数较少,再生植株率没有统计学上的意义。
2.6 流式细胞仪倍性鉴定
对得到的233株再生植株,利用流式细胞仪对其中的50株进行倍性鉴定(图4)。结果表明,47株为单倍体,3株为二倍体,单倍体率为94%。
3 讨论与结论
基因型已被证明是许多植物未受精子房离体培养的关键因素,如黄瓜[14-17]、南瓜[5、18]、西葫芦[19-21]等。在西瓜中,也有研究表明,基因型是影响雌核发育的关键[10-12],不同基因型的西瓜胚状体诱导率在1.67%~21.33%。在本研究中,笔者所选用的6个不同的基因型都诱导出了胚状体,但不同基因型之间的胚状体诱导率差异较大。在M9诱导培养基中,大果型西瓜品种雪龙1号和雪龙3号的诱导率分别为4.44%和8.89%,雪龙3号的诱导率是雪龙1号的2倍;中果型西瓜品种早蜜的诱导率最高(55.56%),红都2号次之(43.80%),早蜜的诱导率比红都2号高11.76个百分点;但小果型品种小玉9号和黄小玉的诱导率均偏低,分别为1.11%和2.22%。由此可见,中果型西瓜品种的胚状体诱导率均比大果型和小果型高,不同基因型的胚状体诱导率存在显著差异,也进一步说明基因型是影响西瓜未受精子房培养诱导胚状体的关键因素,与前人的研究结果一致。龚思等[10]以中果型西瓜早佳未受精子房为试材,对西瓜未受精子房的胚状体诱导率进行了研究,最高胚状体诱导率为21.33%;而本研究中红都2号的胚状体诱导率最高为63.89%,是早佳的3倍。
前人研究结果表明,不同诱导培养基的胚状体诱导率差异显著,植物生长调节剂在胚状体诱导中发挥了重要作用[9-10,22-23]。Zou等[9]在西瓜未受精子房培養中选用中果型西瓜品种早佳和黑媚娘,在MS+3 mg·L-1 2, 4-D+2 mg·L-1 6-BA+0.5 mg·L-1 NAA诱导培养基中培养,早佳的胚状体诱导率最高,为20.67%,黑媚娘的诱导率为14.72%,而在MS+3 mg·L-1 2,4-D+1 mg·L-1 6-BA+0.5 mg·L-1 NAA中,早佳和黑媚娘胚状体诱导率仅为1.67%和6.94%,说明不同植物生长调节剂的添加量是重要因素。在笔者的研究中,M9(MS+2 mg·L-1 6-BA+1 mg·L-1 NAA)和M10(MS+2 mg·L-1 6-BA+2 mg·L-1 NAA)是西瓜未受精子房诱导单倍体的最佳诱导培养基,6个不同基因型的西瓜品种在M9和M10诱导培养基中都能诱导出胚状体,当使用不同的诱导培养基时,胚状体诱导率有显著差异。以中果型为例,红都2号在M10诱导培养基中胚状体诱导率最高,达63.89%,诱导率是M1的10倍;而早蜜在M9诱导培养基中效果最好(55.56%)。本研究中,红都2号在M7(MS+1 mg·L-1 2,4-D+2 mg·L-1 6-BA+1 mg·L-1 NAA)诱导培养基的培养下,胚状体诱导率仅为6.67%,可能是添加了2,4-D的原因,这与荣文娟等[13]在未受精胚珠培养萌发的研究结果一致,认为2,4-D能有效促进愈伤组织生长,但得到的愈伤组织难以分化。
在笔者的研究中,共获得了233株再生植株,这是西瓜单倍体育种的一个很大突破。笔者利用流式细胞仪对50株再生植株进行倍性鉴定,结果表明,47株为单倍体,3株为二倍体,单倍体率为94%。在研究过程中,尽管筛选到了能够诱导大、中、小果型胚状体的培养基,但大果型和小果型品种的胚状体诱导率和再生植株率偏低,可能与基因型、诱导培养基所添加的植物生长调节剂的种类和浓度有关,且小果型品种黄小玉未获得再生单倍体植株。下一步,笔者一方面将调整植物生长调节剂的种类和浓度,以提高大、小果型品种的胚状体诱导率;另一方面,根据流式细胞仪倍性鉴定的结果,笔者将利用化学药剂(秋水仙素、氨磺乐灵等)对获得的西瓜单倍体再生植株进行染色体加倍,以获得双单倍体植株。
综上所述,笔者筛选到了适合大、中、小果型的西瓜单倍体诱导培养基,提高了西瓜单倍体诱导率,并获得了除黄小玉外的单倍体再生植株。研究结果对提高西瓜育种效率具有重要意义,有助于推进西瓜育种发展,为西瓜单倍体育种提供技术支持。
参考文献
[1] SARI N,ABAK K,PITRAT M,et al.Induction of parthenogenetic haploid embryos after pollination by irradiated pollen in watermelon[J].Hortscience,1994,29(10):1189-1190.
[2] BAKTEMUR G,KELES D,KARA E,et al.Effects of genotype and nutrient medium on obtaining haploid plants through ovary culture in cucumber[J].Molecular Biology Reports,2022,49(6):5451-5458.
[3] SORNTIP A,POOLSAWAT O,KATIVAT C,et al.Gynogenesis and doubled haploid production from unpollinated ovary culture of cucumber(Cucumis sativus L.)[J].Canadian Journal of Plant Science,2018,98(2):353-361.
[4] 张蕾琛,孙楠,王迎儿,等.南瓜未授粉子房和胚珠离体培养影响因素[J].浙江农业科学,2019,60(9):1556-1560.
[5] 闵子扬,李涵,邹甜,等.南瓜未授粉子房离体培养及植株再生[J].植物学报,2016,51(1):74-80.
[6] 陈伟,王清华,高莉敏,等.不同基因型和预处理方式对大葱离体雌核发育诱导单倍体的影响[J].山东农业科学,2020,52(4):23-26.
[7] 李威亚,潘美红,惠林冲,等.洋葱离体雌核诱导与单倍体愈伤再生体系建立的研究[J].江西农业学报,2023,35(7):68-74.
[8] 闵子扬,邹甜,阮万辉,等.西瓜离体雌核发育诱导单倍体植株再生[J].分子植物育种,2019,17(13):4404-4409.
[9] ZOU T,SU H N,WU Q,et al.Haploid induction via unfertilized ovary culture in watermelon[J].Plant Cell,Tissue and Organ Culture,2018,135(2):179-187.
[10] 龚思,梁少华,严静怡,等.西瓜未受精子房离体培养技术[J].中国瓜菜,2019,32(5):17-21.
[11] 李玲,闵子扬,童龙,等.西瓜未授粉子房的离体培养[J].中国瓜菜,2014,27(6):6-10.
[12] 李迎迎.西瓜未授粉子房离体培养技术的研究[D].郑州:河南农业大学,2017.
[13] 荣文娟,刘君璞,朱迎春,等.西瓜未受精胚珠离体培养若干影响因素的研究[J].中国瓜菜,2015,28(3):9-13.
[14] 周霞.黄瓜未授粉子房离体培养诱导单倍体的研究[D].南京:南京农业大学,2020.
[15] 周霞,张璐,周俊国,等.黄瓜未授粉子房离体培养获得胚囊再生植株[J].园艺学报,2020,47(3):455-466.
[16] 陈小鹏,刘栓桃,孙小镭,等.黄瓜未授粉子房的胚状体诱导研究初报[J].西北农业学报,2005,14(2):148-151.
[17] DIAO W P,JIA Y Y,SONG H,et al.Efficient embryo induction in cucumber ovary culture and homozygous identification of the regenerants using SSR markers[J].Scientia Horticulturae,2009,119(3):246-251.
[18] 武习习.南瓜未受精胚珠液体培养技术探究[D].陕西杨凌:西北农林科技大学,2018.
[19] 谢冰.西葫芦的离体雌核发育及植株再生[D].山东泰安:山东农业大学,2005.
[20] 徐静.西葫芦雌核离体高效培养体系的建立[D].乌鲁木齐:新疆农业大学,2007.
[21] 李伟.西葫芦未受精子房离体培养成胚条件优化与成苗技术研究[D].陕西杨凌:西北农林科技大学,2012.
[22] 刘栓桃,赵智中,孙小镭,等.西葫芦未受精胚珠离体誘导植株再生的关键因素[J].华北农学报,2008.23(2):96-100.
[23] 孙守如,章鹏,胡建斌,等.南瓜未受精胚珠的离体培养及植株再生[J].植物学报,2013.48(1):79-86.
