新型冠状病毒疫苗的研究进展*
2024-01-31陈盼杨剑肖永红
陈盼,杨剑,肖永红
(1.北京协和医学院·中国医学科学院病原生物学研究所,北京 100730;2.中国医学科学院感染病及微生态研究创新单元,北京 100730;3.浙江大学医学院附属第一医院传染病重症诊治全国重点实验室、国家感染性疾病临床医学研究中心、感染性疾病诊治协同创新中心,杭州 310003)
2019年底严重急性呼吸综合征冠状病毒 2 (severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)首次被报道以来,其引起的2019年新型冠状病毒感染(coronavirus disease 2019,COVID-19)席卷全球,给全球的公共卫生带来严重的威胁[1]。接种新型冠状病毒疫苗(简称新冠疫苗)可以刺激机体对SARS-CoV-2产生特异性免疫,在接种后至少数月内使机体保持对SARS-CoV-2的防御作用。另外,接种新冠疫苗可以在人群中形成免疫屏障,减少SARS-CoV-2在人群中的传播,保护无法接种疫苗或免疫力低下的人群。因此,为了将新冠疫情对世界人民的健康损害降到最低,多国开始积极研制和推广接种新冠疫苗,并且已经取得了不错的效果。目前,全世界完成接种的新冠疫苗已超13亿剂次[2],这为全球的新冠疫情防控工作做出了不可忽视的贡献。
截至2023年3月3日,已有39种新冠疫苗获批上市或紧急使用(表1),处于临床研究阶段的新冠疫苗有180种,处于临床前研究阶段的新冠疫苗高达199种,其中重组蛋白疫苗、病毒载体疫苗、灭活疫苗、mRNA疫苗的数量最多[3]。然而,由于疫苗免疫效果在接种后随时间逐渐下降以及变异株逃避现有疫苗的识别,维持新冠疫苗的保护效果正面临着巨大的挑战。本文主要就新冠疫苗常见类型的代表性疫苗的研究进展展开综述,以期为新冠疫苗的研发及接种工作提供参考。
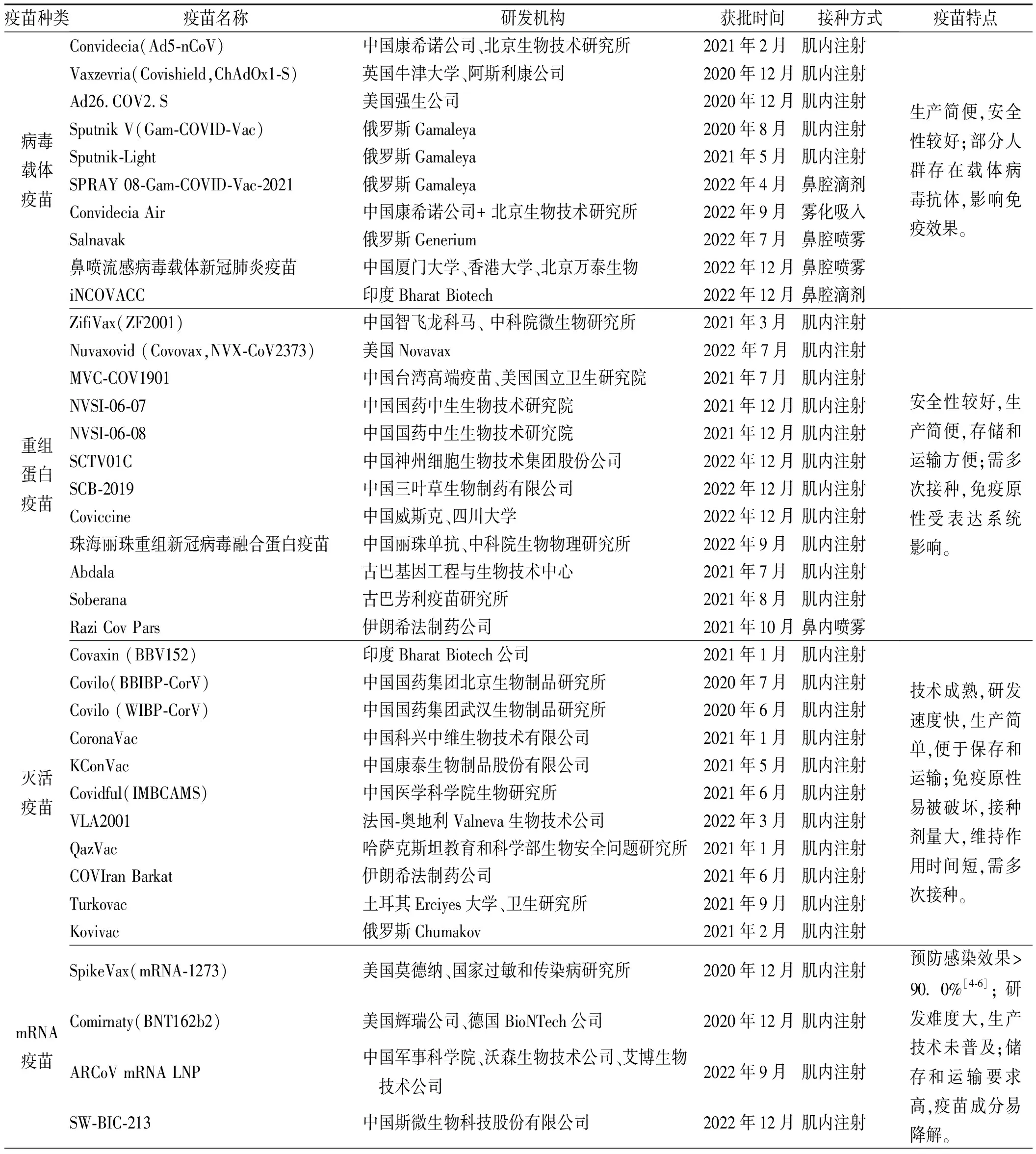
表1 全球已获批紧急使用或上市的新型冠状病毒疫苗
1 病毒载体疫苗
病毒载体疫苗将编码新冠病毒刺突蛋白的基因导入载体病毒基因组中,该病毒载体进入人类细胞后,导入的基因在人体内表达,诱导机体强烈的特异性免疫反应。目前至少有10种病毒载体疫苗已获批使用,有8种处于Ⅲ/Ⅳ期临床试验阶段[3]。
Ad5-nCoV是一种由天津康希诺公司和北京生物技术研究所研发,以复制缺陷的5型人腺病毒为载体的病毒载体疫苗。一项国际多中心的Ⅲ期试验结果发现,在成年人群中接种单剂次Ad5-nCoV后28 d,疫苗对发生有症状的COVID-19的保护率为57.5%,对发生重症COVID-19的保护率为91.7%[7]。另外,在完成全程接种的情况下,对于有SARS-CoV-2感染史的个体,Ad5-nCoV诱导的中和性抗体水平与mRNA疫苗BTN162b2类似,高于灭活疫苗CoronaVac;对于既往没有SARS-CoV-2感染史的个体,Ad5-nCoV诱导的中和性抗体水平明显低于BTN162b2,而明显高于CoronaVac组;Ad5-nCoV组中没有产生中和性抗体的接种者比例也略高于 CoronaVac组和BTN162b2组(3.57%vs.0.89%vs.0%)[8]。在奥密克戎(Omicron)流行期间,接种灭活疫苗BBIBP-CorV、WIBP-CorV和CoronaVac组对预防SARS-CoV-2感染和危重型COVID-19发生的总体有效率均略高于接种Ad5-nCoV组(16.3%vs.13.2%,88.6%vs.77.9%)[9]。由此可见,Ad5-nCoV对于保护机体感染SARS-CoV-2有一定的保护效果,但在预防重症方面保护作用更加突出。
康希诺公司随后改变药物剂型,研制出雾化吸入型Ad5-nCoV疫苗,用雾化器将疫苗变成了微小颗粒,经鼻吸入即可。在既往接种两剂CoronaVac的成年人中,使用雾化Ad5-nCoV,其免疫原型强于3剂CoronaVac注射方案,可以诱导机体产生高水平的中和性抗体,且这种更高的免疫水平可以持续至少12个月[10-11]。ZHANG等[12]对至少6个月前接种2剂灭活疫苗的个体分别强化接种肌内注射型的腺病毒疫苗Ad5-nCoV、灭活疫苗CoronaVac、重组蛋白疫苗ZF2001以及气雾型Ad5-nCoV,试验结果表明,在所有试验组中,对奥密克戎最强烈的中和抗体反应发生于强化接种气雾型Ad5-nCoV后28 d,分别是CoronaVac组的14.1倍、ZF2001组的5.6倍和注射型Ad5-nCoV组的2.0倍;对奥密克戎最强烈的干扰素-γ(interferon-γ,IFN-γ)T细胞应答反应也发生于接种气雾型Ad5-nCoV组,是CoronaVac组的12.8倍、ZF2001组的16.5倍和注射型Ad5-nCoV组的5.0倍,可见气雾型Ad5-nCoV为强化接种疫苗及控制奥密克戎传播提供新方案。雾化型Ad5-nCoV异源接种方案的免疫原性优于其他接种方案的原因可能有:①CoronaVac和ZF2001与Ad5-nCoV的作用机制不同,在激活机体免疫应答过程中发挥了协同互补的作用;②IgA在早期抵抗SARS-CoV-2感染过程中发挥着重要作用[13],雾化型Ad5-nCoV可以激活机体产生黏膜免疫和分泌型IgA,在病毒进入呼吸道时便快速阻断感染,这是通过肌内注射途径接种的疫苗所欠缺的。
在预防SARS-CoV-2感染、相关住院和死亡方面,Ad5-nCoV的保护效果略低于其他2种病毒载体疫苗ChAdOx1-S和Ad26.COV2.S(70.50%vs.80.79%vs.82.18%,72.31%vs.80.23%vs.77.33%,79.93%vs.86.81%vs.85.79%),其中ChAdOx1-S的保护效果最具优势[14]。这可能是由于疫苗所选择的载体病毒不同。Ad5-nCoV和Ad26.COV2.S分别以复制缺陷的人5型和26型腺病毒作为载体,人腺病毒在世界范围内广泛传播,这导致既往感染过人型腺病毒的个体体内可能存在特异性中和抗体,使携带SARS-CoV-2刺突蛋白基因的人型腺病毒可能无法成功感染接种者。而ChAdOx1-S采用在人群中传播较少的黑猩猩腺病毒作为载体,降低人群存在预先免疫而降低疫苗效果的可能。另外,基于一个个体同时携带人5型和26型腺病毒抗体的概率低于仅携带其中任一腺病毒抗体的概率,另一种病毒载体疫苗Sputnik V分别以人5型和26型腺病毒作为载体进行先后两次接种,这种接种方式也可以提高机体对腺病毒的免疫应答水平。
尽管ChAdOx1-S的保护效果相对于其他同类型疫苗占优势,但就安全性而言,ChAdOx1-S引起了巨大的争议。一项在美国、智利和秘鲁开展的Ⅲ期临床试验招募受试者32 451例,尽管绝大多数ChAdOx1-S接种者出现不良反应(92.6%),但均为短暂的轻中度不良反应;严重的不良反应中,深静脉血栓形成和肺栓塞发生率均<0.1%,未见血小板减少症、脑静脉窦血栓形成或异常部位的静脉血栓形成事件[15]。类似地,韩国的研究数据证实,在接种第1剂和第2剂ChAdOx1-S后分别有76.8%和74.4%的医护人员发生至少一次局部或全身不良事件,但没有一次出现危及生命的不良事件[16]。然而,多地报告ChAdOx1-S接种者出现凝血异常反应,研究指出接种 ChAdOx1-S与免疫性血小板减少症、血栓形成等风险升高有关[17]。在年轻人群和老年人群中,ChAdOx1-S和Ad26.COV2.S接种者发生由静脉血栓和出血引起的严重不良事件以及血栓栓塞性疾病的频率均高于 BNT162b2接种者,严重不良事件相关的死亡率也更高;ChAdOx1-S接种者发生血小板减少症的频率高于Ad26.COV2.S接种者[18]。同样地,CARI等[19]研究也表明,与接种BNT162b2比较,接种ChAdOx1-S发生血小板减少症、肺血栓栓塞和其他血栓形成和出血事件等严重不良事件频率要高得多。基于此,欧洲药品管理局展开调查,认为与血小板减少症相关的血栓栓塞事件是ChAdOx1-S非常罕见的副作用,调查结果显示接种ChAdOx1-S的总体获益大于风险[20];而美国疾病预防控制中心和食品药品监督管理局联合声明建议暂停使用ChAdOx1-S疫苗[21],多国也相继宣布暂停接种ChAdOx1-S。因此,关于ChAdOx1-S的安全性,还需要进一步长期的随访观察。相比于ChAdOx1-S,Ad5-nCoV在Ⅲ期试验中显示出较好的耐受性,在成年人群中接种单剂次Ad5-nCoV后28 d,注射部位疼痛(61.3%)是最常见的局部不良反应,头痛(44%)是最常见的全身不良反应[7]。
2 重组蛋白疫苗
重组蛋白疫苗利用基因工程技术将病原体靶抗原与某种表达载体蛋白相结合,在靶抗原大量表达之后纯化,注入人体后刺激机体产生免疫应答,常常需要佐剂增强免疫应答。目前至少有12种重组蛋白疫苗已获批使用,有24种处于Ⅲ/Ⅳ期临床试验阶段[3]。
NVX-CoV2373由Novavax公司开发,以重组纳米颗粒刺突蛋白作为抗原,以独特的Matrix-M作为佐剂[22]。FORMICA等[23]研究发现在澳大利亚和美国的年轻人群和老年人群中接种NVX-CoV2373均可以诱导产生稳定水平的中和性抗体,血清转化率至少达到96%。类似地,日本成年人群接种2剂NVX-CoV2373后2周血清内中和性抗体几何平均滴度(geometric mean titer,GMT)达到峰值,血清转化率达到100%,大多数不良反应为轻度或中度,并在接种后约3 d消退[24]。从保护效果持续时间来看,NVX-CoV2373也表现良好。一项对包括NVX-CoV2373、Ad26.COV2.S、BNT162b2和mRNA-1273的新冠疫苗比较研究中,在免疫接种后6个月,NVX-CoV2373诱导的中和抗体GMT是Ad2.COV6.S的2.6倍,与BNT162b2相当,略低于mRNA-1273[25]。在平均接种4.5个月后,疫苗预防SARS-CoV-2感染的保护率为82.7%,对发生重症COVID-19的保护率高达100%[26]。这略优于另一款重组蛋白疫苗ZF2001,在成年人完全接种ZF2001后至少6个月内,ZF2001对于预防有症状的SARS-CoV-2感染、重症及危重症COVID-19的保护率分别为75.7%和87.6%[27]。
目前关于NVX-CoV2373预防SARS-CoV-2变异株感染的研究多与Alpha及Beta相关,关于奥密克戎的研究数据相对较少。在南非 B.1.351流行期间,NVX-CoV2373预防健康人群感染SARS-CoV-2的保护率为60.1%[28]。在英国开展的一项15 187例受试者参与的随机对照试验发现,对于成年受试者,接种2剂NVX-CoV2373对预防SARS-CoV-2感染具有89.7%的保护作用,未报告有COVID-19相关住院及死亡事件,并对英国当时广泛传播的B.1.1.7变异株的保护率达86.3%[29]。这与在美国、墨西哥开展的临床试验研究结果相一致,接种NVX-CoV2373后3个月,疫苗对预防SARS-CoV-2感染的保护率为90.4%,其中对预防Alpha感染的保护率为93.6%[30]。
3 灭活疫苗
灭活疫苗是一种发展较为成熟的疫苗制备技术,通过理化手段使病原体丧失致病性,但仍然保持免疫原性,刺激机体产生免疫反应,安全性较好。灭活疫苗是我国接种最广泛的新冠疫苗种类[33]。目前至少有11种灭活疫苗已获批使用,有13种处于Ⅲ/Ⅳ期临床试验阶段[3]。
BBIBP-CorV是由中国国药集团北京生物制品研究所研发的灭活疫苗,以氢氧化铝为佐剂,是我国最早获批紧急使用的疫苗之一。一项阿根廷的研究表明,接种2剂BBIBP-CorV对预防SARS-CoV-2感染和发生重症均有明显的保护效果,对预防相关死亡的疫苗有效性达85.0%[34]。另一项摩洛哥的研究也证实,在接种BBIBP-CorV后的前4个月内,疫苗对预防COVID-19相关住院的有效性始终保持在较高水平(分别为88%、87%、87%、85%),第5个月和第6个月有所下降,但仍保持>60%[35]。针对阿布扎比地区≥19岁人群的研究数据显示,接种2剂次BBIBP-CorV对于预防COVID-19相关住院、重症监护和死亡的有效性分别为80%、92%和97%[36]。类似地,另外一种灭活疫苗CoronaVac在预防重症方面也有较好的表现。在18~59岁人群中接种CoronaVac可以预防有症状的COVID-19(83.5%)和相关住院事件(100%);在 3~5岁儿童中对发生有症状的COVID-19、相关住院和重症监护的保护效果分别为38.2%、64.6%和69.0%[37-38]。
灭活疫苗在预防COVID-19相关重症与死亡方面的保护效果更显著可能是因为其作用靶点不局限于刺突蛋白,并且能激活较强的细胞免疫反应。PETROVIC等[39]发现完全接种BNT162b2和BBIBP-CorV后28 d均可提供强大的免疫反应和刺激血清抗体转化,但接种BBIBP-CorV所产生的中和性抗体GMT低于接种BNT162b2(72.74vs.216.55)。在VALYI-NAGY等[40]开展的一项研究中也观察到类似的结果,在既往无感染史者中接种BNT162b2可以诱导比BBIBP-CorV更强烈的体液免疫;在既往感染者中接种BBIBP-CorV组仅有40%在第1剂后出现强烈的血清反应,而在接种BNT162b2组这一比例达到100%。然而,这并不意味着BBIBP-CorV的免疫原性低于BNT162b2,因为接种2剂次BBIBP-CorV个体的血清转化率同样达到100%。另外,该研究还观察到,BBIBP-CorV不仅可以诱导抗刺突蛋白的T淋巴细胞反应,还可以诱导T淋巴细胞对未编码在BNT162b2中的其他结构蛋白的免疫应答。同样地,对于CoronaVac,MOK等[41]比较其与BNT162b2在中国香港地区成年人群中完全接种时产生的免疫应答水平。蚀斑减少中和试验发现BNT162b2组使蚀斑数减少 50%的血清抗体滴度水平明显高于CoronaVac(251.60vs.69.45),但CoronaVac诱导的针对结构蛋白的细胞免疫水平高于BNT162b2。这与VALYI-NAGY等研究结果相一致,尽管BNT162b2可以诱导比CoronaVac更强烈的体液免疫,但CoronaVac还可以诱导针对刺突蛋白以及其他结构蛋白的细胞免疫反应。一般来说,体液免疫的强度与预防SARS-CoV-2感染的保护效果正相关,细胞免疫则在预防发生重型COVID-19方面起着主导作用[42]。因此,这2项研究提示,灭活疫苗不仅可以针对刺突蛋白和其他结构蛋白发挥更广泛的保护效果,降低变异株发生免疫逃逸的可能性,还可以通过刺激机体产生更强的细胞免疫,降低发生严重的COVID-19的风险。
4 mRNA疫苗
mRNA疫苗是将被包裹的编码病原体靶蛋白的mRNA直接注射到人体内,该段mRNA可以在宿主细胞稳定地表达靶蛋白,刺激机体产生强烈的体液免疫和细胞免疫[43-44]。绝大多数使用及研发中的新冠mRNA疫苗在宿主体内表达刺突蛋白,由脂质纳米颗粒递送[43,45]。目前至少有4种mRNA疫苗已获批使用,有10种处于Ⅲ/Ⅳ期临床试验阶段[3]。
mRNA-1273是由美国莫德纳公司及国家过敏和传染病研究所研发的mRNA疫苗。BADEN等[4,46]发现,mRNA-1273的保护效力为94.1%,显著降低有症状的COVID-19的发生率,其诱导的体液免疫可以至少持续存在6 个月。墨西哥的一项纳入约500万人的大型研究对BNT162b2、mRNA-1273、Sputnik V、Ad5-nCoV、Ad26.COV2.S、ChAdOx1-S和CoronaVac的保护效果进行比较,结果显示在完全接种的情况下,就预防SARS-CoV-2感染而言,mRNA-1273的保护率最高,并明显高于BNT162b2(91.5%vs.80.34%);就预防COVID-19相关住院而言,mRNA-1273的保护效果一般,均低于BNT162b2、Sputnik V、ChAdOx1-S(78.00%vs.84.3%vs.81.3%vs.80.2%);就预防COVID-19相关死亡而言,mRNA-1273和BNT162b2的保护率最高且相似(93.5%vs.89.8%)[14]。ROMERO-IBARGUENGOITIA等[47]开展的多国研究同样针对这7种疫苗展开比较,结果发现在有和无SARS-CoV-2感染史的人群中,除了有感染史且接种Sputnik V者组的抗体滴度高于BNT162b2组以外,接种mRNA-1273和BNT162b2后产生的中和性抗体GMT均明显高于其他疫苗,其中mRNA-1273明显高于BNT162b2(4 950.0vs.2 630.0,1 875.0vs.998.0)。然而,一项在美国6个州开展的前瞻性对照试验中,将接种第2剂后至少14 d者分为完全接种组,将未接种者、第1剂后至少14 d者、第2剂后不满14 d者及其他疫苗接种情况不确定者分为不完全接种组。结果表明,不完全接种组中BNT162b2和mRNA-1273的疫苗效力分别为80%和83%,完全接种组则分别为93%和82%[48],在该项研究中,接种BNT162b2的保护效果略优于mRNA-1273。
有研究指出,mRNA-1273和BNT162b2接种者体内的中和性抗体均可以持续至少6个月,保护效果较持久[49]。2种疫苗的IgG水平均在第6周达到峰值,mRNA-1273的IgG滴度水平在接种两剂后第14—20天、第42—48天和第70—83天更高,BNT162b2则仅在第28~34天更高[50]。尽管mRNA疫苗的有效性都会随着时间的推移而逐渐下降,但这对于BNT162b2尤其明显[51]。另有报道,与 BNT162b2比较,接种 mRNA-1273发生突破性感染的可能性更低。一份接种2剂mRNA疫苗的6个月随访数据显示,mRNA-1273接种组突破性感染的累积发生率为0.59%,BNT162b2接种组突破性感染的累积发生率为0.84%[52]。
在防御变异株方面,TANG等[53]发现,接种第2剂mRNA疫苗至少14 d后,mRNA-1273对于预防任何有症状或无症状的Delta感染以及相关重症的有效性均明显高于BNT162b2(73.1%vs.51.9%,96.1%vs.93.4%)。另有研究表明,对于 Delta假病毒,mRNA-1273、BNT162b2和Ad26.COV2.S诱导产生的中和性抗体GMT相对于野生型均有不同程度地降低,在最近接种初始或加强疫苗和先前感染的接种者中Delta中和性抗体仅略有减少;而在对于奥密克戎假病毒的所有分组中,3种疫苗诱导产生的中和性抗体GMT相对于野生型均发生显著降低,其中最近接种强化疫苗者的GMT降低幅度同样最小,mRNA-1273、BNT162b2和Ad26.COV2.S分别降低了2倍、4倍和13倍[54]。这与WILLETT等[55]研究结果类似,完全接种BNT162b2及mRNA-1273对奥密克戎的疫苗效力均明显低于Delta(26.02%vs.83.55%,23.70%vs.87.82%)。mRNA疫苗对预防Delta感染不仅在保护率上优于奥密克戎,在保护效果持久性方面也明显优于奥密克戎。完全接种mRNA疫苗14~90 d后疫苗对预防Delta感染的保护率为80.2%,在91~180 d、181~270 d和超过270 d后分别下降至68.9%、63.7%和61.3%;相比之下,对奥密克戎的保护效果更差且下降更明显,在完成接种14~90 d、91~180 d和181~270 d后疫苗对预防奥密克戎感染的保护率分别为44.0%、23.5%和13.8%,超过270 d后保护率仅为5.9%[56]。因此,mRNA的疫苗可有效诱导机体对SARS-CoV-2野生型和Delta变异株的体液免疫,但对奥密克戎变异株的保护效果欠佳且作用不持久。
从现有的研究来看,在预防SARS-CoV-2野生株及变异株感染和疫苗保护作用持久性方面,mRNA-1273比BNT162b2更具优势。这可能是因为mRNA-1273能递送更多的mRNA(100 μgvs.30 μg),能刺激机体产生更多的特异性IgG抗体[52]。
总而言之,相比于其他疫苗,mRNA疫苗对于预防SARS-CoV-2野生型和变异株感染以及对COVID-19相关的住院和死亡均有较好的保护效果。与此同时,mRNA疫苗在Ⅲ期临床试验中安全性良好,绝大多数接种者出现短暂的轻微的不良反应,一般不超过24 h,严重不良事件的发生率较低[4-5],是目前总体效果最好、应用最广泛的疫苗之一。
5 结论
在目前已获批紧急使用或上市的疫苗中,mRNA疫苗在预防野生株和变异株感染方面均表现出明显的优势,其中mRNA-1273的保护效果略优于BNT162b2,保护效果一般可以持续至少6个月,是目前世界应用最广泛的新冠疫苗之一;相比于预防SARS-CoV-2感染,病毒载体疫苗、重组蛋白疫苗和灭活疫苗在预防COVID-19相关重症及死亡方面的保护效果更为突出,且运输保存要求低于mRNA疫苗,有利于普及接种;我国研发的雾化吸入型Ad5-nCoV可显著增强机体免疫应答反应,互补的作用机制以及优化的接种方式为新冠疫苗研制工作提供了新方案。就安全性而言,除了ChAdOx1-S在凝血相关不良反应方面仍有争议以外,绝大多数新冠疫苗的安全性良好,最常见的不良反应为注射部位疼痛、发热、乏力等,症状多为轻中度且一般在1~3 d自行消退。
然而,目前尚无理想的新冠疫苗。理想的新冠疫苗应该具备以下条件:①对人群具有显著的保护效力,持续时间较长;②技术成熟,安全性好;③可以进行大规模的快速的工业生产;④稳定性好,易于运输和储存;⑤给药方式简便,最好是单剂次;⑥可以修改靶点,以灵活应对变异株。现有的疫苗正面临着变异株逃避免疫和持久性有限的挑战,未来可以考虑采取强化接种、异源接种、经鼻腔接种以及开发多价疫苗等措施来提高新冠疫苗对机体的保护效果。
