超高效液相色谱-串联质谱法测定奈玛特韦及利托那韦血药浓度*
2024-01-31范菁唐昊翔王银辉范炜斌谢姣林彬
范菁,唐昊翔,王银辉,范炜斌,谢姣,林彬
(1.浙江省长兴县人民医院药学部,长兴 313100;2.湖州市智能药学与个体化治疗重点实验室,长兴 313100;3.浙江省长兴县疾病预防控制中心,长兴 313100;4.西安交通大学附属第二医院药学部,西安 710004)
2021年奈玛特韦片/利托那韦片组合包装上市,根据公司发布的临床数据表明,其可大大降低轻度或中度新型冠状病毒感染(简称新冠)患者的住院或死亡风险,为新冠患者治疗带来曙光,引起业内的高度关注[1]。2022年12月奈玛特韦片/利托那韦片组合包装作为新型抗新冠病毒药物被写入《新型冠状病毒感染诊疗方案(试行第十版)》,用于新冠患者的治疗[2-3]。其中奈玛特韦是新型冠状病毒SARS-CoV-2主要蛋白酶抑制剂,它能够通过阻断病毒多蛋白前体的加工,从而阻止病毒复制。利托那韦作为CYP3A的抑制剂,与奈玛特韦联合应用时,可防止奈玛特韦过早的代谢失活,从而提高奈玛特韦在患者体内的药物浓度[4-5]。当奈玛特韦/利托那韦与通过该途径代谢的药物联合使用时,会影响其疗效或增加不良反应的发生风险。为了避免药物之间的相互作用,明确奈玛特韦、利托那韦在患者体内的血药浓度十分重要[6]。因此,使用奈玛特韦/利托那韦治疗的患者,建议进行药物浓度监测,对提高临床疗效和降低不良反应具有重要意义。
截至2023年5月,超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spec-tormetry,UPLC-MS/MS)法用于患者体内奈玛特韦/利托那韦血药浓度检测方法学的报道有2篇,但测定方法存在样本处理复杂、样本分析时间过长等,无法满足临床大样本检测[7-8]。本文建立UPLC-MS/MS检测奈玛特韦/利托那韦的血药浓度,为新冠患者的治疗药物监测以及药动学相关研究提供方法学基础。
1 材料与方法
1.1仪器 质谱仪(型号:Xevo TQ-S cronos,美国沃特世公司);超高效液相色谱仪(型号:H-Class Plus,美国沃特世公司);台式高速冷冻离心机(型号:5424R,德国艾本德公司),旋涡混匀器(型号:VORTEX-3,德国艾卡公司),电子分析天平(型号:BSA-124S,德国赛多利斯公司,感量:0.1 mg)。
1.2药品与试剂 奈玛特韦对照品(上海源叶生物科技有限公司,批号:N17HS201609,含量≥98%);利托那韦对照品(中检院标准物质有限公司,批号:F1503111,含量≥99%);奈玛特韦-D9内标[岛津(上海)有限公司,批号:DD023-221A1,含量≥98%];13C,2H3-利托那韦内标[岛津(上海)有限公司,批号:155216-67-5,含量≥98%],甲酸、乙腈、甲醇溶液(色谱级,美国西格玛公司)。
1.3液相色谱条件 色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×50 mm,1.7μm);流动相:A相为100%乙腈,B相为0.1%甲酸,流速:0.3mL·min-1;色谱柱温:45 ℃;进样量:2 μL,梯度洗脱条件见表1。
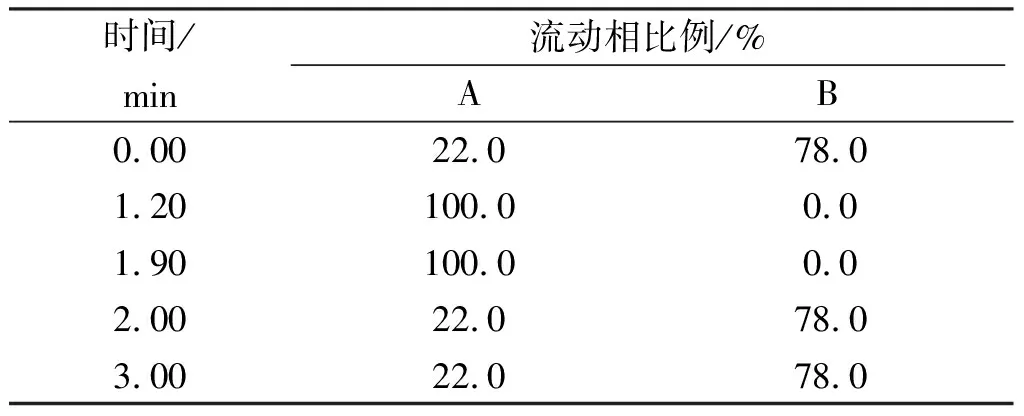
表1 梯度洗脱程序
1.4质谱条件 离子源电喷雾离子(ESI+)模式;毛细管电压:3 000 V;去溶剂化温度:350 ℃;氮气(nitrogen,N2)流速600 L·h-1;扫描方式为MRM模式,奈玛特韦、利托那韦及相应内标的其他质谱检测数据见表2。

表2 奈玛特韦和利托那韦及内标的质谱检测参数
1.5储备液及工作液的配制 精密称取奈玛特韦及利托那韦对照品适量,奈玛特韦及其内标物奈玛特韦-D9以乙腈溶解,利托那韦及其内标13C,2H3-利托那韦以乙腈:水(50:50)溶解,将奈玛特韦及利托那韦分别制备成1.00mg·mL-1的对照品储备液。将奈玛特韦-D9及13C,2H3-利托那韦各自溶解后混合,以含有0.1%甲酸的乙腈:甲醇(3:1)稀释,得到奈玛特韦-D9及13C,2H3-利托那韦浓度分别为1.00和0.50μg·mL-1的混合内标物工作液,-20 ℃避光保存。
取奈玛特韦及利托那韦对照品储备液适量,以含有0.1%甲酸的乙腈:水(3:1)逐级稀释得到系列混合对照品工作液(奈玛特韦:100、80、50、20、10、5、1 μg·mL-1;利托那韦:50、40、20、10、5、1、0.5 μg·mL-1),质控低浓度(奈玛特韦:5 μg·mL-1;利托那韦:1 μg·mL-1)、中(奈玛特韦:10 μg·mL-1;利托那韦:10 μg·mL-1)、高(奈玛特韦:80 μg·mL-1;利托那韦:40 μg·mL-1)。
1.6标准曲线及质控品的制备 空白人血浆90 μL中加入奈玛特韦及利托那韦混合对照品工作液10 μL,配制标准曲线和质控品,标准曲线范围为奈玛特韦:10、8、5、2、1、0.5、0.1 μg·mL-1;利托那韦:5、4、2、1、0.5、0.1、0.05 μg·mL-1;质控低浓度(奈玛特韦:0.5 μg·mL-1;利托那韦:0.1 μg·mL-1)、中(奈玛特韦:1 μg·mL-1;利托那韦:1 μg·mL-1)、高(奈玛特韦:8 μg·mL-1;利托那韦:4 μg·mL-1),定量下限(奈玛特韦:0.1 μg·mL-1;利托那韦:0.05 μg·mL-1)。
1.7血浆样品处理 精密吸取血浆样品100 μL,加入混合内标工作液300 μL,涡旋混合均匀,12 000 r·min-1离心5 min,取上清液2 μL进样分析。
1.8临床应用
1.8.1患者纳入与排除标准 纳入标准:①>18岁新冠病毒核酸检测或抗原检测结果阳性;②本人或家属签署知情同意书。排除标准:①擅自中断或更改药物剂量;② 1周内服用细胞色素P450酶或P-糖蛋白抑制剂或诱导剂。
1.8.2用药方法与结果检测 收集长兴县人民医院2023年1月服用奈玛特韦片/利托那韦片治疗的新冠患者血液标本共计30例。该研究已通过长兴县人民医院伦理委员会审批[(2023)伦审药/械/研第(046号)]。30例患者均接受奈玛特韦/利托那韦口服治疗,其中奈玛特韦300 mg、利托那韦100 mg,bid。根据奈玛特韦以及利托那韦的半衰期计算,连续给药在2 d后血药浓度达稳态。于第3天给药前半小时采血,血样收集于血浆分离胶采血管中,离心,取上清液进行血浆预处理后分析检测。
2 结果
2.1方法学专属性考察 选取6份不同的空白血浆、已加入定量下限的血浆样品、来自服用奈玛特韦片/利托那韦的患者稳态谷浓度血浆样品,按血浆样本处理流程处理后进行分析检测,色谱图见图1。奈玛特韦及其内标奈玛特韦-D9的保留时间均为2.07 min,利托那韦及其内标13C,2H3-利托那韦的保留时间均为2.28 min。人血浆中内源性物质在保留时间内的响应值明显低于定量下限的20%,且不干扰目标峰的分析。

A.空白血浆;B.定量下限的血浆样品;C服用奈玛特韦/利托那韦患者的稳态谷浓度血浆样品。
2.2标准曲线与线性范围 以奈玛特韦或利托那韦的浓度为横坐标(X),血浆样品测得的峰面积与各自内标物奈玛特韦-D9或13C,2H3-利托那韦峰面积比(Y)进行线性回归并绘制标准曲线,得到奈玛特韦标准曲线方程为:Y=4.553 82X+0.223 37,r2=0.997 2,线性范围为0.1~10 μg·mL-1。利托那韦标准曲线方程为:Y=1.080 27X+0.024 901 3,r2=0.995 2,线性范围为0.05~5 μg·mL-1。奈玛特韦定量下限为0.1 μg·mL-1,利托那韦定量下限为0.05 μg·mL-1。
2.3精密度与准确度 按照血浆样品处理流程操作,分别配制定量下限、低、中、高质控4个浓度的血浆样本,每一浓度重复配制6次,分别检测。连续3 d。结果见表3。结果显示奈玛特韦与利托那韦在各质控浓度及定量下限浓度的准确度均在±10%内。奈玛特韦批内精密度范围为4.26%~9.28%,利托那韦批内精密度2.91%~6.01%,奈玛特韦批间精密度范围为4.96%~8.31%,利托那韦批间精密度4.40%~9.31%,精密度和准确度符合《中华人民共和国药典》的相关技术要求。
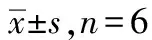
表3 奈玛特韦与利托那韦测定方法的准确度与精密度
2.4提取回收率 在3个质控浓度(低、中、高)下,评价奈玛特韦以及利托那韦的提取回收率。将各质控浓度的血浆样本处理后进样分析得到峰面积A。另取空白血浆按血浆处理流程,将混合内标工作液替换成等体积的含有0.1%甲酸的乙腈:甲醇(3:1),加入对应浓度的奈玛特韦、利托那韦及内标,进样分析,得到峰面积B,提取回收率(%)为峰面积A与峰面积B的比值×100%。结果见表4。奈玛特韦和利托那韦的提取回收率均>94%。
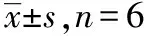
表4 奈玛特韦与利托那韦提取回收率与基质效应
2.5基质效应 考察6份不同来源的空白血浆对奈玛特韦与利托那韦各质控浓度(低、中、高)的影响,空白血浆进行血浆样本处理后添加相应浓度的奈玛特韦、利托那韦与内标溶液,进行分析得到峰面积(C)。相应浓度的奈玛特韦、利托那韦与内标纯溶液,进样分析得到峰面积(D)。基质效应(MF)=C/D×100%,结果见表4,奈玛特韦的基质效应为92.4%~97.7%,利托那韦的基质效应为94.2%~97.6%。
2.6残留效应 取定量上限血浆样本(奈玛特韦:10 μg·mL-1;利托那韦:5 μg·mL-1)进样,每次进样后进空白血浆,平行6次,残留效应=进样定量上限后的残留峰面积/定量下限峰面积。结果显示,定量上限浓度点后的空白血浆在奈玛特韦、利托那韦和内标对应的保留时间处未见明显的信号峰,奈玛特韦的残留韦0.10%,利托那韦的残留韦0.15%,表明残留物对血浆样品的后续检测无影响。
2.7稀释可靠性 取奈玛特韦及利托那韦储备液,加入空白血浆,配制含奈玛特韦及利托那韦浓度分别为20、10 μg·mL-1的混合血浆样本,平行 15 份样。用空白血浆对以上混合血浆样本进行 2、4 和 10 倍稀释。最终得到含奈玛特韦/利托那韦浓度10/5、5/2.5、2/1 μg·mL-1混合血浆样本各5份。处理后进样分析。测定结果显示稀释2、4 和 10 倍的样品奈玛特韦/利托那韦测定结果与标示量的偏差分别为-3.5%/-4.2%、-5.2%/-2.1%、-4.9%/-6.6%。
2.8稳定性 配制各质控浓度(低、中、高)血浆样品,每个浓度平行配制3份,分别考察质控品在长期稳定性(-20 ℃,30 d);反复冻融稳定性(-20 ℃→室温,3次);短期稳定性(室温,24 h);以及处理后自动进样器稳定性(10 ℃,48 h),结果见表5。结果表明奈玛特韦及利托那韦在以上条件下浓度没有明显变化,RSD在±10%。
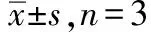
表5 奈玛特韦与利托那韦稳定性试验结果
2.9临床结果 30例患者中,男17例,女13例,年龄(63.9±17.6)岁。患者平均体质量(70.3±10.1) kg,肌酐清除率平均值为(98.2±19.9) mL·min-1。其中伴高血压8例,糖尿病3例,肿瘤2例。
奈玛特韦谷浓度为0.38~2.05μg·mL-1,平均药物浓度为(1.00±0.43)μg·mL-1。利托那韦谷浓度为0.07~0.89μg·mL-1,平均药物浓度为(0.35±0.22)μg·mL-1。提示奈玛特韦和利托那韦在不同患者间的药物浓度差异较大。所有结果均在定量分析线性范围内。本试验建立的UPLC-MS/MS法能满足临床对奈玛特韦/利托那韦血药浓度检测的需求。结果见图2。
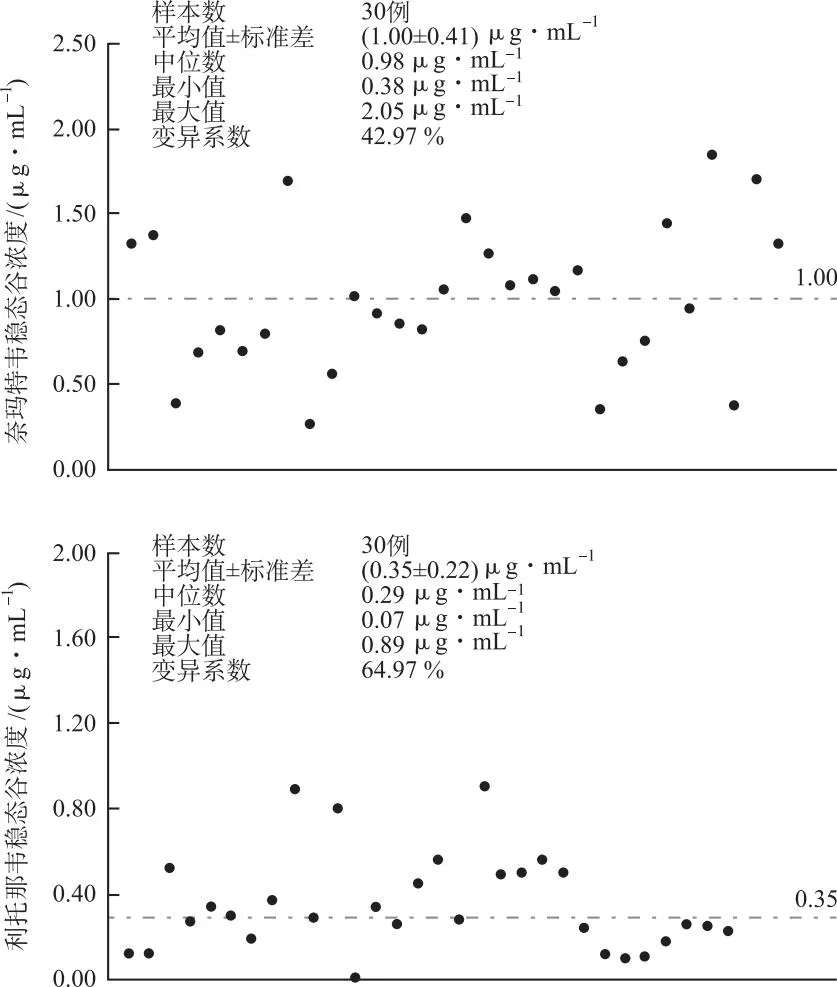
图2 新冠患者体内奈玛特韦和利托那韦血药浓度的散点图
3 讨论
目前,有2篇关于奈玛特韦/利托那韦定量检测方法的报道,LIU等[7]报道一种基于液相色谱质谱联用测定健康志愿者体内奈玛特韦和利托那韦的含量的方法,该液相方法检测时间共7 min,检测效率低;另外,该检测方法仅应用于健康志愿者进行浓度监测,新冠患者病理生理情况复杂,不一定适用。MARTENS-LOBENHOFFER等[8]报道一种基于液相色谱质谱联用测定新冠患者体内奈玛特韦和利托那韦的含量的方法,该方法梯度长达13 min,同样存在检测时间长、效率低的问题,不适用于临床大量样本检测。此外,这2种方法样本预处理方法复杂,检测前需要进行繁琐的准备过程,影响工作效率。本研究根据药品说明书中药动学数据,设置合理的浓度范围,采用UPLC-MS/MS法同时检测人血浆中奈玛特韦和利托那韦浓度。其中奈玛特韦检测浓度范围为0.10~10.00μg·mL-1,利托那韦检测浓度范围为0.05~5.00μg·mL-1。该方法检测时间3 min,其中奈玛特韦及其内标奈玛特韦-D9的出峰时间均为2.07min,利托那韦及其内标13C,2H3-利托那韦的出峰时间均为2.28min。
考虑到分析物以及内标化合物的物理化学性质,本研究检测离子源选择了电喷雾正离子模式,并对以下质谱参数进行了优化:毛细管电压、N2流速、去溶剂化温度、四级杆碰撞能量等。血浆前处理采用了蛋白沉淀法,以含内标的乙腈:甲醇(3:1)作为沉淀剂,相比于其他检测方法沉淀蛋白时先加内标混匀后再加沉淀剂费时繁琐[9-11],笔者在本方法中提前将内标与沉淀剂制备成混合内标工作液,仅需一步即可采用高速离心的方法除蛋白,方法简单。考虑到基质效应等因素,本方法使用结构相似的同位素作为内标物质,其中奈玛特韦-D9作为奈玛特韦的内标,13C,2H3-利托那韦作为利托那韦的内标。试验结果说明当奈玛特韦-D9及13C,2H3-利托那韦作为内标时,基质效应可忽略不计。
试验中发现,奈玛特韦和利托那韦在色谱中保留时间越长,峰形越差。通过优化洗脱程序,将奈玛特韦和利托那韦的出峰时间控制在3 min内,以此获得优越的峰形。此外,柱温对奈玛特韦的峰形有显著的影响,对利托那韦无明显影响,通过比较不同的柱温,发现柱温为45 ℃时峰形最佳。为了提高电离效果,本研究在水相中加入0.1%甲酸。
考虑到奈玛特韦和利托那韦在患者体内的药物浓度较低[12],笔者在本研究中选择灵敏度较高的UPLC-MS/MS法,该方法操作简便,灵敏度和检测效率高,适用于奈玛特韦和利托那韦的血药浓度监测。
MARTENS-LOBENHODDER等[8]针对新冠患者的研究表明,患者接受奈玛特韦/利托那韦口服治疗后(其中奈玛特韦300 mg、利托那韦100 mg,bid),患者体内奈玛特韦谷浓度范围为0.33~4.73 μg·mL-1,利托那韦谷浓度范围为0.05~0.64 μg·mL-1,与本研究中新冠患者体内奈玛特韦/利托那韦药物浓度范围相近。结果显示,奈玛特韦和利托那韦在不同患者间的药物浓度差异较大,结合部分患者的临床疗效也发现谷浓度较高的患者更易发生不良反应,另外谷浓度过低可能影响患者的好转,但是需要扩大样本量进一步深入研究。
笔者在本研究中建立同时测定人血浆中奈玛特韦和利托那韦药物浓度检测方法,并进行方法学验证。该方法简便、快速、灵敏度高,检测范围合理,为今后奈玛特韦和利托那韦的临床研究以及药物安全性研究提供方法学支撑。
