外源性脂多糖对马冈鹅胚胎期胸腿肌发育的影响
2024-01-30王金辉付梦思李发达江丹莉田允波许丹宁黄运茂张续勐
王金辉,付梦思,李发达,江丹莉,田允波,许丹宁,黄运茂,张续勐
(仲恺农业工程学院动物科技学院,广东 广州 510225)
中国是世界肉鹅出栏量最大的国家[1],广东省更是由于地理环境优势和食用水禽的传统,素有“水禽之乡”的美誉。近年来,随着鹅反季节繁殖技术的成功开发和积极推广,广东省鹅养殖业得到迅速发展,但也出现了一些问题,例如种鹅的产蛋量下降,种蛋受精率低,胚胎死亡率高[2]。目前业内普遍认为这些问题产生的主要原因在于夏季炎热的环境所导致的鹅场洗浴池中细菌和脂多糖(LPS)含量的增加[3-5]。
LPS是革兰氏阴性菌细胞壁的主要组成成分,在细菌死亡或快速繁殖时被释放至细胞外。施振旦等[6]认为,由于夏季温度较高,导致洗浴池中细菌含量快速增加,进而造成水体中LPS含量增加,水体中的LPS会随种鹅饮水及在洗浴池中的活动等过程进入种鹅体内,并且进入种鹅消化道的细菌也会在被分解后产生LPS,受LPS污染的种鹅繁殖性能明显降低,雏鹅的生长速度和免疫机能也显著下降。刘容珍等[7]对广东省内2家鹅场母鹅血浆内毒素含量检测,结果发现孵化率较低的鹅场种鹅血浆中LPS含量显著高于孵化率较高的鹅场,且活胚囊胚液中的内毒素水平均明显低于死胚中的内毒素(P<0.05)。对其他禽类的研究也表明,细菌释放的LPS会对禽类生长性能造成不利影响[8]。目前LPS对鹅胚影响的研究主要集中在鹅胚孵化率降低和弱苗产生,较少关注LPS对鹅胚和雏鹅肌纤维发育和生长的影响。
胚胎期是脊椎动物肌肉发育的重要时期,禽类与其他脊椎动物肌纤维发育过程类似,在胚胎期时,肌纤维的数量就已经确定。出生后肌纤维数量将不再改变,出生后肌纤维的发育主要体现在肌纤维长度增加和直径增大[9]。骨骼肌的生长发育受到多种基因的调控,成肌调节因子MRF家族(Myf5、MyoD、Myogenin和Mrf4)在肌生成中起着决定性的作用[10]。其中MyoD是决定肌细胞启动和形成的重要基因,Myogenin在成肌细胞的分化和肌纤维平衡的维持方面起重要作用[10]。肌球蛋白重链(MyHC)是肌球蛋白的基本组成单位,在保证细胞正常工作中发挥重要作用,主要功能是为肌球蛋白提供动力,而Myh1基因则承担着编码MyHC蛋白的作用[11]。肌纤维的生长发育还受其他基因的调控,如IGF-1能有效促进成肌细胞增殖及分化,从而促进骨骼肌再生[12]。除此之外,炎症因子也会影响肌肉的生长,目前主要认为炎症因子会促进成肌细胞的凋亡和肌管的萎缩[13-14],但也有研究认为炎症因子TNF-α和IL-6可以促进成肌细胞的增殖,并影响受刺激卫星细胞的发育至分化的早期阶段[15]。
本研究通过在8胚龄鹅胚尿囊液中注射不同剂量的LPS模拟鹅胚受种鹅不同程度的LPS垂直污染水平,记录鹅胚孵化率,并通过检测一定时期胚胎期尿囊液和出生后雏鹅血清LPS含量,检测建模有效性。同时通过对鹅胚和雏鹅胸腿肌肌纤维束横截面积和密度,炎症和成肌相关基因和部分蛋白相对表达量的检测,探究外源性LPS对鹅胚肌纤维生长发育的影响。
1 材料与方法
1.1 试验设计与材料
试验所用鹅胚均购自广州文健明种鹅养殖有限公司,于入孵第8 天(8胚龄,E8)第1次照蛋确定受精后,随机选取160只受精卵,随机分为4组,每组4个重复,每个重复10只鹅胚。照蛋后用铅笔画出气室边缘,用碘伏消毒蛋壳表面后,75%乙醇进行脱碘;用尖头镊子在气室边缘2~8 mm处轻轻钻一个小孔,避开血管并用注射器将100 μL分别含0、25、50、100 μg LPS(Sigma,L2880,USA)的生理盐水分别注射到4组鹅胚的尿囊腔内。用石蜡封口后,再次放回孵化机内进行常规孵育(以上操作在超净台内无菌操作,并尽量在20 min内完成),记录孵化过程中的死胚数。于15胚龄(注射后7 d,E15)、23胚龄(注射后15 d,E23)和孵化后1日龄(1 d),每组随机选取6 枚(只)鹅胚(雏鹅)采集尿囊液(血液),检测尿囊液(血清)中LPS含量,取出胚胎(屠宰雏鹅)左侧约0.5 cm×0.5 cm×0.5 cm 体积的胸腿肌放入4%多聚甲醛中固定,留待HE染色,石蜡切片检测肌纤维横截面积和直径;采集右侧相同部位约0.5 cm×0.5 cm×0.5 cm体积的胸腿肌,立刻冻入液氮中运回实验室后置于-80 ℃超低温冰箱保存,留待检测相关基因和蛋白表达量。
1.2 尿囊液和血清LPS含量测定
将血液常温放置30 min,离心后取血清进行相关检测。采用鲎试剂法测定尿囊液和血清中LPS含量。所有检测步骤均按厦门鲎试剂生物科技有限公司EC80545S试剂盒说明书规范操作。其中E15和E23由于胚胎血液较少,故检测尿囊液的内毒素含量,1日龄雏鹅检测血清的内毒素含量。
1.3 HE染色及肌束横截面积和密度统计
HE 染色步骤:将肌肉样品放入4%多聚甲醛并放置24~48 h进行组织固定;脱水,70%乙醇(2 h)→80%乙醇(2 h)→95%乙醇(30 min)→无水乙醇(2.5 h)→50%无水乙醇+50%透明剂(30 min)→透明剂(2.5 h)→50%透明剂+50%石蜡(30 min)→石蜡(5 h);将脱水后的组织放入钢包埋盒中,用包埋机加入融化的石蜡,在制冷平台上凝固成蜡块;将蜡块固定在石蜡切片机上切片,厚度4 μm;将漂浮在37 ℃水面上的切片置于载玻片正中位置,随后放在50 ℃烘片机上烘干;将有石蜡切片的载玻片放入透明剂中脱蜡10 min;将载玻片依次在100%、95%、85%、70%、50%的乙醇以及PBS和纯水中各浸泡并振荡2 min;将载玻片放入苏木素中1~5 min,纯水冲洗1 min,加入活化剂30 s,纯水冲洗1 min,伊红染色0.5~2 min,自来水冲洗1 min;玻片自然风干后滴20 μL中性树脂于载玻片标本中心,用镊子盖上载玻片。用正置荧光显微镜(ZEISS,ImagerZ1)观察并拍摄图片。
利用Image-Pro Plus 6.0(Media Cybernetics,Inc.,Rockville,MD,USA)软件统计HE染色胸腿肌横切面图片。每张切片随机挑选至少3 个400 倍视野进行拍照。拍照时尽量让组织充满整个视野。保证每张照片的背景光一致。每张照片随机挑选6 个肌纤维束,测量肌纤维束的面积(mm2),求出平均值。统计每个视野中的纤维束数,测量肌纤维束的总横截面积(mm2),求出单位面积内肌纤维束密度(mm-2)。
1.4 qPCR分析
用Trizol(Thermo,USA)法提取样品总RNA。利用凝胶成像分析仪(Bio-Bad)以及核酸蛋白仪测定RNA18S 与28S条带亮度以及RNA在260和280 nm下吸光度值并计算两者的比值,初步判定质量并记录总RNA浓度与纯度。利用反转录试剂盒(TOYOBO,FSQ-301,日本)将RNA反转录为cDNA,置于-20 ℃保存备用。选用GAPDH作为内参基因,引物见表1。实时荧光定量(qPCR)反应体系(20 μL):cDNA 1.0 μL,上、下游引物(10 pmol·L-1)各0.5 μL,SYBR Green Real-time PCR Master Mix(5×)10 μL,RNase free ddH2O补足至总体积为20 μL。扩增程序:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 15 s,共45 个循环;同时以熔解曲线分析扩增产物的特异性,扩增程序:95 ℃ 15 s,60 ℃ 1 min;95 ℃ 15 s,60 ℃ 15 s。每个样本重复3 次,取平均值。定量结果根据2-ΔΔCT法进行计算。
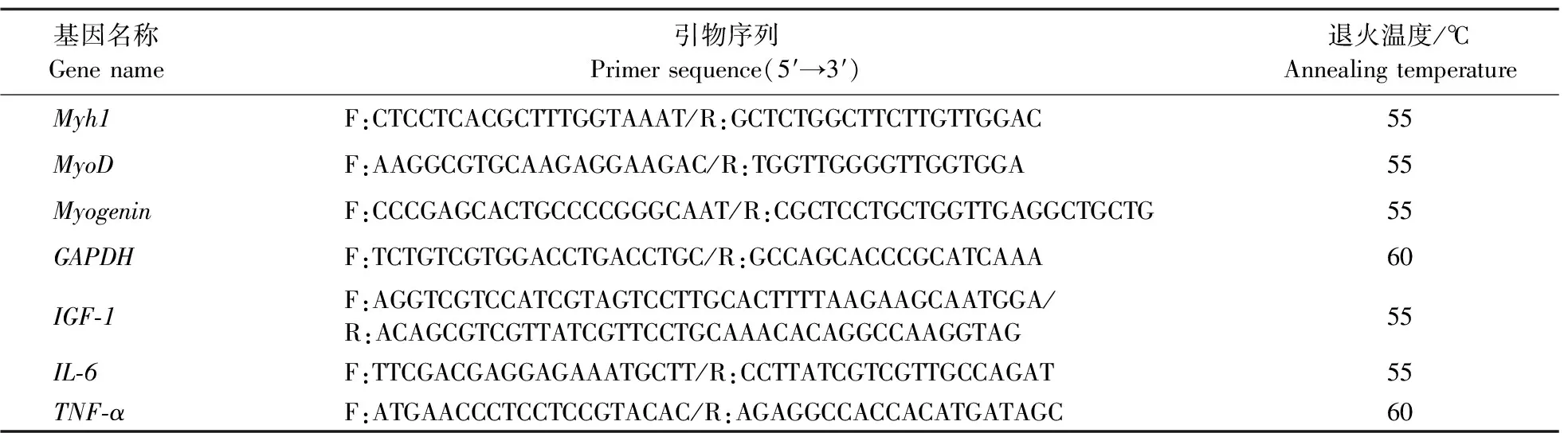
表1 qPCR引物序列Table 1 Primer sequences for qPCR
1.5 Western blot分析
将1日龄雏鹅的胸腿肌组织于冰上剪取约60 mg,加入600 μL含有1%蛋白酶抑制剂混合物(碧云天,P1006)的RIPA强力裂解液(碧云天,P0013B),于组织破碎仪中破碎混匀,低温下10 000g离心 15 min,收集上清液,BCA试剂盒(碧云天)检测蛋白浓度并进行调平,分装置于-80 ℃备用。蛋白在离心管中与6×蛋白上样缓冲液(碧云天,P0015F)于100 ℃金属浴变性10 min。以20 μg蛋白/泳道上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳后,电转膜至聚偏二氟乙烯膜(PVDF);50 g·L-1脱脂奶粉室温振荡封闭1 h,分别加入检测目标一抗(抗体见表2),4 ℃冰箱孵育过夜,PBST 振荡清洗3次,每次 5 min;加辣根过氧化物酶(HRP)标记的二抗,37 ℃摇床孵育1 h,PBST 洗涤3次;电化学发光(ECL)试剂盒行曝光约2 min,待蛋白条带显色清晰时,立刻拍摄照片,记录试验结果,根据光密度分析蛋白表达水平。

表2 所用抗体信息Table 2 Antibody information
1.6 数据分析
采用 GraphPad Prism 7.0 软件统计分析数据,试验数据以平均值±标准误表示。使用Duncan’] s多重比较法进行同一日龄内不同处理组间的差异性比较。
2 结果与分析
2.1 注射外源性LPS对鹅胚孵化率和尿囊液(血清)LPS含量的影响
随着注射LPS剂量的增加,鹅胚的孵化率持续降低(图1-A)注射LPS会导致鹅胚尿囊液中LPS含量升高,在注射后7 d(E15),4组鹅胚尿囊液LPS含量随注射剂量的增加而增加。在注射后15 d(E23),100 μg 组鹅胚尿囊液LPS含量极显著高于其他3组(P<0.01)。在雏鹅出壳当天即1日龄(1 d),4组鹅血清LPS含量随注射剂量的增加而增加,但未达到显著性差异(图1-B)。
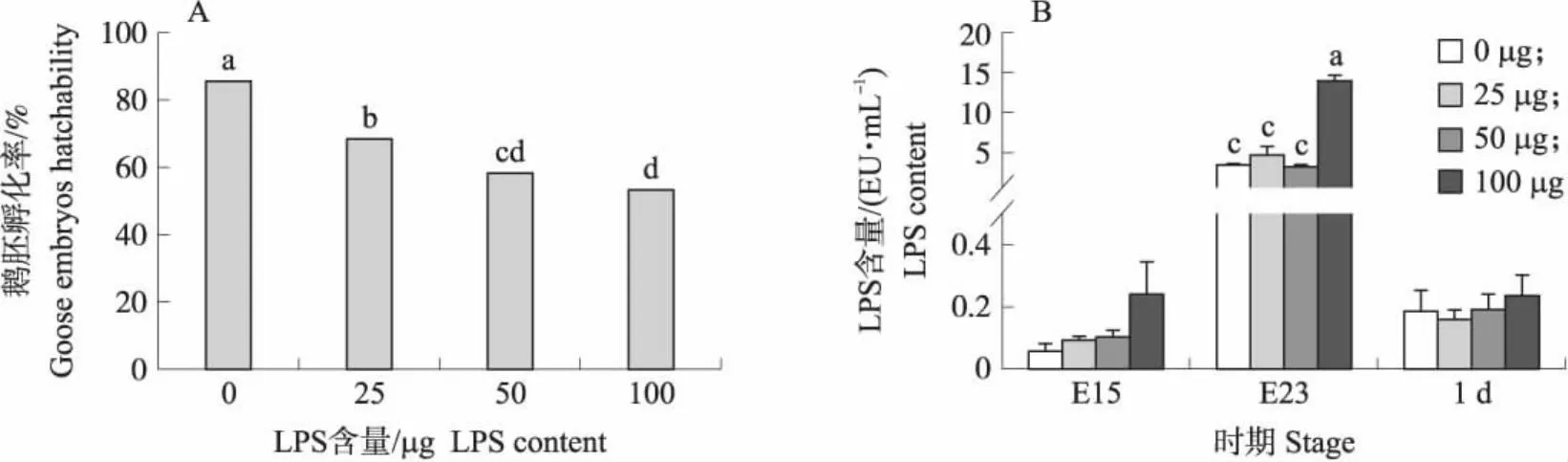
图1 注射外源性LPS对鹅胚孵化率(A)和尿囊液(血清)LPS含量(B)的影响Fig.1 Effects of exogenous LPS injection on hatchability of goose embryos(A)and LPS content(B) in allantoic fluid(or serum)of goose embryos A. 鹅胚孵化率(n=40);B. 鹅胚尿囊液(血清)LPS含量(n=6),E15、E23和1 d表示15胚龄、23胚龄和1日龄雏鹅。同一日龄中,连续小写字母表示差异显著(P<0.05),不连续小写字母表示差异极显著(P<0.01)。下同。A. Hatchability of goose embryos(n=40);B. LPS content in goose embryo allantoic fluid(or serum)(n=6). E15,E23 and 1 d indicate 15,23 embryo age and 1 day-old age gosling. At the same day of age,the adjacent lowercase letter indicates significant difference(P<0.05),and the non-adjacent lowercase letter indicates extremely significant difference(P<0.01). The same below.
2.2 注射外源性LPS对鹅胚肌纤维束横截面积和密度的影响
对4组鹅胚胸肌肌纤维HE染色分析结果发现,在E15时,4组雏鹅肌束横截面积差异均不显著。但100 μg 组肌束密度显著低于0 μg(对照)组(P<0.05)。E23 时,胸肌肌束横截面积随注射LPS剂量的增加而降低,其中50和100 μg组显著低于0 μg 组(P<0.05),肌束密度则为100 μg组极显著高于其他3组(P<0.01)。1 d时,100 μg组肌束横截面积显著低于25和50 μg组(P<0.05)(图2)。对4组鹅胚腿肌纤维HE染色分析结果发现,在试验的3个时期,4组鹅胚(雏鹅)腿肌肌束密度均无显著性差异。而鹅胚(雏鹅)腿肌肌束的面积在E15时,25 μg组显著高于50和100 μg组(P<0.05);1 d时,25、50和100 μg组肌束面积极显著低于0 μg组(P<0.01)。
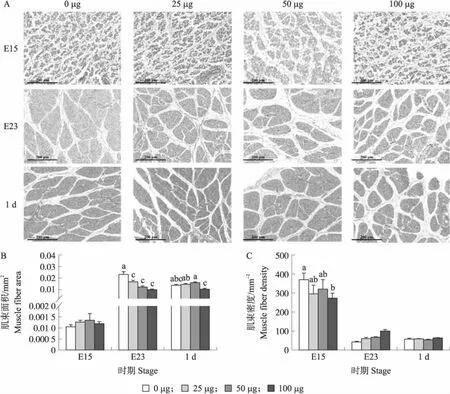
图2 注射不同剂量LPS对鹅胚(雏鹅)胸肌纤维HE染色(A)以及肌束横截面积(B)和密度(C)的影响Fig.2 Effect of injection different doses of LPS on HE staining(A)and cross-sectional area(B)and density(C) of the breast muscle fibers of goose embryos(gosling)
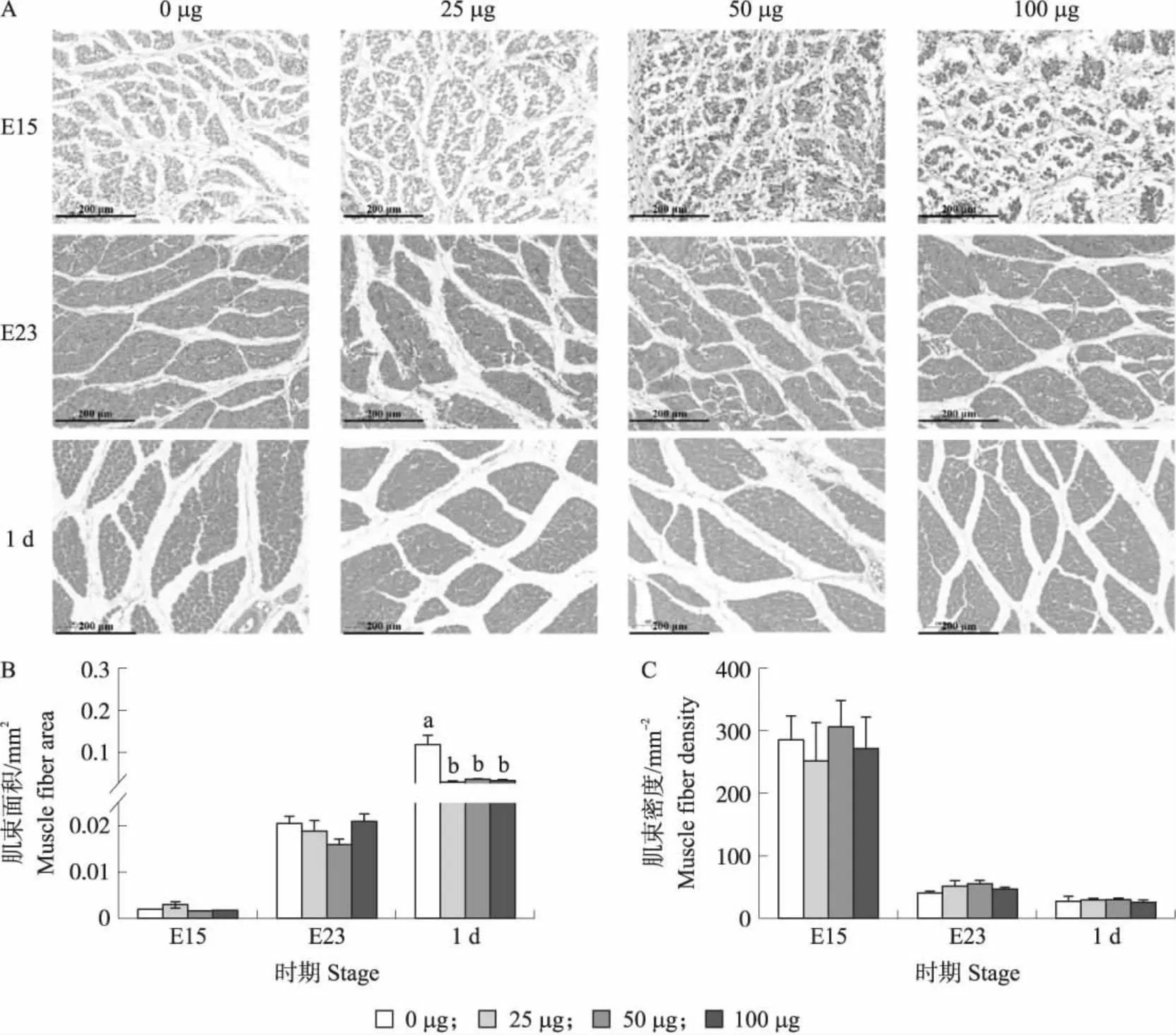
图3 注射不同剂量LPS对鹅胚(雏鹅)腿肌HE染色(A)以及肌束横截面积(B)和密度(C)的影响Fig.3 Effect of injection different doses of LPS on HE staining(A)and cross-sectional area(B) and density(C)of the leg muscle fibers of goose embryos(gosling)
2.3 注射外源性LPS对鹅胚(雏鹅)胸腿肌炎症和成肌基因相对表达量的影响
对4组鹅胚(雏鹅)胸肌炎症和成肌相关基因表达量检测结果显示:炎症因子IL-6基因表达量在E15时随LPS注射剂量增加而下降(P<0.05);TNF-α基因在E15 和E23 时,LPS组鹅胚表达量低于对照组,50 μg 组除外(P<0.05);1 d时,25 μg组显著高于50 μg组(P<0.05)(图4-A)。增殖相关基因IGF-1表达量在E15时,25和100 μg组显著低于0 和50 μg组(P<0.05),1 d时,100 μg组显著高于25 μg组(P<0.05);MyoD在E15时,50 μg组表达量显著高于0、25和100 μg组(P<0.05),但100 μg组显著低于0、25和50 μg组(P<0.05);在1 d时,25 μg组显著高于50 μg组(P<0.05)(图4-B)。成肌分化相关基因Myogenin表达量在E15时,25 μg组显著低于0 和100 μg组(P<0.05),E23 和1 d时,LPS组均低于对照组,仅在1 d时达到显著性差异;Myh1基因在E15 时,表达量随LPS注射剂量增加而下降,且100 μg组显著低于0和25 μg组(P<0.05)(图4-C)。
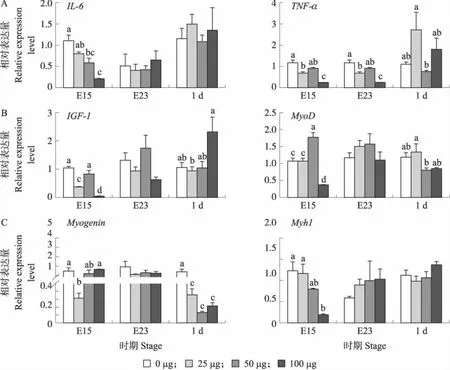
图4 注射不同剂量LPS对鹅胚(雏鹅)胸肌炎症因子(A)、增殖(B)和成肌分化(C)相关基因表达的影响Fig.4 Effect of injection of different doses of LPS on the expression of inflammatory factors(A),proliferation(B) and myogenic differentiation(C)related genes in breast muscle of goose embryo(gosling)
对4组鹅胚(雏鹅)腿肌炎症和成肌相关基因表达量检测结果显示:与对照组(0 μg组)相比,炎症因子IL-6基因表达量在E15时无明显趋势和差异;E23时,25 μg组显著高于0 μg组(P<0.05),1 d时,100 μg 组显著高于0、25和50 μg组(P<0.05);TNF-α基因表达量在E15时,随LPS剂量增加而增加,且100 μg组显著高于0 和25 μg组(P<0.05),E23时,25 μg组显著高于50 μg组(P<0.05)(图5-A)。IGF-1基因表达量在E15时,LPS组低于0 μg组,且25 μg组显著低于0 μg组(P<0.05),1 d时,100 μg组显著低于0 μg组(P<0.05);MyoD基因表达量在E15时,LPS组高于0 μg组,且50 和100 μg组显著高于0 μg组(P<0.05),E23时,100 μg组MyoD基因表达量显著高于0、25和50 μg组(P<0.05)(图5-B)。Myogenin基因表达量在E15时,随 LPS剂量增加而增加(P<0.05),1 d 时,100 μg组显著高于0 μg组(P<0.05);Myh1基因表达量在E15 时,随 LPS剂量增加而增加(P<0.05)(图5-C)。
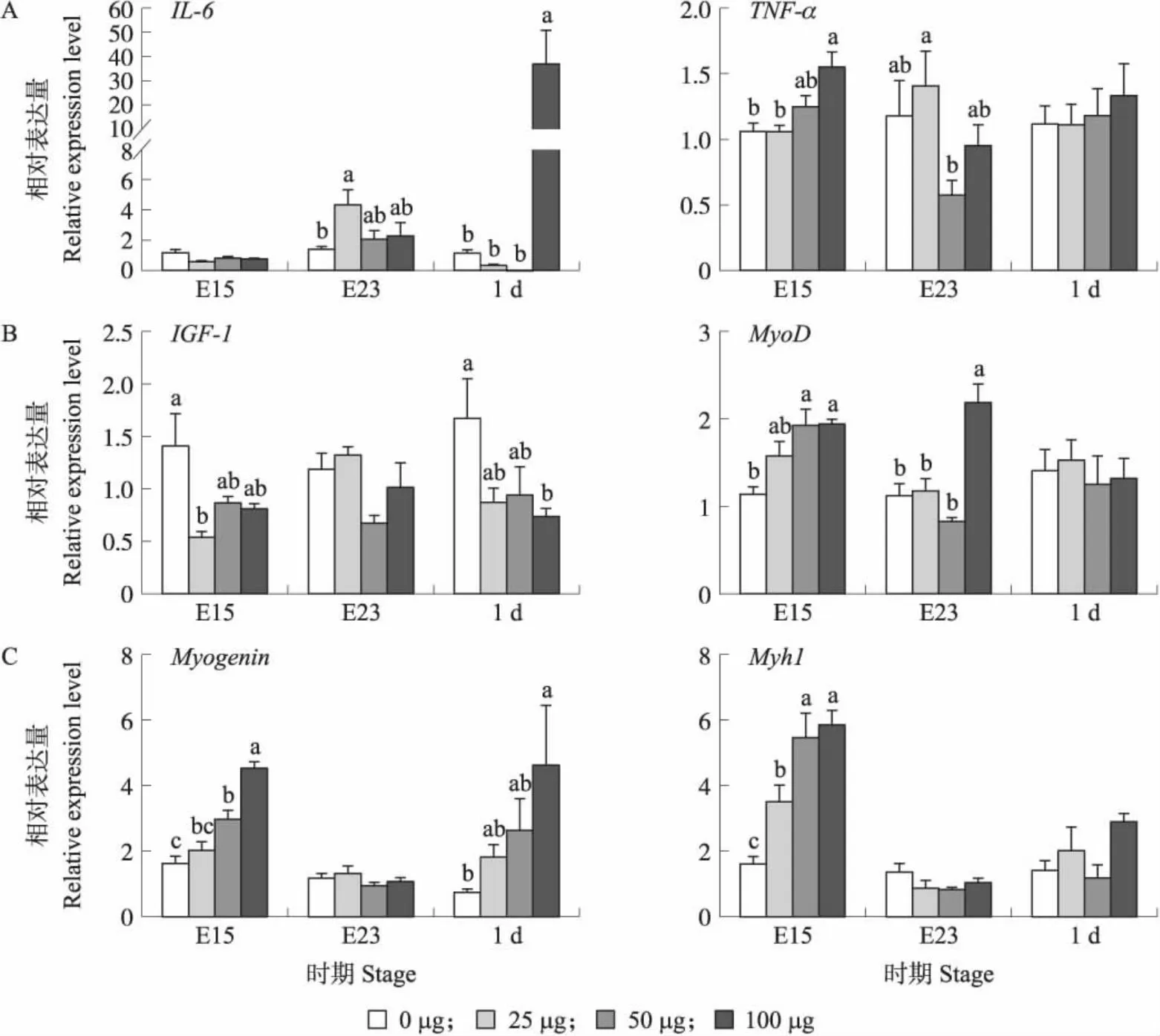
图5 注射不同剂量LPS对鹅胚(雏鹅)腿肌炎症因子(A)、增殖(B)和成肌分化(C)相关基因表达的影响Fig.5 Effect of injection of different doses of LPS on the expression of inflammatory factors(A),proliferation(B) and myogenic differentiation(C)related genes in leg muscle of goose embryo(gosling)
2.4 注射外源性LPS对雏鹅胸腿肌炎症和成肌相关蛋白表达量的影响
注射不同浓度LPS组1日龄雏鹅胸肌炎症和成肌相关蛋白表达量检测结果显示:在胸肌中未检测到炎症因子IL-6蛋白(图6)。而炎症因子TNF-α蛋白表达量随LPS注射剂量增加而增加,且50和100 μg组显著高于0 μg组(P<0.05)。LPS组雏鹅胸肌MyoD蛋白表达量低于0 μg组,且50 μg组显著低于0 μg组(P<0.05)。各处理组MyHC表达量无明显差异。

图6 注射不同剂量LPS的雏鹅胸肌炎症因子和成肌相关蛋白的Western blot分析(A)和表达水平(B)Fig.6 Western blot analysis(A)and expression level(B)of breast muscle fibromyoinflammatory factor and myoblast associated protein in goose goslings injected different doses of LPS
注射不同浓度LPS组雏鹅腿肌炎症和成肌相关蛋白表达量检测结果显示:1日龄雏鹅100 μg组腿肌IL-6蛋白表达量显著高于0、25和50 μg组(P<0.05)(图7)。TNF-α蛋白表达量则是50 μg组显著高于 0 μg 组(P<0.05)。100 μg组MyoD表达量显著低于其他3 组(P<0.05)。MyHC表达量则为25、50和 100 μg 组显著高于0 μg组(P<0.05)。
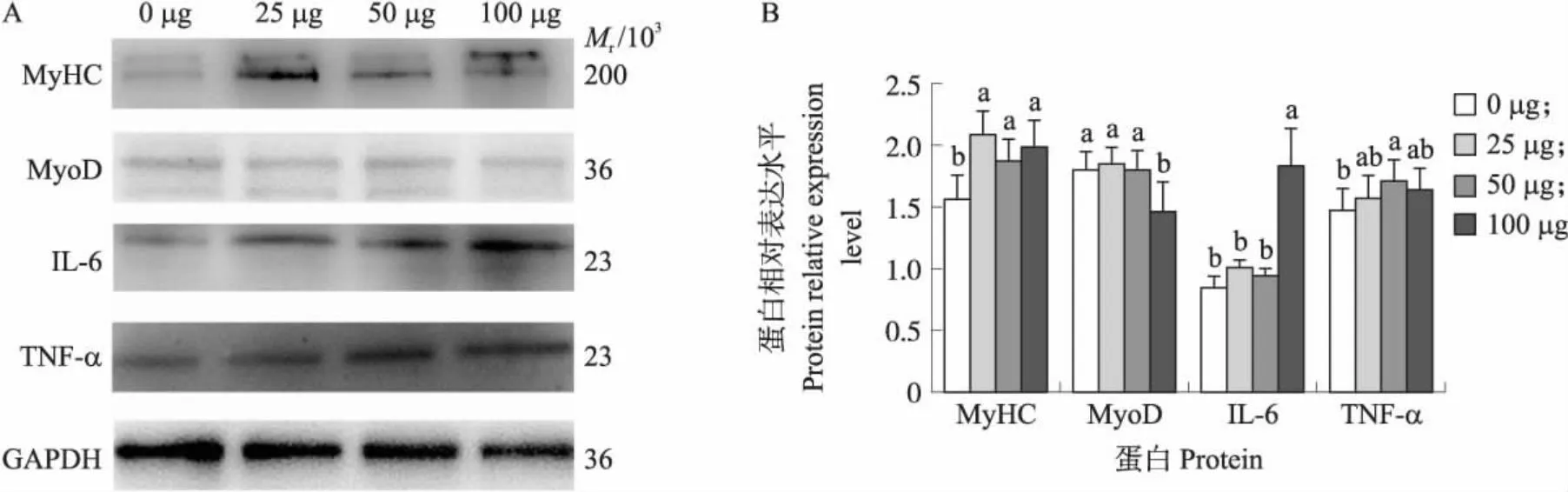
图7 注射不同剂量LPS的雏鹅腿肌炎症因子和成肌相关蛋白的Western blot(A)分析和表达水平(B)Fig.7 Western blot analysis(A)and expression level(B)of leg muscle fibromyoinflammatory factor and myoblast associated protein in goose goslings injected different doses of LPS
3 讨论
LPS可通过激活单核巨噬细胞来释放一系列炎性细胞因子(IL-6 和 TNF-α 等),引起全身性炎症反应。因此LPS 刺激常用于构建免疫应激模型。种鹅血液中LPS会垂直污染受精卵,从而影响鹅胚孵化率[16-17]。在孵育第25天死亡或发育迟缓的鹅胚胎尿囊液中含有大量LPS,而正常发育的胚胎中的LPS含量可忽略不计[17]。此外,研究发现,LPS作为一种脂溶性分子,通过饮水或细菌进入鹅体内和血液后,容易随甘油三酯或卵黄物质沉积到发育中的卵泡中,从而进入所产种蛋内,在孵化时危害胚胎造成死亡,降低种蛋受精率和孵化率[18]。在广东省台山市2家活胚率差异明显的鹅场中发现,2家鹅场的活胚囊胚液中的内毒素水平均明显低于各自死胚中的内毒素水平(P<0.05)[7]。本试验结果显示,注射LPS导致鹅胚孵化率随注射剂量增加而降低,这与江丹莉等[18]的研究结果一致。对鹅胚尿囊液LPS检测结果表明,死亡率较高的组鹅胚尿囊液含量较高。上述结果也与生产中的实际情况相符。
Frost等[19]用LPS处理C2C12小鼠成肌细胞的结果表明,LPS能诱导成肌细胞IL-6和TNF-α等细胞因子mRNA表达量上升并分泌IL-6和TNF-α蛋白。本研究中,各处理组炎症因子IL-6和TNF-αmRNA的相对表达量无显著差异,但注射LPS组雏鹅胸腿肌肌纤维中TNF-α蛋白相对表达量显著升高。研究表明,受LPS刺激后,肌纤维(成肌细胞)中TNF-α、IL-6、IL-1β的mRNA表达量在LPS刺激1~4 h显著上升,但后期追踪时,炎症因子mRNA表达量均回落至正常水平[14,20]。说明炎症因子mRNA的表达具有瞬时性。因此这可能是本试验所在的时间点,IL-6和TNF-αmRNA相对表达量无明显变化的主要原因。
Orellana 等[21]对仔猪注射LPS建立疾病模型的结果显示,LPS导致仔猪背最长肌和腓肠肌中蛋白质含量下降。本课题组前期研究发现,高浓度外源性LPS会导致山麻鸭雏鸭的采食量下降,体重显著降低,并显著抑制肌纤维的发育[22]。与该结果相似,本研究中胚胎期注射LPS会导致鹅胚肌束横截面积和密度呈现一定的剂量依赖性降低。这说明LPS不利于鹅胚肌纤维的生长和发育。Yang等[23]也发现,雏鹅血清中LPS含量较低组胸肌率和腿肌率较高。但注射LPS组1日龄雏鹅腿肌肌纤维MyHC蛋白相对表达量显著高于对照组,这与该时期成肌分化相关基因相对表达量的上升相一致。有研究显示,炎症因子可以促进成肌细胞的凋亡和增殖[24]。因此,结合本研究炎症因子表达量变化的情况,较高的结构蛋白MyHC相对表达量可能是由于炎症因子蛋白促进了成肌细胞的增殖,从而引起更多成肌细胞的分化,但具体影响机制有待进一步验证。
综上所述,马冈鹅受精卵受LPS污染会导致雏鹅孵化率降低,肌纤维发育受阻,不利于雏鹅生产性能的提高,损害养殖户利益。因此,在生产实际中,应降低种鹅养殖环境中的LPS浓度,避免LPS污染种鹅进而污染受精卵,从而有助于雏鹅生长性能的提高。
