高温激活氧化镁活性对硫氧镁水泥的影响
2024-01-30李帅刘欣赵友帅唐宇晗岳雪涛王国栋丁彦霞栾艺娜
李帅,刘欣,赵友帅,唐宇晗,岳雪涛*,王国栋,丁彦霞,栾艺娜
(1.山东建筑大学材料科学与工程学院,山东 济南 250100;2.中材江西电瓷电气有限公司山东分公司,山东 淄博 255000)
0 引言
氧化镁化学式为MgO,其晶体结构和NaCl 相同,均属于立方晶系。MgO 的活性其实是指MgO能够参与物理或化学反应的能力,按其活性的大小可分为低活性、中活性和高活性氧化镁[1]。
活性氧化镁(α-MgO)是氧化镁在其制备过程中发生了晶格畸变、缺陷、错位以及不饱和键等“缺陷”,正是这些“缺陷”使得其衍生出多种应用。例如活性氧化镁是碱式硫氧镁水泥(BMSC)基胶凝材料的重要组成部分,在与改性剂的一同作用下,能够制备出强度高,流动性好,不易吸潮返卤等特性的硫氧镁水泥,可以弥补硅酸盐水泥与氯氧镁水泥的不足[2]。
活性氧化镁吸附能力很强,容易吸附空气中的二氧化碳结合成为碳酸镁包覆层,进而碳酸镁包覆层会与空气中的水分结合生成碱式碳酸镁(xMgO·yCO2·zH2O)。不少学者发现α-MgO 的活性会对BMSC 水化产物性能产生影响[3]。本实验运用了XRD、TG-DSC、FTIR 分析了失活氧化镁灼烧剩余物的微观特性,并用SEM 研究了不同温度灼烧氧化镁剩余物的水化产物,分析了灼烧温度对于氧化镁活性的影响以及氧化镁活性对BMSC试块性能的影响。
1 试验部分
1.1 原料
MgO 粉来源于辽宁镁菱有限公司,分子量40.30,淡黄色粉末,图1 是MgO 粒径分布曲线,其微粒直径主要在20 μm 左右。未失活的氧化镁中活性氧化镁(α-MgO)含量(水合法)为50%(除特殊说明以下均为质量分数),其久置后已失活的MgO 在150 ℃、200 ℃、250 ℃、300 ℃、350 ℃、400 ℃、450 ℃、500 ℃、550 ℃电炉中保温3 h,冷却降至室温后取出,得到不同灼烧温度后的样品。记KB 为未失活MgO 空白对照组,KS 为其水化产物对照组。K0 和K150、K200、K250、K300、K350、K400、K450、K500、K550 分别对应已失活MgO 未灼烧和经150 ℃、200 ℃、250 ℃、300 ℃、350 ℃、400 ℃、450 ℃、500 ℃、550 ℃灼烧后试样;KS0 和KS150、KS350、KS550 分别为已失活MgO 未灼烧粉末水化产物和其经150 ℃、350 ℃、550 ℃灼烧后对应水化产物。
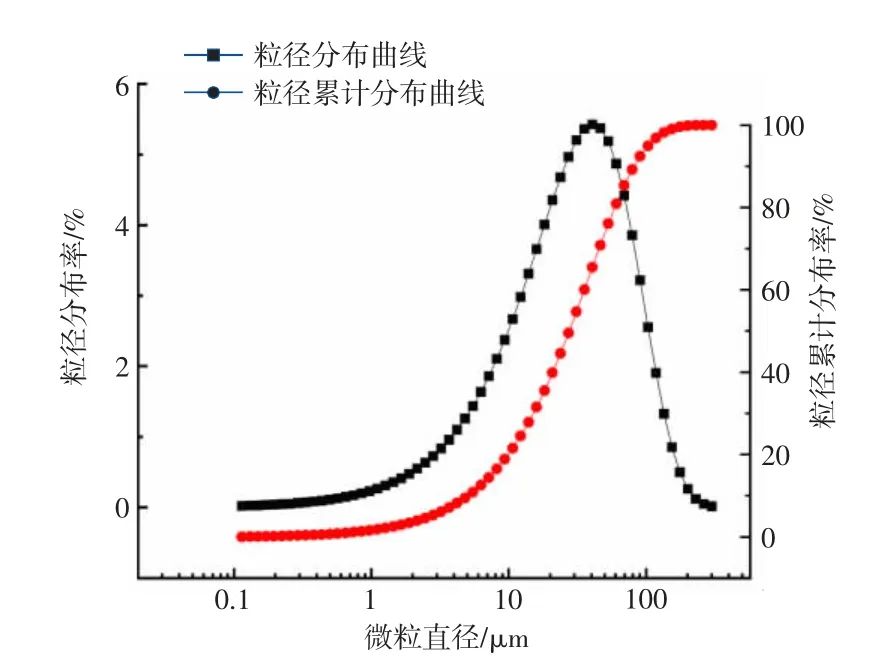
图1 MgO 粒径分布曲线Fig.1 MgO particle size distribution curve
1.2 试样制备
不同学者研究出的性能较好的BMSC 的原料配比为α-MgO∶MgSO4∶H2O=(7~10)∶1∶(18~22)[4]。本实验选用的原料配比为α-MgO ∶MgSO4∶H2O=8∶1∶20。柠檬酸含量固定为α-MgO 的1%。其中记α-MgO(50%)组为空白对照组。
试样步骤如下:按照已定原料配比准确称取七水硫酸镁、柠檬酸、水。在磁力搅拌机作用下加热搅拌均匀至澄清溶液,将称量好的氧化镁与硫酸镁溶液加入搅拌锅内,搅拌240 s 后将浆体注入40 mm×40 mm×160 mm 三连模中,再通过水泥砂浆振实台震动60 s,置于恒温恒湿养护箱中养护24 h 后拆模,置于养护室养护至龄期。试块在强度试验后用无水乙醇浸泡保存,而后在40 ℃恒温箱内烘干,然后进行水化产物的XRD、FTIR、SEM 分析。
1.3 测试方法
强度试验利用微机式万能试验机(SANS CDT1305-2),采用2 mm/min 加压到1 000 N,然后按照2 400 N/s 进行加压直至破坏的加压模式测试抗压强度。测试方法参照GB/T 17671—1999《水泥胶砂强度检验方法(IOS 法)》。
X 射线衍射分析(XRD)利用德国Bruker 公司生产的D8 ADVANCE 型号的X 射线扫描仪进行测试,控制扫描范围在10°~80°、速度为5°/min。
综合热分析(TG-DSC)采用德国耐驰的综合热分析仪(NETZSCH5),温度范围:22~550 ℃,升温速率10 ℃/min,空气气氛,流量10 mL/min。傅里叶变换红外光谱(FTIR)采用美国Thermo Nieolet公司的红外光谱仪(NexuSFTIR),溴化钾压片法制样。
傅里叶变换红外光谱测试(FTIR)利用傅里叶变换红外光谱仪(Nicolet710)分析样品的化学键和官能团的变化,FTIR 试验波长选定为500~4 000 cm-1。
扫描电子显微镜分析(SEM)取破碎后的3~5 mm 左右的水泥碎块,烘干、喷金,利用热发射扫描电子显微镜(SUPRATM55)观察组织形貌。
2 MgO 活性分析
2.1 机理分析
图2 为不同灼烧温度下的α-MgO 含量,其中已失活的MgO 活性只有14.3%,当灼烧温度在350 ℃时,活性可以达到41%。但随着灼烧温度的进一步升高,MgO 活性逐渐降低,但活性高于初始值。
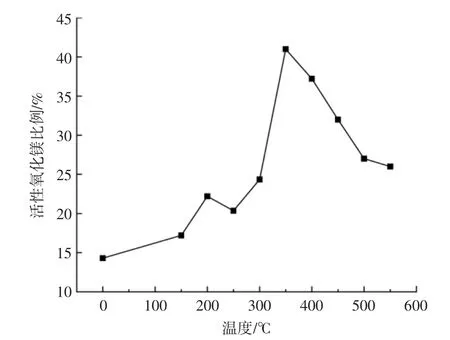
图2 不同灼烧温度下的α-MgO 含量Fig.2 α-MgO content at different sintering temperatures
分析认为α-MgO 比表面积较大,易与空气中的CO2与H2O 结合生成碱式碳酸镁,造成α-MgO含量降低;由于久置,MgO 吸水受潮,α-MgO 质量比例减小。随着灼烧温度升高MgO 内部水分蒸发,且碱式碳酸镁结晶水逐渐脱离,α-MgO 含量升高,当灼烧温度达到350 ℃左右,α-MgO 含量达到峰值,分析认为灼烧温度升高到350 ℃可以得到晶粒较小,结构疏散的MgO,活性较好,继续升高灼烧温度,得到的MgO 晶粒不断长大,晶体结构变得致密,活性降低[5]。随着灼烧温度继续升高,MgO 活性降低,分析认为,分子在内聚力的作用下结合成为稳定的大晶粒,晶体结构变得紧密,晶格不断得到矫正。
2.2 XRD 衍射分析
MgO 置于空气中会失活,其中α-MgO 易吸附空气中的CO2生成碳酸镁包覆层阻碍内部失活,且若在潮湿环境下,碳酸镁易与空气中的水分结合生成碱式碳酸镁(xMgO·yCO2·zH2O),其中xMgO·yCO2·zH2O 的分解温度为300 ℃。如图3(a),已失活MgO 杂质主要为碱式碳酸镁和少量SiO2,经550 ℃电炉灼烧后xMgO·yCO2·zH2O 含量明显降低,相应MgO 含量升高。KB 组为700~1 000 ℃煅烧成品MgO,其杂质含量更低,MgO 含量在90%左右。

图3 不同灼烧温度下的MgO XRD 图谱Fig.3 XRD patterns of MgO at different sintering temperatures
图3 (b)表明已失活MgO 在150~300 ℃电炉中灼烧后,成分没有明显变化,但K150、K200、K250、K300 中碱式碳酸镁衍射峰略低于K0。分析认为,当灼烧温度在0~300 ℃时,碱式碳酸镁失去结晶水,图4 表明当灼烧温度在350 ℃时,K350 相比较K300,碱式碳酸镁衍射峰降低,分析认为,此时碱式碳酸镁分解失去结构水,而K400 中碱式碳酸镁衍射峰继续降低,由此分析碱式碳酸镁的分解温度在300~400 ℃之间。K450、K500 衍射峰没有明显的变化,证明碱式碳酸镁在400 ℃时已经分解完全。
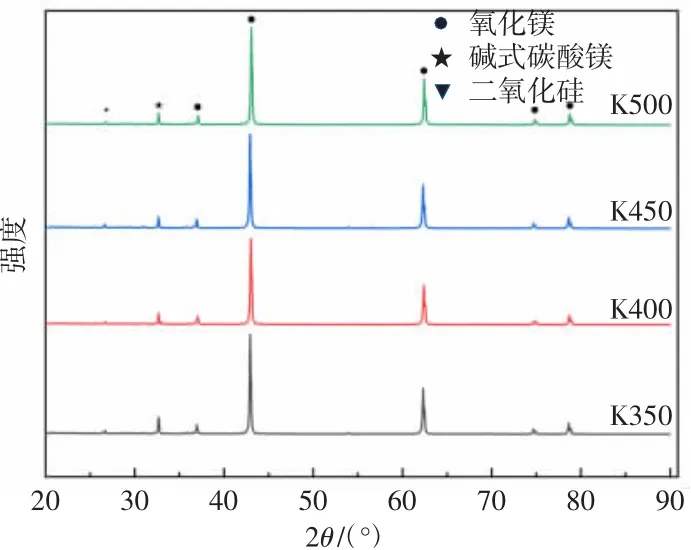
图4 350~500 ℃不同灼烧温度下的MgO XRD 图谱Fig.4 XRD patterns of MgO at different sintering temperatures(350~500 ℃)
2.3 TG-DSC 分析
轻烧氧化镁煅烧温度为700~1 000 ℃,其具有较高的活性和比表面积,重烧氧化镁是菱镁矿在1 700 ℃煅烧时,二氧化碳完全逸出,氧化镁形成方镁石致密块体,称重烧镁砂[6]。图5 为不同氧化镁的DSC 曲线,碱式碳酸镁在345 ℃分解速度最快完全分解为氧化镁温度在540 ℃左右,重烧氧化镁中杂质氢氧化镁完全分解为氧化镁温度在430 ℃左右。

图5 不同氧化镁的DSC 曲线Fig.5 DSC curves of different magnesium oxides
已失活MgO 与轻烧MgO 在100 ℃、300~400 ℃峰强明显不同,这是因为在100 ℃附近时MgO 周围的自由水吸热快速溢出,图6 是失活MgO 的TG-DTG 曲线,其表明当温度在100 ℃左右时样品质量下降较快。

图6 失活MgO 的TG-DTG 分析Fig.6 TG-DTG analysis of metamorphic MgO
当温度在300~400 ℃时,碱式碳酸镁快速吸热分解,逐步丢失结晶水,质量下降较快。当温度在400~500 ℃之间时,碱式碳酸镁逐渐失去结构水,当温度在500 ℃左右时,质量下降也较快,分析认为此时碱式碳酸镁已经完全分解为碳酸镁,且碳酸镁正在完全分解为氧化镁,二氧化碳的溢出使得DTG 曲线出现明显低谷。
3 BMSC 性能分析
3.1 BMSC 强度分析
图7 为28 d 抗压强度与MgO 活性随温度的变化规律,其中28 d 抗压强度随着灼烧温度的升高先增大后减小,在200 ℃出现小峰值,在灼烧温度550 ℃时达到最高,在350 ℃时强度出现低谷。当灼烧温度在250~350 ℃时抗压强度随着氧化镁活性的升高而减小。

图7 28 d 抗压强度与MgO 活性随温度的变化Fig.7 28 d compressive strength and MgO activity with temperature
吴成友等[7]分析了碱式硫酸镁水泥5·1·7 相的形成过程,首先,水分子在MgO 的表面形成[Mg(H2O)x(OH)]+覆盖在其表面,减小其与H2O 的接触面积,并且释放出OH-,然后,所形成的[Mg(H2O)x(OH)]+与柠檬酸分子生成有机-镁络合层[CAm-→Mg(OH)(H2O)x-1]降低了MgO 表层阳离子浓度,抑制其与OH-反应生成Mg(OH)2,最终,[CAm-→Mg(OH)(H2O)x-1]与Mg2+和SO42-与OH-反应形成5·1·7 相晶核,并释放出外加剂分子,外加剂分子继续在MgO 表层生成有机镁络合层,使5·1·7相不断生成。
5·1·7 相可以显著提高BMSC 的强度,Mg(OH)2相的生成对BMSC 强度的增长不利。分析认为当灼烧温度在200 ℃以下时,α-MgO 含量太低导致BMSC 强度不高,随着灼烧温度的升高α-MgO 含量升高,因此生成的5·1·7 相含量逐渐升高,强度增加。
当灼烧温度在350 ℃时,抗压强度较低,分析认为高活性氧化镁与硫酸镁溶液中的离子结合能力差,不利于高结晶程度相形成[5]。当灼烧温度继续上升时,MgO 晶粒长大,晶体结构致密,有利于高结晶度5·1·7 相的生成,图8、图9 为不同灼烧温度下MgO 水化产物3 d XRD 图谱,其中KS550 中5·1·7 相含量较高,同时因为MgO 晶粒致密会抑制其与H2O 反应生成Mg(OH)2相。

图8 不同灼烧温度下MgO 水化产物3 d XRD 图谱Fig.8 3 d XRD patterns of MgO hydration products at different sintering temperatures

图9 不同灼烧温度下MgO 水化产物28 d XRD 图谱Fig.9 28 d XRD patterns of MgO hydration products at different sintering temperatures
图9 表明KS550 水化产物与KS350 水化产物相比5·1·7 相含量较高,而Mg(OH)2相较小。分析认为,由于KS350 氧化镁活性较高,比表面积较大,α-MgO 迅速与水反应生成Mg(OH)2,这抑制了5·1·7 相生成。
3.2 FTIR 光谱分析
图10 为经不同灼烧温度下BMSC 的28 d FTIR 图谱,图中波数1 100 cm-1处对应着SO42-中的O3S-O 伸缩震动峰[8],随着灼烧温度的升高,观察到此伸缩震动峰逐渐变强,这意味着SO42-含量升高,有利于5·1·7 相的生成,进而影响机械强度。
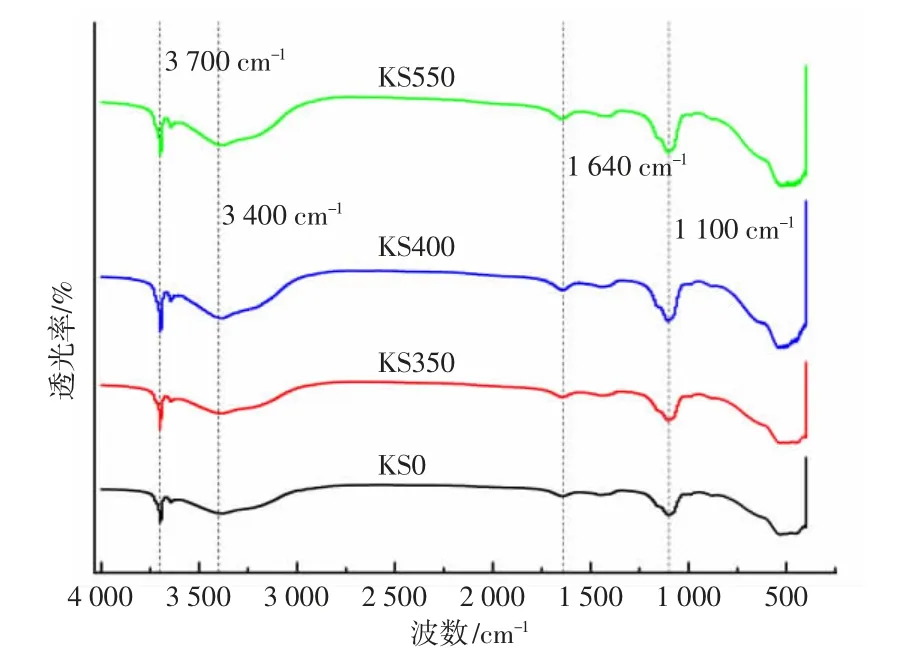
图10 经不同灼烧温度下BMSC 的28 d FTIR 图谱Fig.10 28 d FTIR patterns of BMSC after different sintering temperatures
1 640 cm-1和3 400 cm-1分别为结晶水中HO-H基团的不对称伸缩振动峰和弯曲振动峰,KS400与KS550 相较于KS0 与KS350 此二组峰均有增强。分析认为由于KS400 与KS550 中的5·1·7 相含量较高,其结晶水含量也较高。
波数为3 700 cm-1处对应着Mg(OH)2晶体中的MgO-H 的伸缩振动峰[9]。KS350 与KS400 此振动峰较强,分析认为当灼烧温度在350~400 ℃时,α-MgO 含量较高,会更迅速地与游离的H2O 反应,所以其中Mg(OH)2相含量较高,又因为其会有微膨胀效应,产生裂缝会对BMSC 强度产生不利影响。KS550 中MgO-H 峰相比KS350 略有降低,分析认为由于KS550 中α-MgO 含量降低,与H2O 反应速率减慢,不利于Mg(OH)2相生成。
3.3 SEM 分析
图11 为经不同灼烧温度下BMSC 的28 d 微观形貌,(a)与(b)相比,KS350 中含有大量片状Mg(OH)2相与未参与反应的MgO,少量针状5·1·7相。KS550 中针状5·1·7 相结晶度较高。分析认为,由于灼烧温度在350 ℃左右时α-MgO 含量较高,生成的Mg(OH)2相较多,同时由于其孔隙较大导致强度不高,而KS550 中针状晶体错综复杂可以更好地填充孔隙,是BMSC 强度的主要来源。

图11 经不同灼烧温度下BMSC 的28 d 微观形貌Fig.11 28 d microscopic morphology of BMSC after different sintering temperatures
4 结果与讨论
1) 通过提高灼烧温度的方法可以提高MgO的活性的比例,且其活性随着灼烧温度的升高先增加后减小,在350 ℃最高,为41%。
2) 当失活MgO 灼烧温度在200 ℃以下时,BMSC 强度随温度上升而增大;当灼烧温度在200~350 ℃时,BMSC 强度随温度上升而减小,只有38 MPa;当温度在350~550 ℃时,BMSC 强度随温度上升而增大。
