糖尿病患者空腹血糖与血尿酸对糖尿病视网膜病变的交互作用分析
2024-01-30谢连凤刘琳琳蒋贻平谭述香
谢连凤 刘琳琳 蒋贻平 谭述香
我国糖尿病(DM)患病率逐年递增,糖尿病视网膜病变(DR)是DM患者常见并发症之一,其致盲率和发病率呈不断增高趋势[1]。DR进展是不可逆的过程,因此防止DR的发生以及实时监测和控制DR的进展极为重要。血液生化指标在临床诊断和治疗过程中可用于协调临床诊疗,其操作重复性高,临床实践中可利用实时监测相关生化指标并调整异常值,对防治DM患者发生DR有重要意义。研究发现,多项生化指标与DR发生和进展相关,但单项指标不能准确全面地反映DR的发生情况,目前哪些血液生化指标与DR存在何种关联仍不十分明确[2]。空腹血糖(FBG)可反映胰岛素的分泌功能,是诊断DM的重要指标之一。有研究指出,FBG只能反映受检时的血糖水平,与DR的病变程度关系不大[3]。但也有研究认为FBG是DM患者发生DR的高危因素,且FBG水平将直接影响DR患者的视力损害程度[4]。血尿酸(SUA)是嘌呤的代谢产物,是反映人体代谢状况的指标之一,生活方式和饮食习惯的改变均可影响体内嘌呤水平和尿酸排出量间的平衡,引起SUA升高,导致代谢障碍性疾病的发生。SUA与DR相关性也存在较大争议。一项针对男性患者为期12个月的研究显示,低水平的SUA先于DR发生,且随着DR进展进一步降低[5]。一项横断面研究发现SUA水平与DR无明显相关性[6]。一项研究纳入746例中国DM患者的研究发现,SUA水平随着DM患者DR严重程度的升高而上升,但并未证明SUA是DR的独立危险因素[7]。也有研究发现,当DM患者SUA≥304.0 μmol·L-1时,发生DR的风险是低SUA(<213.0 μmol·L-1)的3.235倍[8]。综上,虽然已有大量研究探讨FBG、SUA与DR的相关性,但研究结果尚不统一,且针对FBG与SUA的交互作用对DR影响的相关研究较少。因此,本研究通过探讨DR发生的危险因素分析FBG、SUA对DM伴DR患者的影响,并对二者交互作用进行定性、定量分析,为DR防治提供依据。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年1月于赣南医学院第一附属医院确诊的DM患者306例为研究对象。纳入标准:(1) 接受视力检查、眼底彩照检查、间接眼底镜检查、裂隙灯显微镜检查、测眼压以及直接眼底镜检查;(2) 年龄≥18岁;(3) 临床资料完整;(4) DR诊断及分级标准符合《糖尿病视网膜病变的国际临床分级标准》[9]。排除标准:(1) 合并肝肾等重要脏器功能障碍者;(2) 交流沟通障碍者;(3) 使用别嘌呤醇、利尿剂及其他影响尿酸代谢的药物;(4) 其他因素导致的DR患者。本研究已经本院伦理委员会批准,患者均签署知情同意书。
1.2 方法
1.2.1 临床资料收集
详细记录患者性别、年龄、体重指数(BMI)、高血脂病史、DM病程、高血压病史、口服药物治疗史、胰岛素治疗史以及最佳矫正视力,测量收缩压(SBP)和舒张压(DBP)(1 kPa=7.5 mmHg)。
1.2.2 生化指标检测
空腹采集患者晨起静脉血并及时送检,使用罗氏全自动生化分析仪检测FBG、SUA、低密度脂蛋白胆固醇(LDL-C)、直接胆红素(D-BIL)、高密度脂蛋白胆固醇(HDL-C)、血肌酐(SCr)、总胆固醇(TC)、间接胆红素(I-BIL)、甘油三酯(TG)、空腹C肽、空腹胰岛素、血尿素氮(BUN),根据条码识别自动离心、编号和检测。使用Sysmex流水线血液分析仪检测糖化血红蛋白(HbA1c),按照仪器说明书规范化操作,所用试剂均为仪器原装配套。
1.2.3 诊断标准
高SUA诊断标准[5]:绝经前女性SUA≥360 μmol·L-1,男性和绝经后女性SUA≥420 μmol·L-1即可诊断为高SUA;依据WHO空腹血糖受损标准及糖尿病的诊断标准[6]:FBG≥7 mmol·L-1或(和)随机血糖≥11.1 mmol·L-1。
1.2.4 眼底检查及分组
依据DM伴DR病变分期标准[9],患眼使用“复方托吡卡胺”滴眼液散瞳,检查眼底情况,测量血压正常后,通过荧光素钠(商品名:历设得)行荧光素眼底血管造影,依据有无DR分为DR组(178例)和NDR组(128例)。
1.3 统计学处理
使用SPSS 22.0进行数据分析,计量资料、计数资料分别使用均数±标准差、率表示,两组间比较使用独立样本t检验与χ2检验。采用最小绝对收缩和选择栓子(LASSO)回归法和多因素Logistic回归分析筛选DM患者发生DR的独立影响因素,并计算危险因素比值比,使用E值法对结果进行敏感性分析。使用rms软件包绘制Nomogram模型并进行验证。矫正混杂因素后,采用EmpowerStats软件中的多元回归方程行多因素分析,采用交互作用检验行影响因素的分层分析。非条件Logistic回归模型分析影响因素,使用Hosmer和Rothman推荐的相加模型[8-9]分析各个因素间的交互作用,并计算交互作用指标[10]。使用受试者工作特征曲线(ROC)对SUA、FBG及其交互作用对DR的影响进行评估。检验水准:α=0.05。
2 结果
2.1 一般资料
两组患者性别比及年龄比较,差异均无统计学意义(均为P>0.05)。与NDR组患者相比,DR组患者的DM病程较长,口服药物治疗史比例较低,胰岛素治疗史比例较高,TC、TG、LDL-c、HDL-c、BUN、SCr、SUA和FBG水平均较高,差异均有统计学意义(均为P<0.05)(表1)。
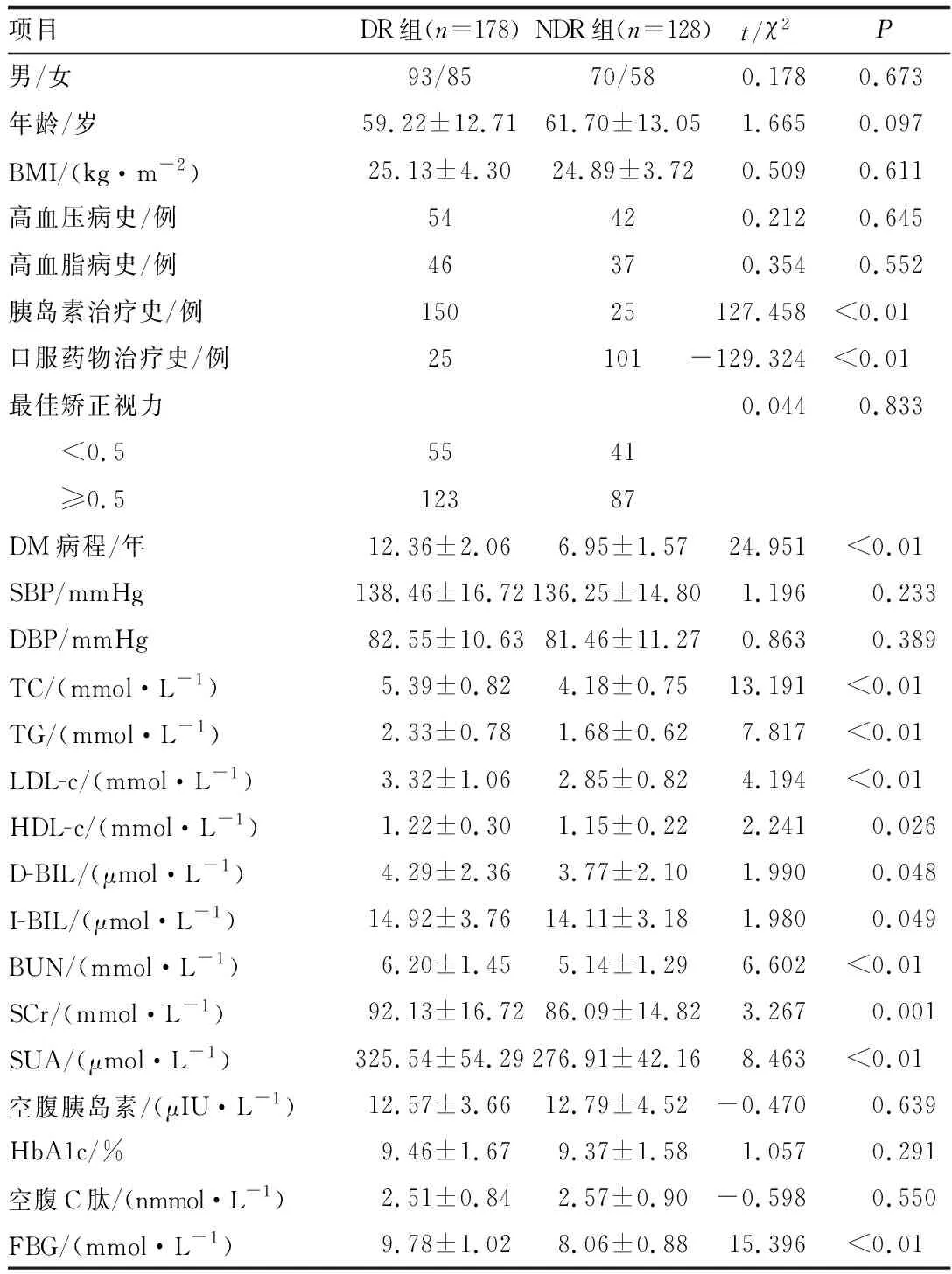
表1 DR组和NDR组患者一般资料比较
2.2 DM患者发生DR的LASSO回归分析
本研究共纳入14个潜在的DR发生风险因素,由于本研究DR病例数较少且不同变量之间可能存在一定关联性,故通过LASSO回归对变量进行降维处理,以便于筛选出最具代表性的风险因素。通过10折交叉验证选择最优Lambda参数,当交叉验证误差最小时的Lambda值则为最优Lambda值,此时对应的非零回归系数变量即为最具代表性的DR发生风险因素。LASSO回归分析结果显示,最优Lambda值为0.033 4(logλ=-3.002),此时对应的口服药物治疗史、胰岛素治疗史、HgA1c、FBG、SUA、SCr、BUN、LDL-c、TG、TC、DM病程为影响DM患者发生DR的相关影响因素(图1)。

A:调整λ后,特征变量与log(λ)的关系图;B:λ(最优参数值)= 0.033 4时绘制垂直线,选取11个变量的关系图。虚垂线为最优Lambda参数取值时所纳入LASSO回归模型的风险因素数目。图1 DM患者发生DR的LASSO回归分析结果
2.3 DM患者发生DR的Logistic回归分析
将2.2中11种影响DM患者发生DR的相关影响因素变量纳入多因素Logistic回归分析,筛选出影响DM患者发生DR的危险因素,变量筛选标准采用前进法(α纳入=0.05),结果发现,胰岛素治疗史、DM病程≥9.66年、TG≥2.07 mmol·L-1、SUA≥297.73 μmol·L-1、FBG≥8.92 mmol·L-1是影响DM患者发生DR的危险因素,口服药物治疗史是影响DM患者发生DR的保护因素(图2)。

图2 DM患者发生DR的Logistic回归分析结果
2.4 相关性E值法的敏感性分析

2.5 Nomogram模型建立
根据Logisitic多因素回归分析结果,采用R软件构建DM患者发生DR的列线图预测模型,列线图可以通过将每个变量的得分相加,并将其定位在总积分量表上来确定DM患者发生DR的概率。结果如图3所示,胰岛素治疗史积分为20分、DM病程≥9.66年积分为24分、TG≥2.07 mmol·L-1积分为35分、SUA≥297.73 μmol·L-1积分为28分、FBG≥8.92 mmol·L-1积分为30分,口服药物治疗史积分为27分,所得总分(164分)对应的值即为DM患者DR发生率(84.68 %)。

图3 DM患者发生DR的Nomogram预测模型结果
2.6 Nomogram模型准确度和有效性评价
对建立的Nomogram模型的校准度和有效性进行评价,图4A中A是参考曲线,B是拟合曲线,两边阴影为95%CI。从本次构建的Nomogram模型来看,当事件发生率在35%以下时,模型低估DR发生风险;当事件发生率在35%~65%时,模型高估DR发生风险,当事件发生率在65%~100%时,模型低估DR发生风险,而在35%、65%时,模型观测值和预测值完全一致,总体来看,本模型的准确度较好。从临床决策曲线可看出,Nomogram模型的净获益值较高,提示本模型有效性较好(图4B)。

A:校准曲线结果;B:临床决策曲线结果。图4 DM患者发生DR的Nomogram模型校准曲线和临床决策曲线结果
2.7 FBG与SUA的交互作用定性分析
单因素非条件Logistic回归分析发现,高FBG、高SUA以及二者同时存在时,发生DR的OR分别为1.893、2.574、6.593,OR(EF)>OR(E)+OR(F)-1,说明高FBG和高SUA具有交互作用(表2)。

表2 FBG与SUA的交互作用定性分析
多因素非条件Logistic回归分析发现,高FBG、高SUA以及二者同时存在时DM患者发生DR的OR分别为1.573、1.824、5.613,OR(EF)>OR(E)+OR(F)-1,说明高FBG和高SUA具有交互作用(表2)。
2.8 FBG与SUA的交互作用定量分析
单因素非条件Logistic回归分析发现,高FBG与高SUA同时作用效应为两因素单独作用之和的 2.27倍,二者交互作用引起的归因交互作用为3.13,在二者同时存在的DR患者患病风险中,43.41%是二者交互作用引起,在仅因为二者所导致的DR患病危险中,有55.89%是由于二者的交互作用引起的。多因素非条件Logistic回归分析发现,高FBG与高SUA同时作用效应为两因素单独作用之和的 3.30倍,由二者的交互作用引起的归因交互作用为3.22,在高FBG与高SUA同时存在时对DR的危险中,有57.30%是由于两个因素的交互作用引起,在仅因为高FBG与高SUA所导致的DR患病风险中,有69.72%是由两个因素的交互作用引起(表3)。
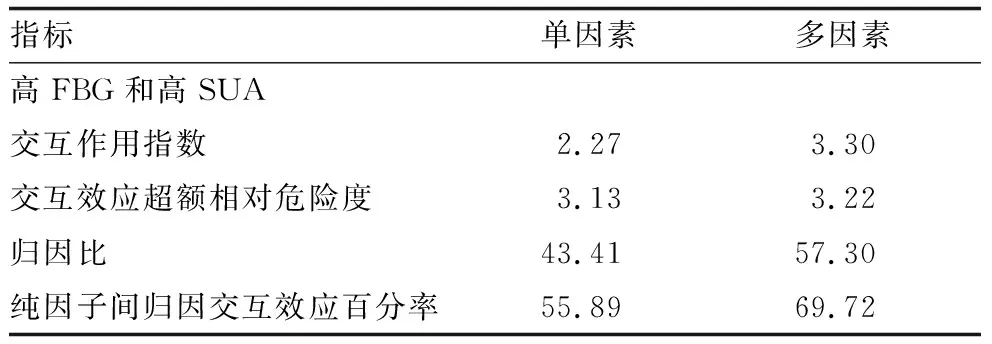
表3 FBG与SUA的交互作用定量分析
2.9 分层交互分析性别对SUA、FBG与DR关系的影响作用
采用EmpowerStats软件中的分层交互检验作用对性别进行分析。在未调整任何因素前,男性和女性两个群体中SUA、FBG与DR的关系存在,在调整其他影响因素后,男性患者SUA、FBG与DR的关系依然存在(均为P<0.05),而女性患者则在调整其他因素后两者关系没有统计学意义(均为P>0.05)。但是在经过交互检验作用(Pinteraction)后,发现无论是否调整其他因素,均发现性别不能影响SUA、FBG与DR之间的关系(表4)。
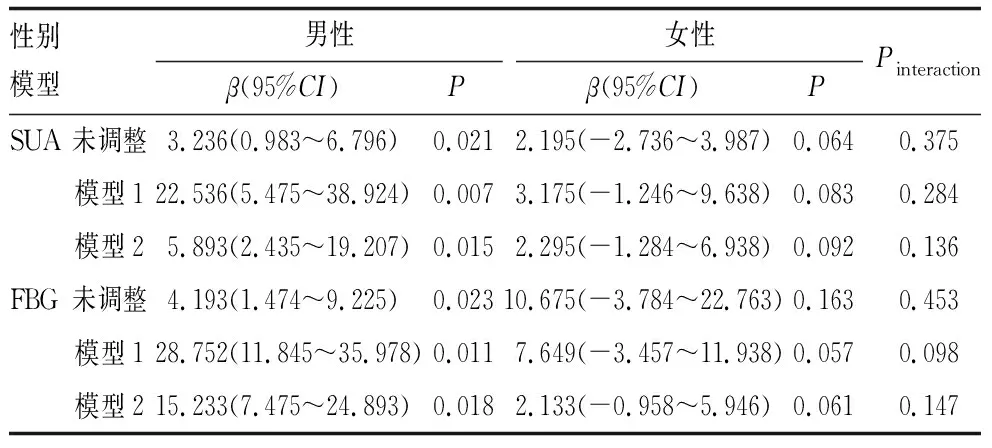
表4 分层交互分析性别对SUA、FBG与DR关系的影响作用
2.10 ROC曲线比较SUA、FBG以及交互作用对DR的诊断价值
ROC结果显示,SUA、FBG及其二者协同交互作用对DR的诊断价值大于二者单独对DR的诊断价值(表5、图5)。

图5 ROC曲线比较SUA和FBG以及交互作用对DM合并DR的诊断价值
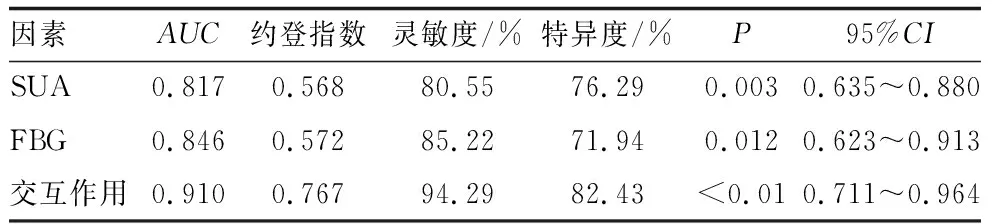
表5 SUA、FBG以及交互作用对DR的诊断价值
3 讨论
DR是导致DM患者视力变差甚至失明的严重并发症之一,有研究报道其发生率一般为30%~60%[10],本研究中发生率为58.17%。DR的发生发展是多种因素共同作用的结果,其中高SUA会导致DR患病率升高已形成共识[11],但具体机制尚不十分清楚。FBG作为糖尿病诊断指标之一,对DR进展也很明确。然而关于二者交互作用对DM患者的DR发生情况研究较少。本研究首先通过Logisitic多因素回归分析发现,DM病程≥9.66年、胰岛素治疗史、TG≥2.07 mmol·L-1、SUA≥297.73 μmol·L-1、FBG≥8.92 mmol·L-1是影响DM患者发生DR的危险因素,口服药物治疗史是影响DM患者发生DR的保护因素。
DM病程越长,眼底结构和功能受损越严重,DR发生风险越高。有学者发现,糖尿病病程<10年的患者,其DR发病率为7%,病程≥10年的患者,其DR发病率高达26%~90%[12]。也有研究证实糖尿病病程与DR发生呈明显正相关[13]。本研究发现,糖尿病病程是DM患者发生DR的独立危险因素。因此,在临床实践中,为早期诊断和防治DR,对于已确诊的DM患者,应尽快进行全面的眼底检查。以往有研究报道[10],口服药物治疗史良好的DM患者发生DR风险低于未按医嘱进行药物治疗的患者。本研究也发现,DR组中有口服药物治疗史的患者比例明显低于NDR组。长期高血糖会造成血-视网膜屏障破坏和血管壁周细胞减少,引起微动脉瘤形成,血液成分渗漏到组织间隙,形成视网膜出血和硬性渗出,血管基膜进行性增厚,导致视网膜缺氧、缺血而产生DR[14]。因此,DM患者需遵医嘱进行口服药物治疗,严格控制血糖,才可有效防止DR发生和进展,从而降低致盲率。胰岛素是人体内唯一降低血糖的激素,其可通过与细胞膜上的胰岛素受体结合发挥降低血糖的作用。以往研究显示,胰岛素在有效控制血糖的同时,胰岛素用量与DR病变程度呈正相关[3]。也有研究证实,胰岛素可通过促进细胞增殖、破坏血-视网膜屏障、促进新生血管形成等促进DR发生[15]。Wang等[16]基于美籍华人的DR危险因素分析发现,使用胰岛素治疗是DM患者发生DR的独立危险因素。本研究再次得到证实。本研究发现,FBG≥8.92 mmol·L-1是DM患者发生DR的独立影响因素,与Jampol等[17]的研究结果相似。但血糖水平受运动、饮食、降糖治疗等的影响,而本研究只分析了临时1次的血液数据,选择偏倚较大,因此该结论还有待进一步证实。有研究认为,包括HDL-c降低和TC、TG、LDL-c升高的脂代谢紊乱也参与DR的发生和进展[18]。本研究也发现,DR组患者的TG、LDL-c水平明显高于NDR组。因此,在关注降糖治疗的同时,也有必要关注患者血脂情况。血脂升高影响DR机理尚不十分明确,推测可能是由于血脂升高,可通过非酶促糖基化多元醇通路引起组织过氧化,并导致血管壁破损,内皮功能紊乱,还可改变细胞膜脂质结构,最终导致微血栓形成,造成视网膜屏障破损,引起DR的发生。SUA是机体内重要的内源性水溶性抗氧化剂,与微血管病变进展有关[19]。本研究发现,SUA是DR的危险因素,与佘新平等[8]的研究结果一致。这可能是由于高SUA可在高糖环境下促进细胞间黏附分子1、肿瘤坏死因子(TNF-α)、单核细胞趋化蛋白1表达,增加Notch信号通路活性,从而促进DR发生[20]。SUA还可通过氧化应激、炎症、内皮功能障碍等途径在DR发生发展中发挥关键作用。本研究进一步构建DM患者发生DR的Nomogram预测模型,并采用区分度(C-index)验证模型准确性,结果发现,Nomogram模型区分度高,具有较好的预测价值,一定程度上可作为临床DM患者发生DR的辅助预测工具。但由于时间有限,经费受限的原因,本研究样本量较少,Nomogram模型的临床实践价值还需更多的临床数据验证。
在各独立影响因素中,相较于DM病程、胰岛素治疗史、口服药物治疗史,SUA和FBG为临床上较常使用的血液生化指标,且TG影响DR机理尚不确切[21]。因此,本研究仅分析SUA和FBG的交互作用是否会影响DR发生。本研究通过单因素和多因素Logistic回归模型均证实,SUA、FBG对DM伴DR患者具有两两正交互作用。FBG、SUA不仅是DM患者发生DR的独立危险因素,而且二者对患者发生DR具有协同效应,其中两个因素同时存在时患者DR患病风险均高于单独存在时的患病风险。本研究进一步通过ROC对FBG、SUA对DR的影响进行评估,发现FBG、SUA二者协同交互作用对DM伴DR的诊断价值大于二者单独存在对DR的诊断价值。分析其原因可能是由于DM患者体内的嘌呤氧化酶活性升高,导致机体内黄嘌呤生成SUA增加;同时由于DM患者常伴肾小球缺氧状况,可加快乳酸生成,结果竞争性地抑制了SUA的排出[22]。因此,临床实践中,若DM患者把FBG指标控制在正常值范围,就能够延缓或减小高SUA的发生,从而减小并发症的发生及恶化。
4 结论
SUA≥297.73 μmol·L-1及FBG≥8.92 mmol·L-1是影响DM患者发生DR的危险因素。FBG与SUA二者协同交互作用对DM伴DR的诊断价值大于二者单独存在对DR的诊断价值。本研究不足在于样本量较少,且为单中心研究,未对DR进行分期分析,也未对DM患者的口服药物种类、胰岛素种类及用量进行深入探讨。
