大黄素抑制胃癌AGS细胞YAP1、FOXD1基因表达及相关机制
2024-01-30顾天刘春宏张飞钱薇朱艳秋褚明亮刘杰民
顾天 刘春宏 张飞 钱薇 朱艳秋 褚明亮 刘杰民
贵州中医药大学第一附属医院 1检验科(贵阳 550001);2研究生院(贵阳 550002);3贵州省人民医院内镜中心(贵阳 550002)
胃癌是消化系统最常见的恶性肿瘤,虽然近年来胃癌的治疗方法进展迅速,但是晚期胃癌患者的病死率依然居高不下[1-2],还需继续探寻新的治疗方式及治疗药物。大黄是传统中医常用的一味药材,其具有泻热毒、破积滞、行瘀血的功效[3],大黄素是大黄的重要有效成分,现代药理研究发现其具有抗肿瘤、抗炎、免疫调节、利胆保肝、镇痛等多种药理作用[4]。糖酵解代谢途径是肿瘤细胞获取能量的主要方式[5],其中己糖激酶Ⅱ(HK2)是催化糖酵解代谢途径的首个关键酶。HK2 在肿瘤细胞中的异常表达升高意味着糖酵解代谢的高度活化,可以显著促进肿瘤细胞增殖、侵袭、转移等[5-8]。Yes 相关蛋白1(YAP1)是Hippo 信号通路的核心效应因子,叉头盒基因D1(FOXD1)是进化保守的叉头盒基因家族成员。二者均被认为是一种致癌基因,在肺癌、肝癌、乳腺癌、结直肠癌及肾细胞癌等肿瘤细胞中表达上调,参与细胞的恶性转化及肿瘤的发生发展等[9-11]。
迄今为止,致癌基因YAP1、FOXD1 在胃癌中表达情况尚无报道,大黄素是否抑制二者表达及其相关机理尚不清楚。因此,本研究将通过TCGA生物信息数据库及相关体外实验对大黄素在胃癌细胞AGS 中的作用进行研究,期望为其今后的临床应用提供部分理论依据。
1 材料与方法
1.1 主要试剂大黄素、丙酮酸(纯度98%)购自上海阿拉丁生化科技股份有限公司;HK2、YAP1、FOXD1 和GAPDH 抗体购自Proteintech 公司;胃癌细胞AGS 由新乡医学院病理教研室惠赠;胃正常上皮细胞GES-1 由上海交通大学医学院附属仁济医院临床干细胞研究中心惠赠。
1.2 试验方法
1.2.1 TCGA 数据库生物信息分析UALCAN 在线分析网站[12](https://ualcan.path.uab.edu/analysis.html)是一款TCGA 数据库的可视化在线网站,通过该网站分析 TCGA 数据库中胃癌肿瘤样本和正常组织样本中HK2、YAP1 和FOXD1 基因的表达情况。
1.2.2 检测大黄素在GES-1 和AGS 细胞中的半数致死量及对AGS 细胞增殖能力影响取对数生长期的GES-1 和AGS 细胞接种于96 孔板中并过夜培养至细胞贴壁。在胃正常上皮细胞GES-1 实验组中加入已经配平无水乙醇溶解剂的大黄素药物(0、25、50、75、100、125 μmol/L)。在胃癌细胞AGS 实验组中分别加入已经配平无水乙醇溶解剂的大黄素药物(0、5、10、20、30、60 μmol/L);设置不含药物及细胞的培养基作为空白组。每组设置3 个复孔,置于培养箱中培养24 h 及48 h 后,每孔加入10 μL CCK-8 试剂,继续孵育1 h,并在酶标仪(450 nm)上检测每孔的OD值,并计算细胞活性。通过IC50 结果,本实验在随后实验中取10、20、30 μmol/L 的终浓度作用于胃癌细胞AGS 48 h后,检测其对AGS 的增殖能力影响。以上实验重复3 次。
1.2.3 使用划痕实验检测AGS 细胞迁徙能力 将胃癌AGS 细胞接种于6 孔细胞培养板,分组加入含不同浓度大黄素(10、20、30 μmol/L)的1%胎牛血清RPMI1640 培养液培养24 h 和48 h。按照说明书的操作步骤进行试验,以上实验重复3 次。
1.2.4 使用Transwell 实验检测AGS 细胞侵袭能力将胃癌AGS 细胞制成3 × 106个/ mL 的细胞悬液,Transwell 下室加入含20% FBS 的RPMI1640培养液800 μL。Transwell 上室加不同浓度大黄素的胃癌细胞AGS(细胞浓度2 × 106/mL,1% FBS RPMI1640 培养液),在培养箱中培养24 h。最后用4%多聚甲醛固20 min 后,通过结晶紫对上室底部细胞进行染色,并擦拭掉上室内部的细胞,并在显微镜下观察并分别计数。以上实验重复3 次。
1.2.5 添加外源性丙酮酸实验将AGS 细胞分为空白对照组和丙酮酸组(丙酮酸和培养基按照1∶2 000 添加),分别干预处理48 h 后,提取蛋白检测YAP1、FOXD1 蛋白的表达变化。以上实验重复3 次。
1.2.6 使用Western blot 方法检测HK2、YAP1、FOXD1 蛋白的表达收集各组胃癌AGS 细胞,并用RIPA 蛋白裂解液提取细胞总蛋白,并用BCA 蛋白浓度测定试剂盒检测蛋白浓度及煮沸加热变性。SDS-PAGE 电泳、转膜、封闭后加抗体HK2、YAP1、FOXD1、GAPDH 及二抗等,最后运用ECL化学发光法进行显影,并在Image J 软件上分析蛋白表达量。以上实验重复3 次。
1.2.7 统计学方法采用SPSS 21.0 处理数据,计数资料以(±s)表示,两组间比较采用独立样本t检验,多样本间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 检测大黄素在AGS 和GES-1 细胞中的半数致死量及大黄素对AGS 的增殖能力影响半数致死量(IC50)结果显示,大黄素对AGS 细胞的药理抑制能力非常强,其24 h 和48 h 的IC50[(38.24±6.12)μmol/L 和(20.44±3.66)μmol/L],显著低于胃正常上皮细胞GES-1 24 h 和48 h 的IC50[(68.49±7.75)μmol/L 和(124.7±2.07)μmol/L](图1A,1B,1C,均P<0.05)。
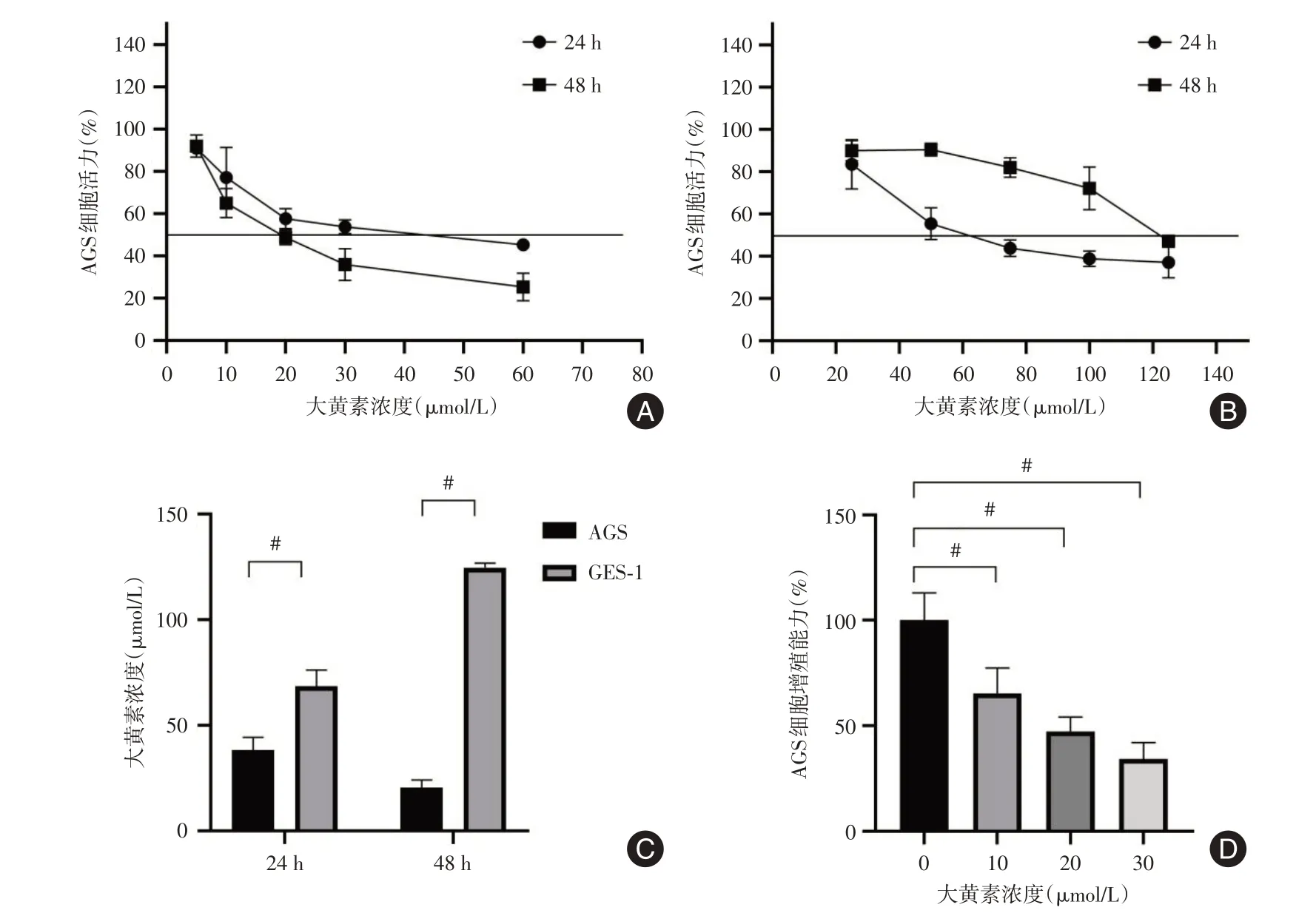
图1 大黄素在不同浓度和不同时间点对胃上皮细胞GES-1 与胃癌细胞AGS 细胞活力的影响Fig.1 Effect of emodin on the viability of gastric epithelial GES-1 cells and gastric cancer AGS cells at different concentrations and time points
通过IC50结果,本实验在随后实验中取10、20、30 μmol/L 的终浓度作用于胃癌细胞AGS,进行下一步相关实验。CCK8 增殖实验显示10、20、30 μmol/L 的终浓度大黄素均可以显著抑制胃癌细胞AGS 48 h的增殖能力(图1D,均P<0.05)。
2.2 检测大黄素对胃癌细胞AGS 迁移能力的影响通过划痕实验的结果显示,大黄素干预后的胃癌细胞的愈合率低于对照组,且浓度越高迁移率就越低,其中30 μmol/L 浓度大黄素可以显著抑制胃癌细胞AGS 24 h 和48 h 的迁移能力,有显著的统计学意义(图2,均P<0.05)。
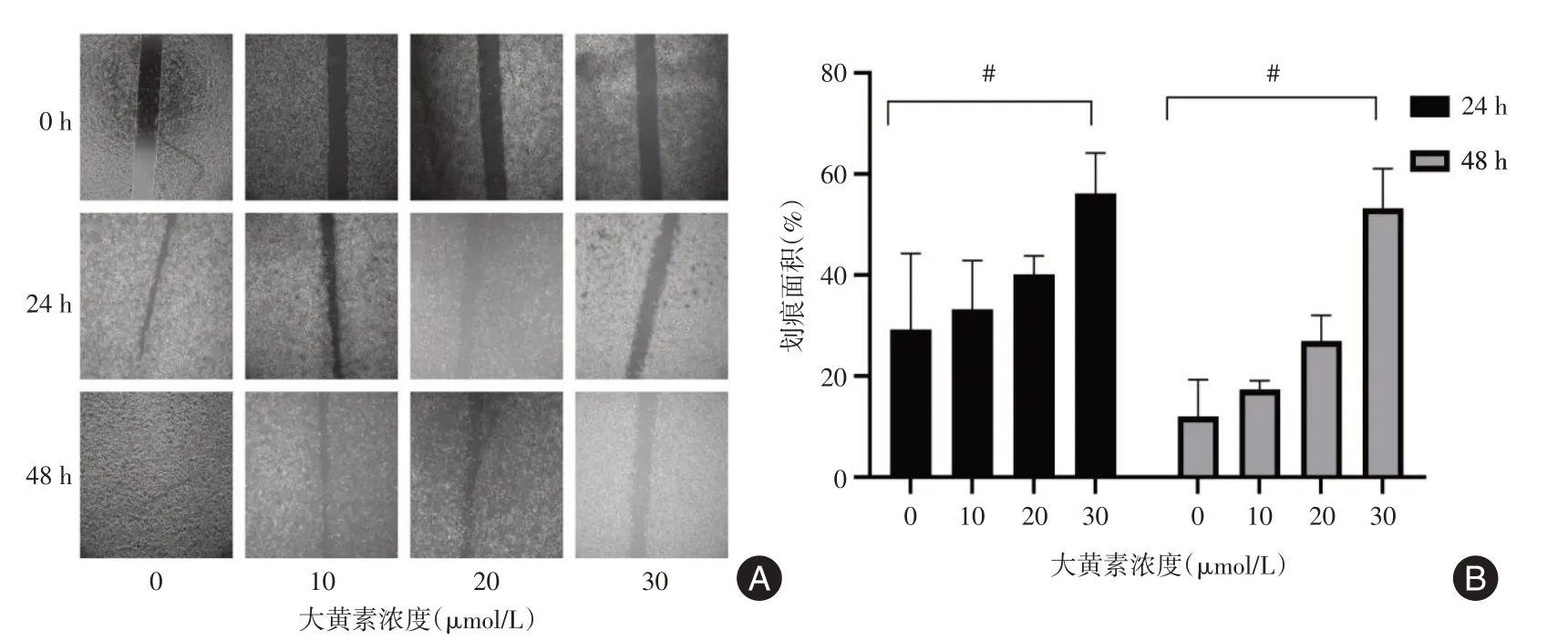
图2 大黄素在不同浓度和不同时间点对胃癌细胞AGS 划痕迁移的影响Fig.2 Effects of emodin on AGS scratch migration of gastric cancer cells at different concentrations and time points
2.3 检测大黄素对胃癌细胞AGS 侵袭能力的影响通过Transwell 侵袭实验的结果显示,大黄素干预后的胃癌细胞的侵袭能力低于对照组,且浓度越高侵袭率就越低。0、10、20 和30 μmol/L 大黄素干预后,各自穿膜的细胞数分别为3 093±210、1 550±350、816±76、527±64个。与0 μmol/L相比较,10、20、30 μmol/L 大黄素浓度处理后的胃癌细胞AGS 穿膜细胞数明显降低,差异有统计学意义(图3,均P<0.05)。
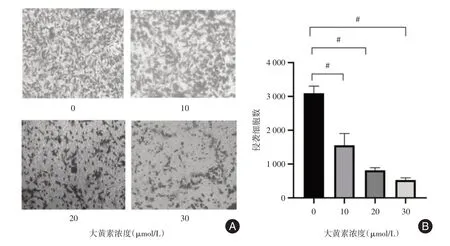
图3 不同浓度大黄素对胃癌细胞AGS 侵袭能力的影响Fig.3 Effects of different concentrations of emodin on the invasion ability of gastric cancer AGS cells
2.4 分析TCGA 数据库中HK2、YAP1 和FOXD1在胃癌及正常组织中的表达情况使用UALCAN在线在线分析网站(http://ualcan.path.uab.edu/index.html)分析 TCGA 数据库中胃癌肿瘤样本和正常组织样本中HK2、YAP1 和FOXD1 基因差异表达情况。结果显示HK2、YAP1 和FOXD1 基因在胃癌组织中的表达均显著高于正常胃组织(图4,均P<0.05)。
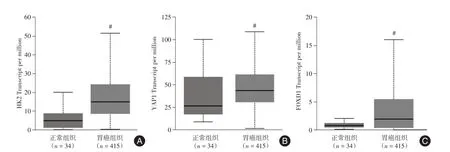
图4 UALCAN 在线分析HK2、YAP1、FOXD1 在胃癌组织和正常组织中的表达Fig.4 HK2,YAP1 and FOXD1 expression were analysed through UALCAN online in gastric cancer tissues and normal tissues
2.5 检测大黄素对胃癌AGS 细胞中HK2、YAP1和FOXD1 的蛋白表达影响使用不同浓度大黄素干预胃癌细胞AGS,Western blot 结果显示与对照组(0 μmol/L)相比,10、20 μmol/L 和30 μmol/L浓度大黄素干预AGS 24 h 后,糖酵解代谢通路关键酶HK2 蛋白表达水平明显被抑制,结果具有统计学意义(图5,均P<0.05)。伴随着糖酵解代谢通路关键酶HK2 的下降,致癌基因YAP1、FOXD1蛋白表达水平也明显被抑制,结果具有统计学意义(图5,均P<0.05)。
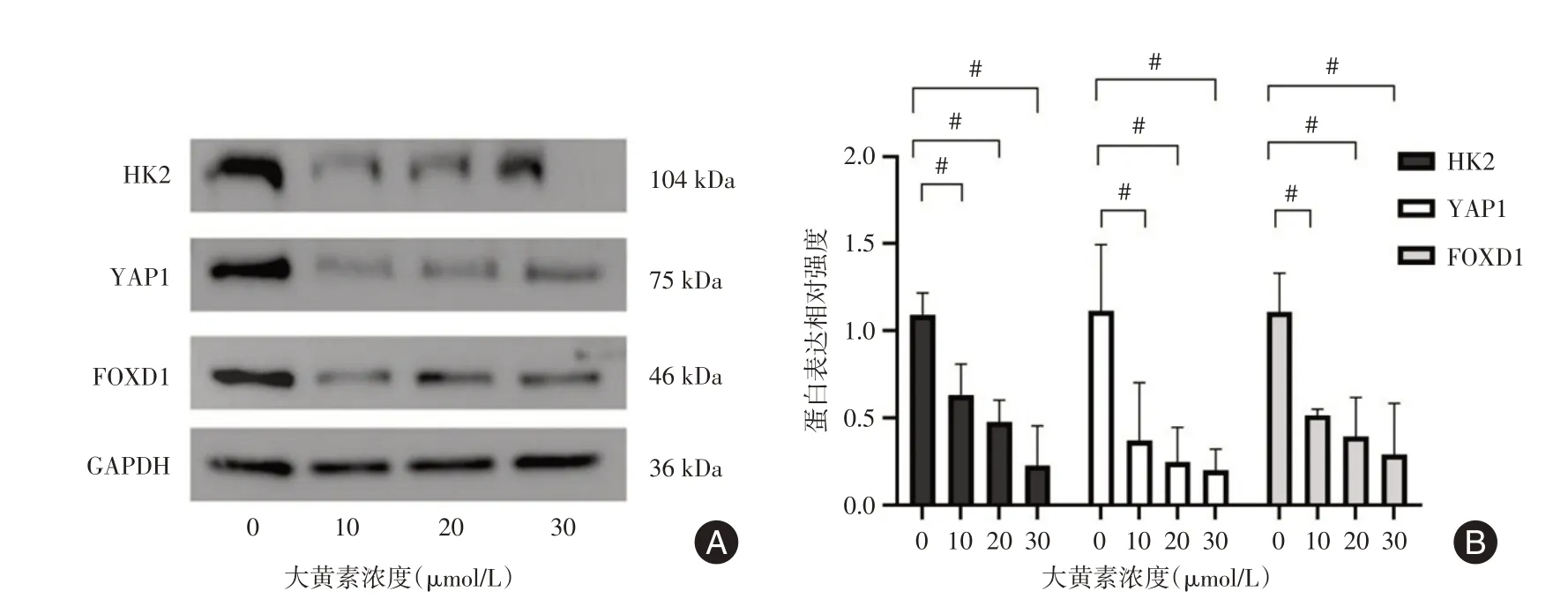
图5 大黄素对胃癌细胞AGS 中HK2、YAP1、FOXD1 蛋白表达水平的影响Fig.5 Effect of emodin on HK2,YAP1,and FOXD1 protein expression in gastric cancer AGS cells
2.6 检测外源性丙酮酸对胃癌细胞AGS 中YAP1、FOXD1 蛋白表达的影响外源性丙酮酸可以增强糖酵解代谢通路[13],因此本试验中,单独补充外源性糖酵解产物丙酮酸,检测胃癌细胞AGS 糖酵解代谢通路强化后,YAP1 和FOXD1 的表达情况。Western blot 结果显示,补充外源性糖酵解产物丙酮酸后,与空白对照组比较,胃癌细胞AGS 中致癌基因YAP1 和FOXD1 的蛋白表达显著增高(图6,均P<0.05)。

图6 丙酮酸提高胃癌细胞AGS 中YAP1 及FOXD1 的蛋白表达Fig.6 Pyruvate increases the protein expression of YAP1 and FOXD1 in gastric cancer AGS cells
3 讨论
胃癌是最常见的恶性肿瘤之一,部分患者特别是农村患者确诊后多属于晚期,无法进行根治性手术切除,而靶向性等药物治疗相对昂贵,对家庭和社会造成重大的经济负担[2,14-15]。大黄味苦性寒,凉血解毒,清热泻火,活血祛瘀,其化学成分有100 多个,大黄素是其主要成分之一,具有明显抗肿瘤作用[4]。
本实验结果表明,大黄素对胃癌细胞AGS 的药理抑制作用非常明显,其24 h 和48 h 大黄素的IC50在胃癌细胞AGS 中显著低于胃正常上皮细胞GES-1(图1A,1B,1C)。CCK8细胞增殖实验发现不同浓度的大黄素(10、20 和30 μmol/L)均可以显著抑制胃癌细胞AGS 的增殖能力。
划痕实验显示30 μmol/L浓度的大黄素可以显著抑制胃癌细胞AGS 的迁移能力。Transwell 实验表明,不同浓度的大黄素(10、20和30 μmol/L)均可以显著抑制胃癌细胞AGS 的侵袭能力。以上提示大黄素体外具有明显抗胃癌AGS 细胞作用。
糖酵解代谢途径是肿瘤细胞获取能量的主要方式,其与肿瘤细胞的多种生物学恶性特征密切相关[5]。HK2 是糖酵解代谢通路中的首个重要关键酶,其表达量不仅反映了肿瘤细胞糖酵解代谢的程度,并且反映了肿瘤的恶性程度[6-8]。本研究结果显示HK2 基因在胃癌组织中表达显著高于胃正常组织,而大黄素处理胃癌细胞AGS 后,HK2 蛋白表达水平显著降低,推测大黄素可以抑制胃癌AGS 肿瘤细胞的糖酵解代谢途径。
YAP1 是Hippo 信号通路中一种重要的信号因子,它在多种肿瘤的发生发展中起着重要作用,包括肝癌、胃癌、结直肠癌、卵巢癌、膀胱癌、乳腺癌等,参与肿瘤细胞的增殖及抗凋亡等[16-17]。研究[18]显示在胃癌细胞中通过调控YAP1 可抑制癌细胞的增殖和迁移,过表达YAP1的胃癌细胞MKN45可以促进巨噬细胞糖代谢从而促进自身对5-Fu 的化疗抵抗[19]。FOXD1是转录因子forkhead box 家族成员之一,广泛参与细胞信号转导、周期调控、生理代谢等过程。FOXD1 在多种肿瘤组织中表达上调,包括肺癌、胰腺癌、头颈部鳞状细胞癌、结直肠癌、乳腺癌及肾细胞癌等,参与肿瘤细胞的恶性转变及发生进展[9-11,20-23]。近期的研究[10,24]亦发现,FOXD1 与糖酵解代谢途径密切相关,能通过该途径促进胰腺癌、鼻咽癌等肿瘤细胞的增殖、侵袭和转移。本研究通过UALCAN 在线网站分析TCGA数据库,发现YAP1 和FOXD1 基因在胃癌组织中的表达均显著高于正常组织。而使用大黄素干预胃癌细胞AGS 后,Western blot 实验结果显示,YAP1 和FOXD1 蛋白表达水平均明显下调,提示大黄素对其有明确的抑制作用。由于本研究同时发现大黄素可以显著抑制AGS 细胞的糖酵解代谢关键酶HK2,那么大黄素是否通过糖酵解代谢途径抑制了致癌基因YAP1 和FOXD1 的表达?丙酮酸是糖酵解的中间产物,在糖酵解代谢中发挥着重要作用,研究表明增加外源性丙酮酸可以增强糖酵解代谢通路[13],因此本试验中,单独补充外源性丙酮酸,检测胃癌细胞AGS 糖酵解代谢通路强化后,YAP1 和FOXD1 的表达情况。结果显示,补充外源性丙酮酸后,YAP1 和FOXD1 的蛋白表达都显著升高,即其表达伴随着糖酵解代谢的增强而增高。以上结果提示,大黄素可能通过抑制AGS 细胞的糖酵解代谢途径,进一步抑制致癌基因YAP1 和FOXD1 的表达,从而抑制细胞的增殖、迁移和侵袭等肿瘤生物学表型。
总之,本实验初步揭示了大黄素和胃癌AGS细胞糖酵解代谢途径及致癌基因YAP1 和FOXD1的部分关系。希望以上研究能为大黄素未来的临床应用提供一些理论基础。
【Author contributions】GU Tian and LIU Chunhong performed the experiments and wrote the article.CHU Mingliang and LIU Jiemin designed the study and reviewed the article.ZHANG Fei ,QIAN Wei and ZHU Yanqiu participated experiment research,data analysis.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
