17α-乙炔雌二醇胁迫下零价铁对硝化污泥中抗性基因的影响
2024-01-29王丽丽李安婕张传国交通运输部天津水运工程科学研究院水路交通环境保护技术交通行业重点实验室天津300456北京师范大学环境学院水沙科学教育部重点实验室水环境模拟国家重点实验室北京00875
王丽丽 ,李安婕 ,张传国 (.交通运输部天津水运工程科学研究院水路交通环境保护技术交通行业重点实验室,天津300456;2.北京师范大学环境学院,水沙科学教育部重点实验室,水环境模拟国家重点实验室,北京 00875)
近年来,抗生素抗性基因(ARGs)污染正成为对全球生态环境安全和人体健康领域的的巨大威胁,同时,人工合成雌激素乙炔基雌二醇(EE2)因其内分泌干扰性强及生态风险大等特点而受到了广泛关注.活性污泥作为污水处理厂中典型生物处理工艺是多种、丰富ARGs 的储存库和排放源[1].具有硝化能力的活性污泥,硝化污泥可有效去除抗生素、雌激素类新污染物[2-3],已有文献研究表明三氯卡班、磺胺甲恶唑等新污染物可增加硝化污泥中的ARGs 丰度[4-5].然而目前研究大多集中在提高硝化污泥工艺去除EE2 的效率方面,有关EE2 对硝化污泥中的ARGs 的影响鲜有报道.
零价铁(ZVI)作为新兴的低成本、绿色环保材料,已广泛应用于污水处理领域.已有研究表明ZVI 不仅可提高生物处理工艺去除污水中常见污染物(如C、N、S、P 元素)的效率[6],也可增强硝化污泥中雌激素EE2 等药品类新污染物的矿化程度和去除效果[7].同时ZVI 被报道可以减少剩余污泥厌氧消化产生的ARGs 丰度[8],然而ZVI 对硝化污泥中ARGs的影响尚未明确.值得注意的是,某些ARGs 即使在丰度水平很低的情况下,也可能对人类健康具有较大的威胁[9-10],因此在考察EE2及ZVI对硝化污泥中ARGs 的影响时,除丰度外也需要考虑ARGs 的抗性风险问题.
本研究借助宏基因组测序技术考察ZVI对硝化污泥处理EE2 过程中ARGs 的影响,评估EE2 及ZVI作用下硝化污泥中的ARGs 抗性风险,探究菌群结构与ARGs之间的相关性,以期为ZVI削减生物脱氮工艺处理药品类新污染物过程中ARGs 丰度,控制ARGs 抗性风险提供科学依据与理论指导.
1 材料与方法
1.1 实验材料
硝化污泥接种自实验室一短程硝化颗粒污泥序批式反应器(SBR).ZVI 颗粒纯度大于99%,直径为1mm,BET 比表面积为0.05m2/g.EE2(纯度>98%)购于Dr.Ehrenstorfer 公司(德国).其余试剂均为优级纯,购自中国国药集团化学试剂有限公司.
1.2 序批式反应器运行
将初始污泥浓度(MLSS)为4.5g/L 的硝化污泥接种到两个柱状有机玻璃SBR(高42cm,直径为3.3cm,工作体积为0.36L).SBR 底部进水,中部出水,交换比为50%,底部曝气,曝气流量用流量计控制在0.125L/min.每个运行周期共4h,时间分配为:进水5min,曝气225min,污泥沉淀5min,最后出水5min.反应器中水温保持在20℃左右.SBR 进水为人工配制,包括NH4Cl(320mg N/L)、EE2(10µg/L)、营养物质、微量元素和 NaHCO3.营养物质和微量元素参考Wang 等[2]人研究,NaHCO3的添加量依据出水pH 值进行调整,以维持出水pH 值在中性至碱性范围内.为探究环境浓度的EE2 对硝化污泥中抗性基因的影响,本研究将EE2 浓度设置在µg/L 水平.参考Xu等[11]人研究,将其中一SBR 中加入30g/L 的ZVI,命名为EE2+ZVI 组,另一SBR 命名为EE2 组,ZVI 投加浓度参考自Yang 等[12]人研究.反应器运行共240个循环.
1.3 宏基因组测序及生物信息学分析
采用宏基因组测序技术对EE2及ZVI暴露下硝化污泥中ARGs 丰度及菌群结构变化进行探究.接种污泥和SBR 实验结束时两反应器中污泥样品用0.01mol/L PBS 清洗3 次后,使用E.Z.N.A.Soil DNA Kit 试剂盒(美国OmegaBio-tek)对样品DNA 进行抽提,随后检测DNA 浓度、纯度和完整性.使用Covaris M220 超声破碎仪(基因有限公司)将DNA片段化,用于后续构建文库,使用NEXTflex Rapid DNA 建库试剂盒(美国Bioo Scientific)进行建库,随后在Illumina NovaSeq 测序平台进行测序,原始数据已上传至 NCBI 数据库(BioProject ID PRJNA871801).
对测序数据进行质控,使用拼接软件MEGAHIT 软件对质控后的序列进行拼接组装.在拼接结果中筛选大于等于300bp 的Contigs 作为最终的组装结果.使用Prodigal 软件对拼接结果中的Contigs 进行开放阅读框预测,选择其中长度大于等于100bp 的基因序列.通过CD-HIT 软件对本研究中样品预测出的基因序列按照序列相似度、覆盖度大于等于90%的原则进行聚类,构建非冗余基因组集.使用SOAPaligner 软件,将3 组样品中的高质量序列与上述非冗余基因集按照95%相似性进行对比.按照TPM(transcripts per million)计算方法统计基因在对应样品中的丰度信息[7],即以该基因通过基因长度标准化后的基因丰度在该样本中所有基因长度标准化后的基因丰度总和中占比的百万倍来表示.通过 Diamond 软件将基因集与 CARD 数据库(Comprehensive Antibiotic Resistance Database)、NR数据库(Non-Redundant Protein Sequence Database)及KEGG 数据库(Kyoto Encyclopedia of Genes and Genomes)对比,对比类型BLASTP,e-value 参数设置为1×10-5,以获得样品中的抗性功能、物种分类和KEGG 功能注释信息.
1.4 数据分析及绘图
使用OriginPro 2022 或R 4.3.0 软件进行数据处理及绘图.
2 结果与讨论
2.1 EE2 及ZVI 对硝化污泥ARGs 丰度的影响
接种污泥、EE2 组及EE2+ZVI 组,3 组样品中的ARGs 丰度如表1所示,接种污泥、EE2 组及EE2+ZVI 组在抗性机制水平上的ARGs 总丰度分别是38232.82,38957.24 及37052.06TPM,EE2 的加入使污泥中的ARGs 丰度提高了724.42TPM,而ZVI 降低了该趋势.此外,KEGG 功能注释结果表明,ZVI 使得信号传导(Signal transduction)通路的丰度降低(接种污泥、EE2 组及 EE2+ZVI 组中丰度分别为28213.07,28518.34 及26686.60TPM),有研究发现信号传导通路的增强驱动了剩余污泥中ARGs 的传播[13],这说明ZVI 在控制硝化污泥中ARGs 的传播方面具有潜力;双组分系统(Two-component system)是细菌中常见的调节机制,细菌可以通过此系统感知一系列刺激并作出适当的适应性反应,在以往研究中,该系统通路的富集与细菌对抗生素的抗性有关[14],EE2+ZVI 组中该通路丰度(20875.44TPM)低于接种污泥(22455.70TPM)及EE2组(22807.10TPM),上述KEGG 功能注释结果与前文中ZVI 削减了硝化污泥处理EE2过程中ARGs的现象一致.nm或µm尺寸的ZVI 被报道可通过降低ARGs 宿主细菌的丰度而减少鸡粪、牛粪或剩余污泥厌氧处理过程中的ARGs 丰度[8,15-16],因此可结合菌群结构变化进一步探究本研究中ZVI 降低硝化污泥中ARGs 的机理.

表1 各抗性机制ARGs 丰度(TPM)Table 1 ARGs abundance for resistance mechanism(TPM)
硝化污泥中抗性机制共有6 种(表1),其中抗生素外排泵是3 组样品中最主要的抗性机制,其次为抗生素靶点改变和抗生素靶点保护.研究表明,外排泵在细菌中广泛存在,在介导细菌多重耐药中起着重要作用[17],抑制外排系统中外排泵蛋白的表达量可以降低细菌对药物的外排作用,减缓耐药性的产生.本研究中丰度前10的ARGs包括macB、tetA(58)、novA、mtrA、bcrA、oleC、patA、evgA 及evgS,均属于外排泵机制,涉及大环内酯类、四环素类、氨基香豆素、青霉烷、肽类及氟喹诺酮类等抗生素.
2.2 EE2 及ZVI 对硝化污泥中ARGs 类型及组成的影响
3 组样品中均包含20 种ARGs 类型(ARG type,图1),其中多重耐药(Multidrug)为主要抗性类型,其次为大环内酯-林可酰胺-链霉菌素(MLS)及糖肽类(Glycopeptide).EE2加入后上述类型的ARGs的丰度分别增加了267.27,274.50 和189.34TPM.而ZVI 减弱了上述ARGs 的丰度在EE2 作用下增强的趋势,丰度相比EE2 组污泥分别降低了476.20,221.72 和365.52TPM.有研究表明EE2 暴露有利于硝化污泥中对不同类别的抗生素均具有抗药性的细菌的生长,如Comamonas[2,18],这说明尽管EE2 并非抗生素类物质,但可能通过影响菌群结构而间接影响硝化污泥中ARGs 丰度.因此,如前文所述,上述现象或可与菌群结构联合分析,以明确相应机制.接种污泥中有502 个ARGs 亚型(ARGs subtype),特有亚型为8个,EE2 组和EE2+ZVI 组分别有496 和499 个亚型,特有亚型均为3 个,说明EE2 及ZVI 对硝化污泥中ARGs 亚型种类影响较小.

图1 ARG 类型水平上的ARGs 丰度Fig.1 ARGs abundance at ARG type level
将ARGs 亚型水平上的ARGs 丰度(前50)进行样品间Z 分数标准化聚类分析,结果显示EE2 和ZVI 的添加改变了硝化污泥中ARGs 亚型的分布.三组样品分为了两大类,一类为接种污泥,一类为EE2 组和EE2+ZVI 组,后者的共同点是添加了EE2,两类通过有无EE2 区分,这说明EE2 的影响大于ZVI 的影响(图2).ZVI 增加了硝化污泥中mexQ、tetW、kdpE、baeR 和PmpM 的丰度,涉及多重耐药、四环素类、氨基糖苷类这3 种ARGs 类型.EE2 增加了硝化污泥中的evgA、efrB、lsaC、mtrA、smeD、efrA、patB、AcrS、tetM、ANT(3’’)-IIa、baeS 和OprM 的丰度,涉及多重耐药、氟喹诺酮类、四环素类、氨基糖苷类这4 种ARGs 类型,而ZVI 降低了上述ARGs 的丰度.
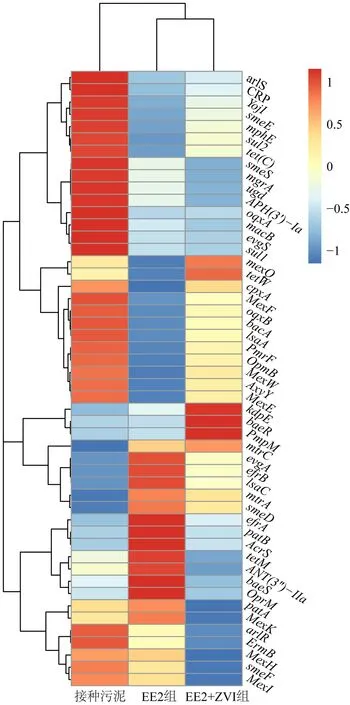
图2 ARG 亚型水平上的ARGs 丰度Fig.2 ARGs abundance at ARG subtype level Z 分数标准化后
2.3 EE2 及ZVI 对硝化污泥中抗性风险的影响评估
为减轻全球目前普遍存在的抗生素耐药性危机,除了ARGs 的丰度和类型外,还迫切需要全面了解ARGs 在污水处理单元中的健康风险.Zhang等[9]在2022年创建了一个对ARGs 的健康风险进行评估的数据库,该数据库根据2561 种ARGs 亚型的人类可及性、可移动性、致病性和临床可用性,对其进行了风险排序,共分为4 个级别,其中Q1风险最高,其次为Q2、Q3、Q4.本研究依据该数据库对3 组硝化污泥中的ARGs 抗性风险进行了评估(图3),可以发现EE2 组中落在高风险等级Q1和 Q2 的丰度有所提高,分别提高了 555.75 及151.08TPM,而添加ZVI 组相比硝化污泥和EE2 组中各等级的丰度均有减少,相比接种污泥减少了1004.87TPM,相比EE2 组减少了1459.63TPM,上述结果说明EE2 可能增加了硝化污泥中的ARGs抗性风险,而ZVI 减少了抗性风险.多重耐药是硝化污泥中丰度占比最大的高风险(Q1 和Q2 等级)ARGs 类型,占比49.23%,因此硝化污泥中多重耐药ARGs 需被重视.

图3 ARGs 抗性风险评估Fig.3 ARGs resistance risk assessment
2.4 硝化污泥中ARGs 与细菌群落间的相关性
携带不同ARGs 的细菌可能在不同环境条件下增多或减少,从而改变ARGs 的分布[19].本研究分析了3 组硝化污泥样品中的群落结构,分别检测到11个门水平和144 个属水平的细菌,图4 展示了丰度占比≥1%的门和属.在门水平,变形菌门(Proteobacteria)是本研究中硝化污泥细菌菌群结构的主要组成部分(图4a),在细菌群落总丰度中占比为71.86%(接种污泥)、76.48%(EE2 组)及 70.21%(EE2+ZVI组).Saunders 等[20]的研究表明在污水处理厂的活性污泥微生物种群中 Proteobacteria 占据核心地位,Proteobacteria 被报道可参与碳氢化合物、酚类的生物降解[21-22].在EE2 暴露下的240 个循环后,Proteobacteria 的相对丰度增加了4.62%,这可能是由于 EE2 促进了某些可降解复杂有机污染物的Proteobacteria 门细菌生长,与前人的研究一致[2].而ZVI 及EE2 联合作用下其丰度并未增加,说明ZVI并不能促进Proteobacteria 生长.Proteobacteria 门细菌被报道可驱动生物体系中ARGs 水平[23],因此可推测本研究中EE2 促进了Proteobacteria 门细菌生长,进而增加了硝化污泥中ARGs 丰度,而ZVI 表现出了对Proteobacteria 的抑制,减少了EE2 胁迫作用下ARGs 丰度增长的趋势.

图4 门水平(a)和属水平(b)上的微生物组成Fig.4 Microbial composition at phylum level(a)and genus level(b)
基于皮尔森相关性分析ARGs 与微生物群落之间的关系(图5),结果表明丰度前20 的ARGs 均与丰度前20 的菌属有不同程度的相关性.研究结果表明丰度前20 的微生物菌属中有10 种菌属与ARGs 成显著正相关(P<0.05),10 种菌属与ARGs 成显著负相关(P<0.05).徐秋鸿等研究认为当微生物与某些ARGs 呈显著正相关关系,微生物可能是这些ARGs的潜在宿主;当微生物与某些ARGs 呈显著负相关关系,微生物可能会影响这些ARGs 的水平转移[24].

图5 ARGs 与微生物群落间相关性Fig.5 Correlation between ARGs and microbial community
本研究中部分菌属,如厌氧绳菌纲未分类属(g_unclassified_c_Anaerolineae)、鞘脂单胞菌属(g_Sphingopyxis)、伯克氏菌目未分类属(g_unclassified_o_Burkholderiales)、奥托氏菌属(g_Ottowia)及变形菌门未分类属(g_unclassified_p_Proteobacteria),与多种ARGs 显著正相关,涉及多种耐药机制,表明这些微生物可能是多种ARGs 的共同潜在宿主,可能对ARGs 的分布特征和水平转移产生影响,导致细菌产生多重耐药性[25].而部分ARGs 与多个菌属之间呈显著正相关,如patA、macB、brcA、oleC、mtrA及baeS,表明这些ARGs 可能有多个潜在的微生物宿主[26].
3 结论
3.1 硝化污泥处理EE2 过程中ARGs 丰度提高了724.42TPM,ZVI削减了此增长趋势,EE2及ZVI改变了ARGs 亚型的分布,但对ARGs 类型及亚型种类无明显影响.
3.2 ZVI 降低了硝化污泥中的抗性风险,多重耐药是硝化污泥中丰度占比最大的高风险(Q1 和Q2 等级)ARGs 类型,占比49.23%.
3.3 微生物群落是硝化污泥中ARGs 的重要驱动因子,鞘脂单胞菌属(Sphingopyxis)等菌属与多种ARGs 显著正相关,可能是多种ARGs 的共同潜在宿主.
