轻微型肝性脑病危险因素分析和列线图预测模型的构建及内部验证*
2024-01-29高晓红李培燕
高晓红 彭 芳 李培燕
延安大学附属医院感染病科 (陕西 延安, 716000)
肝性脑病(HE)是由急、慢性肝功能严重障碍或各种门-体分流异常所致的、以代谢紊乱为基础、轻重程度不同的神经精神异常综合征[1],是慢性肝病和急性肝功能衰竭患者常见的肝硬化并发症,严重影响感肝硬化患者的生存预后[2]。研究发现肝硬化患者日常行为能力异常与合并MHE有关[3],合并MHE的患者更易发生跌倒风险[4, 5]、交通事故[6]、易合并睡眠觉醒异常[7,8]。此外,MHE与肝硬化疾病进展相关,其能够识别出患上更严重肝硬化并发症的风险,合并MHE患者的肝硬化病情进展年发病率约增高3倍[9]。Ampuero等[10]研究发现MHE患者相比于没有MHE的患者更容易进展为显性肝性脑病(OHE),死亡风险更高。所以,早期筛查、及时适当干预治疗MHE对于改善肝硬化患者疾病结局非常重要。目前受限于现有诊断方案,尚无MHE的诊断金标准。MHE患病率高,对患者日常活动造成的影响严重,并且难以明确诊断。目前,如何为每位肝硬化患者实现科学有效的个体化MHE的预测,找到一个耗时短、方便、准确的MHE筛查方法仍为临床难题。
列线图是近年来较为常用的临床医学预测模型之一,可应用于生存概率分析或不良事件的发生预测。其可通过R软件将logistic回归分析筛选出的独立危险因素直观呈现出来,该模型可以实现对各种不良事件的个性化快速的预测。目前尚未发现有文献报告以列线图为模型构建OHE以及MHE的预测模型,故其对MHE的预测价值尚不清楚,可进一步探究列线图模型对肝硬化患者合并MHE的预测价值。
1 资料与方法
1.1 纳入及排除标准 纳入标准:①参照2019版《肝硬化指南诊疗指南》肝硬化诊断标准[11],诊断为肝硬化的患者;②年龄为18~65岁;③简明精神量表(MMSE)>25分;④同意参加本研究的肝硬化患者。排除标准:①目前处于2018版肝性脑病诊疗指南修订的肝性脑病分级标准HE1级及以上者;②近4周内有上消化道出血者;③有较为严重其他各个系统疾病;④合并神经系统疾病或精神疾病者;⑤近4周应用催眠、镇静类精神药物者;⑥近4周内使用过乳果糖、益生菌制剂、门冬氨酸鸟氨酸、利福昔明等药物治疗者;⑦与研究相关重要的指标缺失者;⑧不同意签署知情同意者以及其他因各种原因不能完成神经心理学测试者。
1.2 MHE诊断方法 本研究MHE的诊断方法依据2018版肝硬化肝性脑病诊疗指南[1],采用传统的神经心理学测试联合新的神经心理学测试进行诊断,NCT-A、NCT-BC联合S-ANT1。所有测试均在安静、明亮的室内环境中进行,并且由同一名测试者完成。3项测试结果同时为阳性诊断为MHE,由于NCT-A、NCT-BC测试、ANT结果受年龄和教育程度的影响,经受教育年限和年龄共同矫正的PHES可以使MHE诊断的准确性提高[1]。NCT-A参考标准为:异常值>27.861+0.548×age-0.821×education,SD:7.581[12];NCT-BC参考标准为:异常值>42.816+0.672×age-0.971×education, SD 9.173[12];S-ANT1的诊断临界值为20只动物。
1.3 主要观察指标
1.3.1 研究对象资料 ①一般资料:收集所有研究对象的姓名、性别、年龄、教育程度等一般资料;②实验室指标:收集所有研究对象入院时的肝纤四项、甲胎球蛋白、乙型肝炎系列定量指标、高敏HBV DNA、血常规、肾功能、肝功能、血凝系列、电解质、空腹血糖、血脂等实验室指标;③影像学指标:腹部超声或CT或MRI测量的门静脉主干直径、脾静脉内径、腹水量、有无合并脂肪肝、有无合并门静脉血栓、门脉高压情况、脾脏大小;瞬时肝脏弹性检测值(肝脏硬度值)、脂肪肝定量。
1.3.2 研究对象相关资料评价指标 ①精神意识状态:采用简明精神量表进行患者精神意识状态的评估,评分>25分者,排除现患显性肝性脑病;②吸烟史评价指标:持续1年以上、每天至少吸1支烟者为存在吸烟史;③饮酒史评价指标:患者既往长期、稳定的饮酒史;④乙型肝炎家族史评价指标:三代以内的直系亲属至少有1人患乙型肝炎或乙型肝炎所致的其他肝脏疾病;⑤上消化道出血史评价指标:患者既往有明确的呕血或便血史;⑥高血压病史评价指标:患者提供明确高血压病史,或住院后测得得血压值符合高血压的诊断标准考虑存在高血压病史;⑦糖尿病史评价指标:患者既往存在明确的糖尿病史或目前血糖指标符合糖尿病诊断标准;⑧OHE病史、TIPS术史等评价指标;既往有排除其他疾病所致的意识不清病史;有TIPS手术史;⑨肝硬化相关并发症评价指标:腹部超声、CT或MRI检查结果提示患者目前存在腹水、门脉高压、脾大。食管胃底静脉曲张依据胃镜结果或影像学提示食管下段迂曲呈蚯蚓状或串珠状等;⑩营养风险评价指标:采用营养风险筛查工具(nutritional risk screening 2002,NRS 2002)进行营养风险指标评估;感染风险评价指标:结合患者血常规及CRP、hs-CRP、SAA进行综合评估;评价肝功能情况指标:采用Child-Pugh评分及终末期肝病模型 (model for end-stage liver disease,MELD)对研究对象进行肝功能情况评估。

2 结果
2.1 MHE的危险因素分析
2.1.1 单因素分析 见表1。

表1 MHE组与无MHE组资料单因素分析
2.1.2 多因素分析 (1)变量赋值 单因素分析共筛选了15项可能的危险因素,分别是年龄、教育程度、合并腹水、营养风险、肝硬化病程、既往脾切除术史、总蛋白、天门冬氨酸氨基转移酶、白蛋白、谷草/谷丙、凝血酶原时间、血浆凝血酶原活动度、透明质酸、Child-Pugh分级、MELD评分。由于合并腹水、肝硬化失代偿期、总蛋白、白蛋白、Child-Pugh分级、凝血酶原时间这些因素之间可能存在相互影响,谷草/谷丙与天门冬氨酸氨基转移酶之间可能存在相互影响,所以最终纳入年龄、教育程度、合并营养风险、MELD评分、透明质酸、天门冬氨酸氨基转移酶、血浆凝血酶原活动度、Child-Pugh分级8项因素,各因素赋值情况见表2。
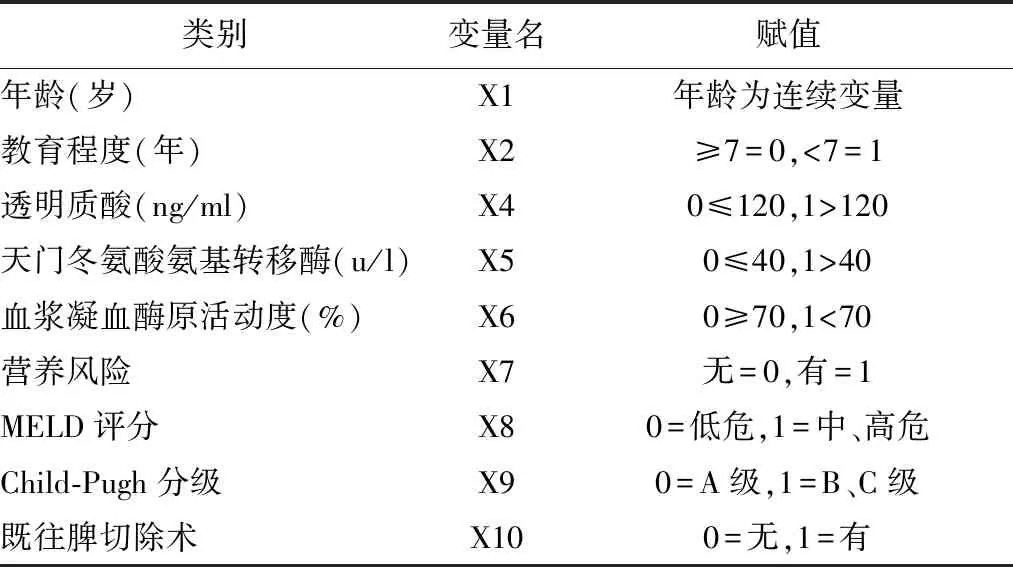
表2 MHE可能危险因素与赋值说明
(2)二分类多因素logistic回归分析 结果显示,年龄、透明质酸、Child-Pugh B、C级、受教育年限小于7年是肝硬化患者合并MHE的独立危险因素。Child-Pugh B、C级肝硬化患者合并MHE的风险是Child-Pugh A级的2.177倍,95%CI为(1.263,3.753);透明质酸结果异常的肝硬化患者合并MHE的风险是结果正常患者的2.615倍,95%CI为(1.226,5.577);年龄每增长1岁,肝硬化患者发生轻微型肝性脑病的风险增加5.8%,95%CI为(1.026,1.091);受教育程度7年以下的肝硬化患者合并MHE的风险是7年及7年以上的的2.532倍,95%CI(1.493,4.292),见图1。
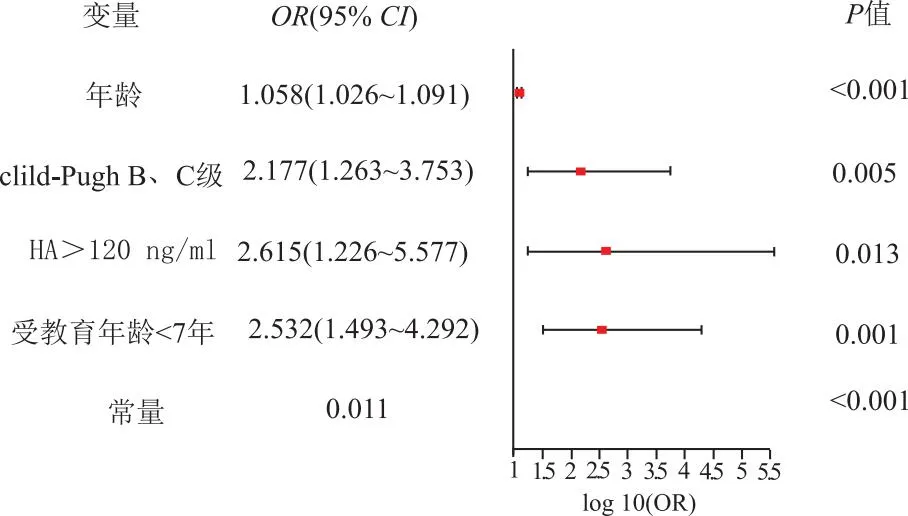
图1 肝硬化合并MHE的危险因素森林图
2.2 绘制肝硬化患者合并MHE的各独立危险因素ROC曲线绘制年龄、Child-Pugh分级、HA>120 ng/ml、受教育年限<7年的ROC曲线,各因素曲线下面积分别为0.636、0.597、0.581、0.603,见图2。
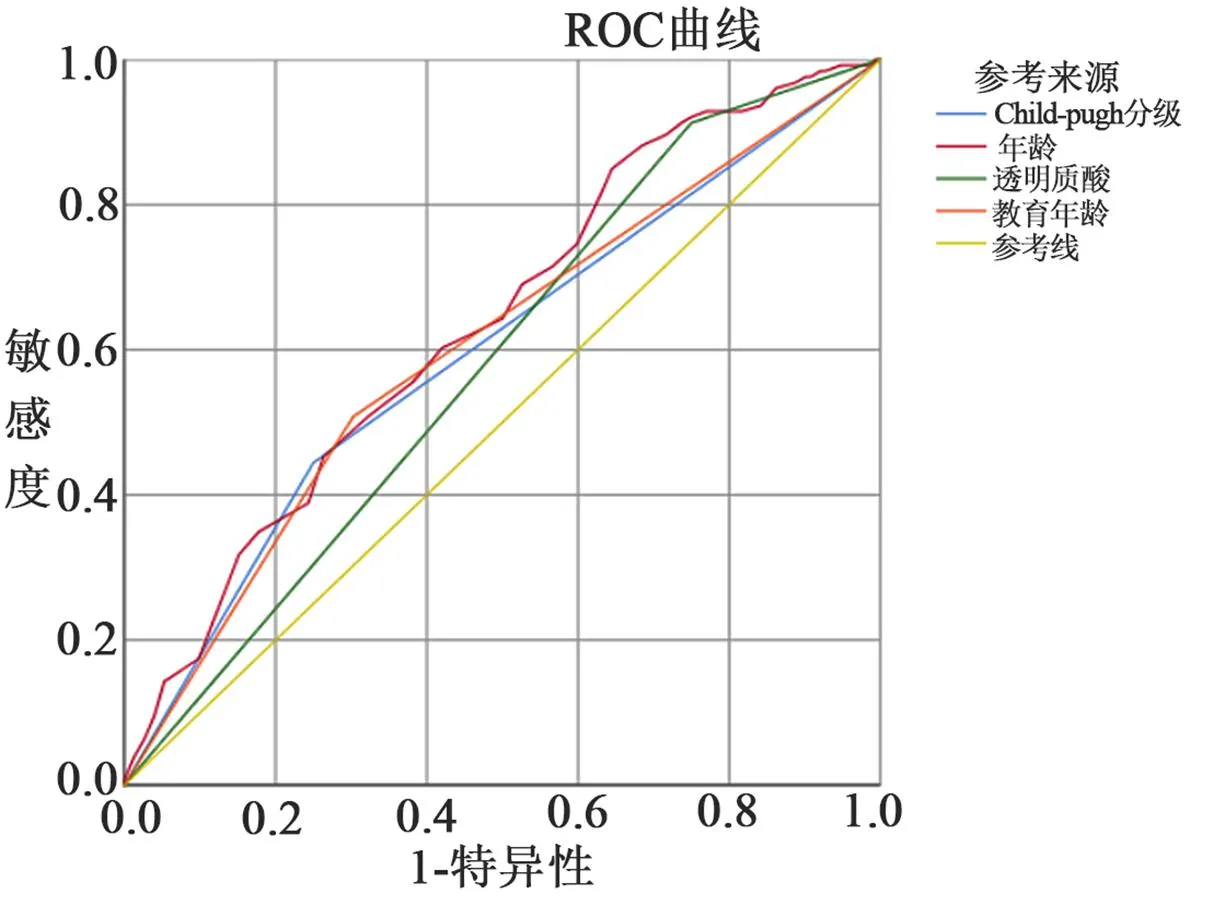
图2 各独立危险因素的受试者工作特征曲线
2.3 构建肝硬化患者合并MHE的列线图预测模型
2.3.1 预测肝硬化患者合并MHE风险的列线图模型 基于肝硬化患者合并MHE的独立危险因素年龄、Child-Pugh分级、透明质酸>120 ng/ml、受教育年限<7年构建列线图预测模型,见图3。各因素对肝硬化发生MHE的影响以分值形式呈现,各因素端点做垂线与分数轴交点处即为该指标对应的分值,各因素的分值总和为该列线图预测模型的总分,总分对应的预测概率及为该模型预测肝硬化患者发生MHE的概率。举例:一个肝硬化患者年龄60岁,Child-Pugh分级为B级,受教育年限为6年,透明质酸为200 ng/ml,则其年龄得分为83分,Child-Pugh分级得分为23分,受教育年限得分为27分,透明质酸得分为28分,则该患者总分为161分,该患者合并MHE的预测概率>80%。
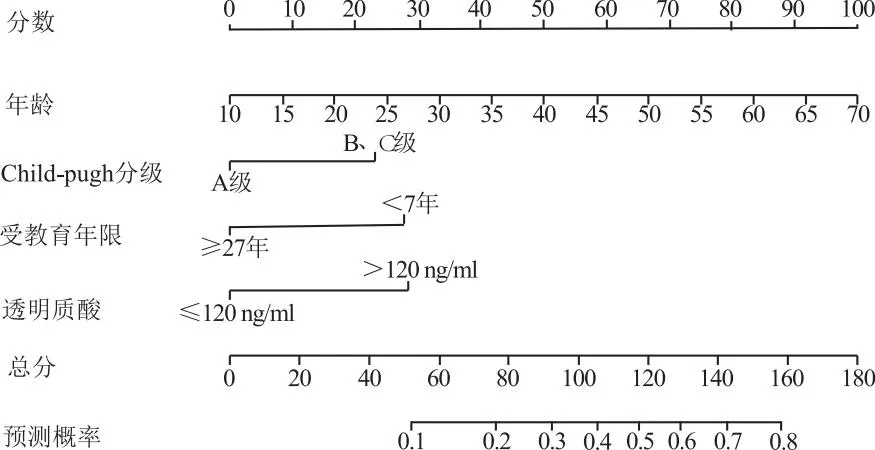
图3 肝硬化患者发生MHE的列线图预测模型
2.3.2 预测肝硬化患者合并MHE的列线图模型验证 Bootstrap对肝硬化患者合并MHE的列线图模型进行内部验证结果显示预测校准曲线大致位于标准曲线和可接受线之间,见图4,Hosmer-Lemeshow拟合优度检验,χ2=1.557,P=0.460;ROC曲线下面积为0.738,95%CI(0.664,0.762),见图5。结果提示本列线图模型对肝硬化患者合并MHE的预测具有较好的校准度与区分度。
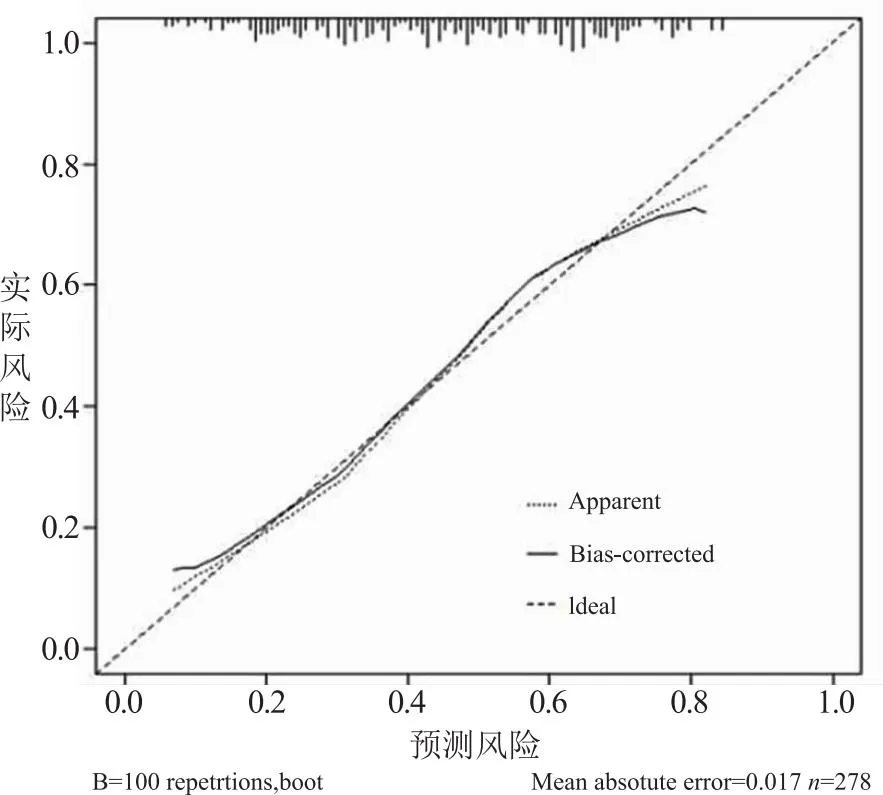
图4 预测肝硬化合并MHE的校准曲线
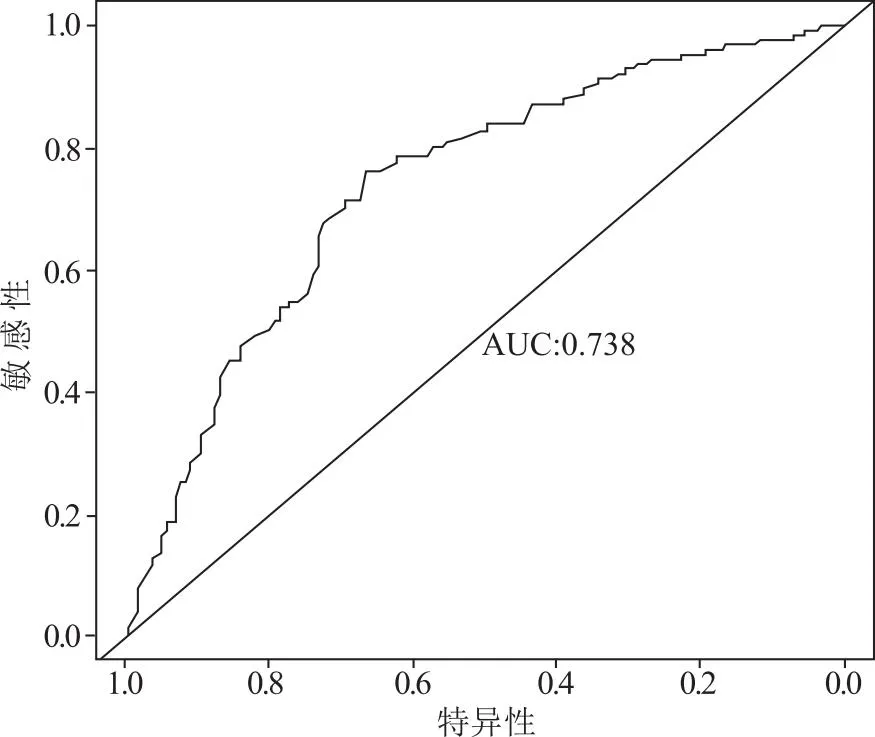
图5 肝硬化并发MHE的ROC曲线
3 讨论
本研究肝硬化患者中MHE的检出率为45.32%,与国内报道关于MHE的发病率报道基本一致。发现年龄是肝硬化合并轻微型肝性脑病的独立危险因素,年龄每增长1岁,肝硬化患者合并MHE的风险会增加5.6%。这与国内学者石绣江[13]、李素文[14]、刘子声[3]等研究结果一致,年龄增长是肝硬化患者合并MHE的危险因素,年龄越大者,肝硬化并发MHE越常见。MHE组中受教育程度为小学及小学以上患病人数相当,受教育程度是MHE发生的危险因素,受教育年限7年以下是MHE独立危险因素,受教育程度7年以下是7年及7年以上的的2.532倍,这与王砚砚等[15]研究结论一致。然而,杨亚琦等[16]以NCT-A、DST为方法诊断MHE,发现受教育程度等无相关性,石绣江等[13]采用进行PHES和临界闪烁频率(CFF)诊断MHE,发现受教育程度对肝硬化发生MHE差异无统计学意义。本研究对NCT-A、NCT-BC、S-ANT1均采用年龄和受教育程度矫正,这两项研究神经心理学测试未采用年龄和受教育程度进行矫正,可能是研究结果存在偏差的原因。
本研究纳入是否合并感染、门脉高压、血清电解质、是否合并营养风险、食管胃底静脉曲张、合并腹水、上消化道出血病史、OHE病史等临床指标。研究结果显示失代偿期患者相较于代偿期的肝硬化患者更容易合并MHE,这与姜婷婷等[17]研究结果一致。本研究结果显示合并腹水的肝硬化患者合并MHE的风险更大,刘思琴等[18]研究结果显示肝硬化病程、合并腹水是隐匿性肝性脑病发病的危险因素。合并门静脉血栓、脾大、食管胃底静脉曲张、门脉高压MHE组与无MHE组差异无统计学意义,目前国内外对这些因素的研究较少,其有待进一步验证。既往有OHE病史、上消化出血病史的患者、有TIPS手术史病史两组差异无统计学意义,但有研究显示,既往OHE病史、有TIPS手术史与OHE发生相关[19],刘思琴等[18]发现HE病史、TIPS术、Child-Pugh分级、MELD评分为隐匿性肝性脑病的独立预测因子。本研究发现有脾切术史的肝硬化患者更容易发生肝性脑病,但目前该项因素报道较少,结果有待进一步验证。有学者发现电解质紊乱与显性肝性脑病的发生有关,Bossen等[20]发现血清钠每降低1 mmol/L,发生HE的危险性增加8%。有学者还发现机体锌缺乏可能是OHE发生和预后不良的预测因子[21]。有学者发现镁缺乏与肝硬化患者认知功能受损之间存在关联,提示镁可能参与了MHE的发病过程[22],但这些指标在本项研究中未发现差异具有统计学意义。
本研究发现是否合并营养风险MHE组与无MHE组比较差异具有统计学意义,但多因素结果显示其不是肝硬化合并MHE的独立危险因素。这与国内学者钱珠萍等[23]研究结果相近,但刘子声等[3]研究认为营养风险是肝硬化合并MHE的危险因素。骨骼肌质量、握力(HGS)被用于评估各种疾病的营养状况。研究发现,HGS降低的患者比HGS正常的患者有更高的隐匿性肝性脑病患病率和更容易进展为OHE[24]。一项前瞻性队列研究显示[25],伴有肌肉消耗的肝硬化患者发生MHE和OHE风险更高。肌少症和血清支链氨基酸水平是MHE的预测因子,肝硬化患者肌肉减少和或氨基酸失衡的改善可能会改善患者MHE[26]。而另一项病例对照研究显示尽管肌少症与MHE发病无关,但肌肉质量损失可能有助于预测MHE[27]。其研究结果的差异可能与营养不良评价工具存在差异有关,但这些研究结果我们可以发现,指导肝硬化患者应加强营养,合理饮食有助于降低发生MHE的风险。
感染被认为是肝性脑病的常见诱发因素。有研究显示多重细菌感染会增加肝硬化患者发生MHE的风险[28],本研究结果显示两组在感染风险上差异无统计学意义,可能是评价指标选择及标准致结果存在差异。由于肝性脑病发病考虑全身炎症反应学说参与其中,一些炎症介质与MHE的关系也展开了相关研究。Montoliu等[29]发现IL-6、IL-18可能参与了MHE的发生,同时IL-6和IL-18可作为鉴别肝硬化是否合并MHE的有价值的指标。Li等[30]发现IL-6、IFNc、IL-17a与乙型肝炎肝硬化发生MHE呈正相关,IL-6、IL-17a是MHE的两个独立危险因素。Wu等[31]发现IL-1蛋白的表达、IL-6 、IFNγ、IFNλ3、 IL-17a,IL-6和IFNγmRNA的水平与肝癌患者发生MHE相关,同时IL-6、IL-17a和 IFNλ3是肝癌患者发生MHE的独立危险因素。
肝功能分级往往可以反映肝硬化患者疾病严重程度,Child-Pugh分级、MELD评分是目前较常用的评估指标。有研究表明MHE与肝硬化患者疾病的严重程度有关,肝功能越差,越容易并发MHE[14]。本研究发现Child-Pugh B/C级是MHE发病的独立危险因素,Child-Pugh B/C级肝硬化患者合并MHE的风险是Child-Pugh A级的2.084倍,而MELD评分不是MHE发病的独立危险因素。王砚砚等[32]研究也得出同样的结论,研究发现Child-Pugh分级是MHE重要的危险因素。有研究发现,Child-Pugh分级可以独立预测MHE,同时Child-Pugh B级和C级患者合并MHE的风险高于Child-Pugh A级患者,Child-Pugh分级评分越高,MHE越容易发现,而MELD评分无法预测[33]。而另一项研究则说明MELD评分>15分是唯一的独立危险因素[34]。刘子声等[3]研究发现Child-Pugh C级是肝硬化合并MHE的危险因素。这说明Child-Pugh 分级及MELD两者预测MHE的能力不同,Child-Pugh分级预测效果可能有一定的价值,但MELD评分预测价值却存在一定的争议。
本研究纳入实验室指标结果显示总蛋白、白蛋白、天门冬氨酸氨基转移酶、谷草/谷丙、凝血酶原时间、血浆凝血酶原活动度、透明质酸是肝硬化患者合并MHE的影响因素,其余各项指标差异无统计学意义。姜婷婷等[17]发现血浆凝血酶原活动度和血小板是MHE发生的危险因素。钱珠萍等[35]研究发现血红蛋白、总胆红素、血清白蛋白、国际化标准化比值、血氨浓度与MHE的发生有关,国际标准化比值和血氨浓度是MHE发生的独立危险因素,刘子声等[3]也研究发现国际标准化比值是肝硬化合并MHE的独立危险因素。刘思琴等[18]发现凝血酶原时间、总胆红素、肌酐、血小板、凝血酶原活动度、白蛋白是隐匿性肝性脑病的影响因素,但均不是独立危险因素。由于总蛋白、白蛋白、凝血酶原时间与Child-Pugh分级之间存在相互影响,所以本研究最终未纳入多因素分析中。目前研究报道中,血氨与MHE的关系一直存在争议,Kimer等[36]与石绣江等[13]发现MHE患者与肝硬化患者血氨浓度无关,而刘子声等[3]研究结果提示血氨浓度是肝硬化合并MHE的危险因素。本研究因血氨指标有部分缺失,最终未纳入研究中。此外,本研究发现透明质酸是肝硬化并发MHE的危险因素[37]。透明质酸升高程度与肝硬化严重程度密切相关。目前关于透明质酸与MHE的相关研究较少,本研究是单中心研究,透明质酸与肝硬化患者合并MHE的关系,可进一步待进一步探讨。
本研究纳入的瞬时肝脏弹性数值、肝脂肪变定量、门静脉主干前后径、脾静脉内径结果显示,MHE组与无MHE组差异均无统计学意义。目前该指标研究较少可能由于检查人员的技术存在一定的误差,可进一步验证与肝硬化发生MHE的风险。阅读文献发现,患有认知障碍的肝硬化患者和不患有认知障碍的肝硬化患者的肠道-肝脏-脑轴存在显著差异[38]。结肠中,微生物菌群多样性、类杆菌属减少是肝硬化患者合并MHE的危险因素[39]。因研究条件有限,未纳入肠道菌群指标进行分析。
为进一步探讨预测效果更佳的预测模型,基于年龄、透明质酸>120 ng/ml、Child-Pugh B/C级、受教育年限小于7年4项独立危险因素运用R软件构建肝硬化合并MHE的列线图预测模型,Bootstrap法对肝硬化合并MHE的列线图模型内部验证结果显示预测校准曲线大致位于标准曲线和可接受线之间,Hosmer-Lemeshow拟合优度检验结果P>0.05,提示线图预测能力较好,绘制模型ROC曲线显示,AUC为0.738,95%CI(0.664,0.762),提示列线图模型预测效果优于各独立危险因素,显示该肝硬化合并MHE的列线图预测模型具有较好的校准度与区分度,鉴别肝硬化患者中易合并MHE的高危患者具有重要的临床指导意义。
本研究不足之处主要有以下方面:①本研究为单中心回顾性研究探究肝硬化患者发生MHE的危险因素,存在一定的选择偏倚,有关结论仍需进一步验证;②本研究立足肝硬合并MHE患者的危险因分析,未对患者进行长期随访;③限于研究时间与资料收集,本研究未对列线图模型进行外部验证,因此有关肝硬化合并MHE的列线图预测模型还需要进一步完成外部验证。
