PD-1/PD-L1 参与骨髓间充质干细胞归巢修复慢阻肺大鼠的肺损伤
2024-01-28林志凤王志红陈燕辉施佳恒王宇潇徐忠敏石永斌林丹婕
林志凤,王志红*,陈燕辉,施佳恒,王宇潇,徐忠敏,石永斌,林丹婕
(1 福建中医药大学中西医结合学院,福州 350122;2 福建医科大学省立临床医学院 福建省立医院血液科,福州 350001;3 福建医科大学临床医学部,福州 350000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)作为一型常见的慢性肺部疾患,以进行性不完全可逆的气流受限为主要特征,现有的临床治疗方案无法改善患者肺功能的长期下降和死亡率[1]。间充质干细胞(mesenchymal stem cells,MSCs)能分化成多种细胞类型,并用于再生肺实质和气道结构,干细胞治疗是一种有潜力恢复COPD患者肺功能和提高生活质量的治疗策略[2]。然而,良好的归巢能力是干细胞发挥治疗作用的前提,归巢效率的提高对于优化治疗效果至关重要[3]。
程序性死亡蛋白配体 1(programmed death ligand-1, PD-L1)及其受体程序性死亡蛋白1 (programmed death-1, PD-1) 是免疫调节和免疫治疗的关键分子,除了参与免疫应答外,表达于MSCs 上的PD-L1 参与MSCs 的迁移过程[4],沉默胆囊癌细胞内 PD-1 基因能抑制细胞的侵袭转移能力[5],PD-1 与PD-L1 均被证明在细胞迁移过程中发挥重要作用。结合既往研究损伤肺组织中PD-1 表达增高[6,7],MSCs 表达PD-L1[8],本研究通过建立COPD 肺损伤大鼠模型,探讨PD-1/PD-L1 在细胞迁移过程中的作用及对骨髓来源MSCs 归巢作用的影响,以期为MSCs 的临床治疗提供一定的思路。
材料与方法
1 实验动物
实验用6~8 周龄SPF 级SD 大鼠,雌雄各半,体重120~150 g,用于造模及分离骨髓间充质干细胞,实验动物购自福建医科大学动物实验中心(动物编号:SYXK 闽2012-001)。实验前适应性饲养1 周,常规饲喂,自由进食、饮水,饲养环境温度、湿度适宜,通风良好,所有实验动物相关处置均按照动物实验伦理要求进行。
2 主要试剂和仪器
DMEM 培养基、胰蛋白酶、胎牛血清(Gibco 公司);荧光标记的单克隆抗体(eBioscience 公司):CD34-PE、CD44-PE、CD29-FITC、CD45-FITC;绿色荧光蛋白(GFP)腺病毒载体(上海吉凯基因化学技术有限公司);大鼠 PD-1 蛋白(Sino Biological);抗PD-L1 抗体(BioXcell 公司);丙二醛(MDA)试剂盒(南京建成);SOD 试剂盒(南京建成);流式细胞仪(Bection Dickinson 公司);倒置荧光显微镜(Olympus 公司);酶标仪(Bio-Tek 公司)。
3 MSCs 的制备与鉴定
取SD 大鼠双侧股骨,充分暴露骨髓腔,取DMEM 培养基反复冲洗骨髓腔,收集冲洗液,离心后弃上清;加入含 10% 胎牛血清的 DMEM 培养基重悬细胞,以2×106个细胞接种于培养瓶,置于 37 ℃、5% CO2培养箱培养。原代细胞贴壁生长达80%左右时进行传代,原代细胞记作P0,传第一代记作P1,依次类推。取P3 代细胞,经胰酶消化后,制备成细胞悬液,分别加入CD34-PE、CD44-PE、CD29-FITC、CD45-FITC 的荧光标记抗体,并设置同型抗体对照,室温下避光孵育30 min,应用流式细胞仪检测MSCs 表面标志。向生长到融合度80%的P3 代细胞,分别加入成脂、成骨诱导培养基,21 d 后,油红O 染色进行成脂鉴定,碱性磷酸酶染色进行成骨鉴定。
4 动物模型创建与评价
大鼠适应性喂养1 周后,采用烟气暴露法,在染毒箱中全烟气暴露2 h/d,10 支烟1 次,每支烟燃吸12 min,吸烟机抽吸频率1 次/min,每周6 次,连续暴露4 个月,以制作大鼠COPD 模型,模型的制备由实验室协助完成。观察大鼠毛发、饮食、行动等结合丙二醛(MDA)和超氧化物歧化酶(SOD)可用作COPD 模型评价指标[9],根据相应试剂盒说明检测正常及COPD 大鼠血清MDA 及SOD 含量。
5 MSCs 治疗与疗效评价
5.1 GFP 标记MSCs
取P3 代细胞行绿色荧光蛋白(GFP)标记,培养体系加入病毒液(Ad-GFP滴度为3.0×1010PFU/mL),以110 PFU/cell的剂量加入培养瓶中。每隔30 min振荡1 次,共3 次。在荧光显微镜下观察标记情况。GFP 转染MSCs 后,以未标记的 MSCs 做对照,用流式细胞仪进行荧光标记率检测。
5.2 GFP 标记MSCs 的归巢
实验分为正常和CODP 模型组,每组10 只,收集GFP 标记的MSCs,胰酶消化后计数,制成3×106的细胞悬液,经尾静脉分别注射入正常和CODP 模型大鼠体内。于MSCs 注射后第7 d,戊巴比妥钠麻醉处死大鼠,取出肺组织制作冰冻切片,荧光显微镜下观察GFP 阳性细胞的分布并拍照。按照每个部位 5 个视野,每只鼠共计数 5 个部位,计算每只鼠肺内绿色荧光信号数量,以x±s表示。
5.3 HE 染色观察各组肺组织病理变化
实验总共为3 组:①正常对照组,正常SD 大鼠通过尾静脉给予生理盐水,注射2 周;②COPD 模型组,通过尾静脉给COPD 模型大鼠注射生理盐水,注射2 周;③MSCs 治疗组:通过尾静脉给COPD模型大鼠注射MSCs 细胞,每周1 次,每次3×106个细胞,注射2 周。上述干预措施完成后,取大鼠肺脏一部分用作PCR 检测各组肺组织中PD-1 mRNA的表达,另一部分制作石蜡切片,再行HE 染色,观察各组病理变化。每张病理切片随机选取5 个视野用数码相机进行采像,并用Metamorph 图像分析软件(美国 Universal Imaging Corporation)分析肺组织结构的形态学变化,测量平均肺泡面积及肺泡吸光度(OD)值,并进行统计学分析。
6 PD-1 mRNA 在各组大鼠肺组织中表达的qRTPCR 检测
实验动物分为对照组、COPD 模型组和MSCs 治疗组,取每组大鼠的一部分肺脏组织,将组织匀浆后采用Trizol 一步法提取组织总RNA,按照反转录试剂盒说明合成cDNA。以cDNA 为模板,进行PCR 扩增。2-△△Ct法计算目标引物 mRNA 的相对表达量。依据NCBI 数据库中大鼠PD-1以及内参β-actin 基因序列,引物设计合成采用Primer5.0 引物设计软件(表1)。

表1 RT-PCR 引物序列Tab.1 Sequences of primers for RT-PCR
7 MSCs 上PD-L1 mRNA 表达的RT-qPCR 检测
取P3 代MSCs 和P3 代MSCs 培养上清液,用Trizol 一步法提取总RNA。按照反转录试剂盒说明合成cDNA,以cDNA 为模板,进行PCR 扩增 。2-△△Ct法计算目标引物 mRNA 的相对表达量。依据NCBI 数据库中大鼠PD-L1 以及内参β-actin 基因序列,应用Primer5.0 引物设计软件进行引物设计合成(表1)。
8 PD-1 和PD-L1 在MSCs 向肺迁移中作用的Transwell 分析
取P3 代的MSCs,经胰蛋白酶消化后,用无血清的DMEM/F12 培养基重悬,制备成2×106个/mL的细胞悬液,取200 μL 添加到上室。根据下室成分不同分为3 组:空白对照组,下室加入600 μL 完全培养基 ( 含10% 胎牛血清和 1%双抗的 DMEM/F12培养基 );PD-1 组:下室加完全培养基及PD-1 蛋白(2 ng/μL);PD-L1 抗体组:下室加完全培养基及PD-1 蛋白(2 ng/μL),同时上室加PD-L1 抗体(2 ng/μL)。培养36 h 后,取出小室,弃掉培养液,用4%多聚甲醛固定15 min,PBS 清洗,用0.1%结晶紫染色3 ~4 h,PBS 清洗,用棉棒轻轻擦去小室内未穿过小室膜的细胞,晾干后于倒置显微镜观察小室膜外层细胞,随机选取5 个视野进行细胞计数并拍照,分析MSCs 的相对迁移数量。
9 统计学分析方法
软件用SPSS 25.0,计量资料以x±s表示,两组均数比较用两独立样本t检验;多组间均数比较用单因素方差分析 (One-way ANOVA),组间两两比较采用LSD-t检验,以P< 0.05 为差异有统计学意义。
结 果
1 MSCs 形态学观察及鉴定
采用贴壁法培养的骨髓来源的MSCs,24 h 后部分细胞可见贴壁;3 ~4 d 后即可观察到一些小的集落形成。原代细胞贴壁生长,呈长梭形,以多个克隆集落方式增长繁殖,7~14 d 即可观察到克隆集落部分融合成片(图1A)。传代后的MSCs,细胞贴壁较P0 代培养的细胞快,24 h 即可观察到细胞完全贴壁,形态与P0 代细胞相似,传代后MSCs 均匀分布,形态呈单一的梭形。流式细胞仪检测结果表明MSCs 上CD29、CD44 表达率较高(图1D、E),CD34、CD45 表达率较低(图1F、G)。加入成脂诱导培养基后21 d,油红O 染色可见呈深橙红色的脂滴(图1B);成骨诱导分化21 d 后,经碱性磷酸酶染色可见典型的成骨表现(图1C)
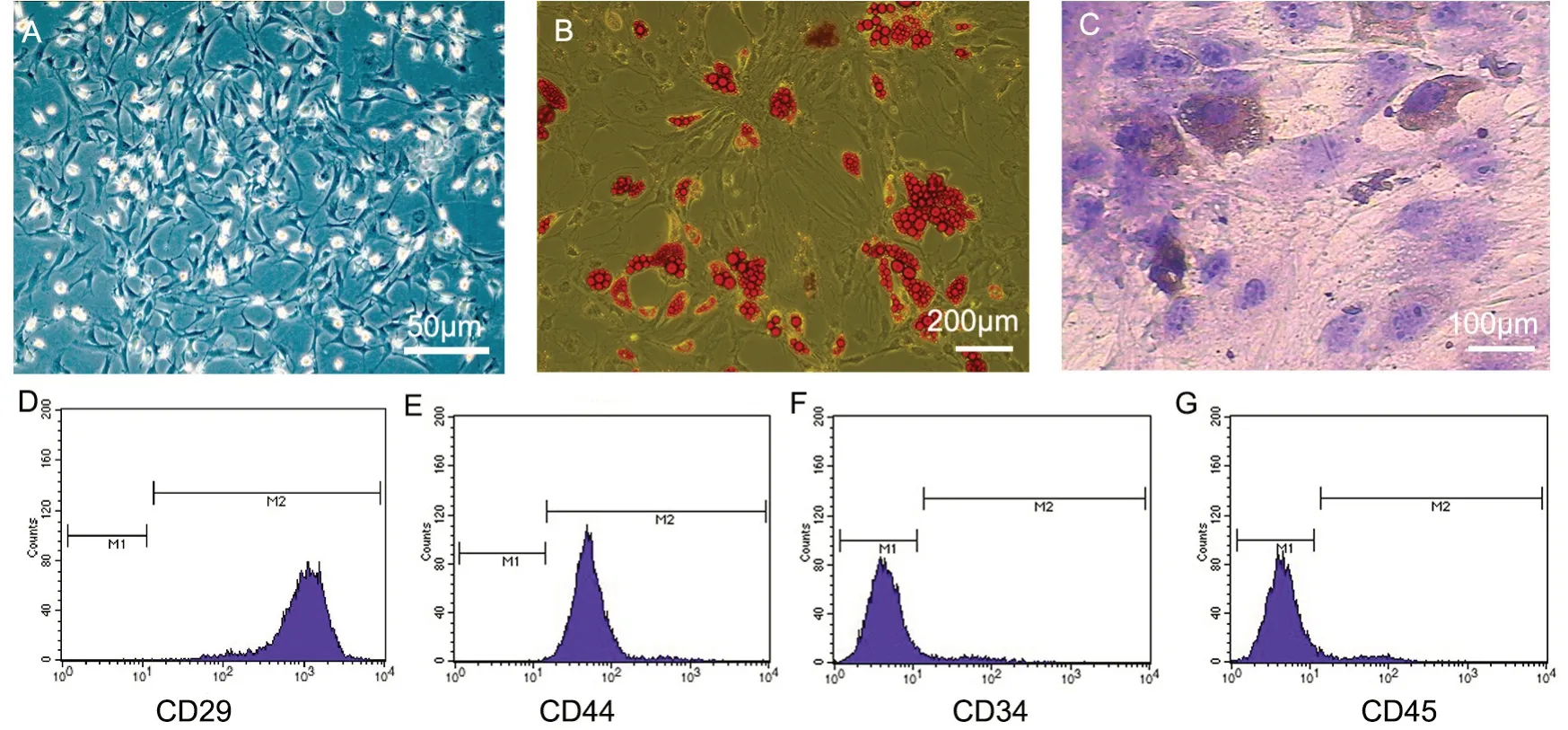
图1 MSCs 的培养及鉴定。A,MSCs 原代细胞成纤维样集落方式增殖;B,MSCs 成脂诱导后油红O 染色;C,MSCs 成骨诱导后碱性磷酸酶染色;D-G,MSCs 表面CD29(D)、CD44(E)、CD34(F)和CD45(G)表达的代表性流式细胞术检测Fig. 1 Culture and identification of MSCs. A, fibroblast-like colony proliferation of MSCs primary cells; B, Oil Red O staining of MSCs after lipogenic induction; C, alkaline phosphatase staining of MSCs after osteogenesis induction; D to G, representative assay by flow cytometry of the expressions of CD29 (D), CD44 (E), CD34 (F) and CD45 (G) on the surface of MSCs
2 慢性阻塞性肺疾病模型鉴定
造模结束后,正常对照组大鼠精神状态较好,毛发有光泽,呼吸平稳,无气促,饮食及睡眠正常。COPD 模型组大鼠则出现精神萎靡,毛发干枯发黄,呼吸急促,咳嗽等症状,而且进食饮水量减少,睡眠质量较正常组欠佳。相对于正常组,COPD 模型组血清SOD 水平低于对照组,MDA 含量高于对照组(表2)。

表2 大鼠肺中超氧化物歧化酶活性和丙二醛水平的变化(n=8)Tab. 2 Changes of SOD and MDA levels in lungs of rats (n=8)
3 MSCs 在肺组织的示踪及MSCs 输注后病变肺组织的损伤修复
向MSCs 中加入携带GFP 的腺病毒, 3 h 后在荧光显微镜下开始出现稀少的微弱绿色荧光;24 h后大部分细胞被转染,呈较强的绿色荧光。48 ~72 h 阳性细胞逐渐增多,MSCs 细胞几乎全部转染,并且强度增强,多为明亮的绿色荧光(图2A),转染效率约 80%左右,空白对照组未见荧光表达。GFP标记的MSCs 输注至正常及COPD 模型大鼠后7 d,COPD 大鼠肺组织中绿色荧光蛋白标记的MSCs 明显多于正常大鼠(图2B、C,表3)。

图2 GFP 标记MSCs 归巢。A,转染GFP 腺病毒 3 d 后的MSCs;B,正常大鼠肺内GFP 标记的MSCs;C, COPD 大鼠肺内GFP 标记的MSCsFig. 2 Homing of MSCs labeled with GFP. A, MSCs transfected with GFP adenovirus for 3 days; B, GFP-labeled MSCs in the lungs of normal rats; C,GFP-labeled MSCs in the lungs of COPD rats
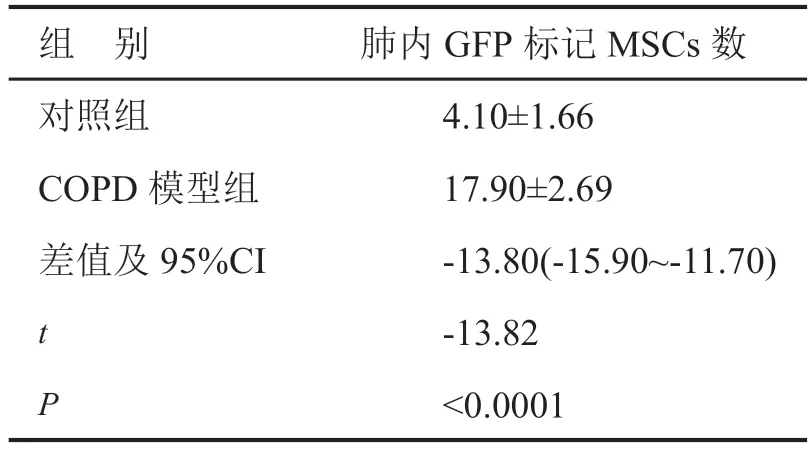
表3 大鼠肺内MSCs 归巢的定量分析(n=10)Tab. 3 Quantitative analysis of MSCs homing in the rat lungs (n=10)
对大鼠肺组织HE 染色显示:正常对照组中肺泡大小均匀,肺泡壁无明显增厚,肺泡腔干净、匀称,边缘无大量炎细胞浸润及部分肺间隔断裂(图3A);在COPD 模型组中,镜下见病变支气管壁明显增厚,增生的粘膜突向管腔,间质内可见大量淋巴细胞和浆细胞浸润,同时管壁内有平滑肌束增生、肥大。观察结果提示COPD 模型制备良好(图3B)。MSCs 治疗组中,与COPD 模型组比较,支气管壁较之变薄,间质中淋巴细胞、浆细胞等慢性炎症细胞减少,细支气管和肺泡结构正常化,新肺泡结构形成。COPD 模型肺组织平均肺泡面积较正常对照组明显增大,OD 值明显减少;MSCs 治疗组平均肺泡面积较COPD 模型组明显减小,OD 值明显增大(表4)。结果提示,MSCs 治疗后COPD 肺损伤有所改善(图3C)。

图3 大鼠肺组织病理变化HE 染色检测。A,对照组;B,COPD 模型组;C,MSCs 治疗组;比例尺,100 μmFig. 3 Examination by HE staining of lung tissue pathological change of the rats. A, Control Group; B, COPD Model Group; C, MSCs treatment Group;scale, 100 μm
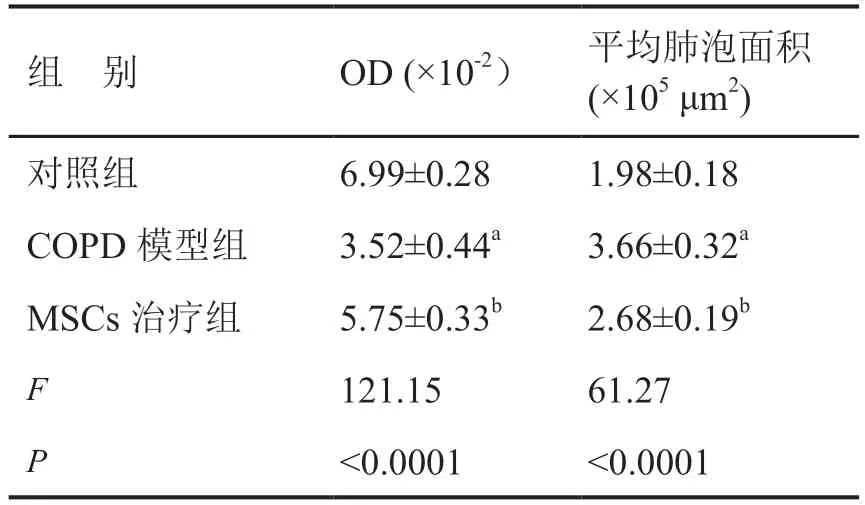
表4 肺组织平均肺泡面积与OD 值定量分析(n=5)Tab. 4 Quantitative analysis of the average alveolar area and OD value of the rat lung tissues (n=5)
4 MSCs 治疗减少COPD 模型大鼠肺组织中PD-1 mRNA 表达的上调
qRT-PCR 检测显示:COPD 模型组的肺脏组织PD-1 mRNA 表达水平较对照组明显升高,MSCs 治疗组大鼠肺组织中PD-1 mRNA 表达水平明显低于COPD 模型组,与对照组相近(图4)。
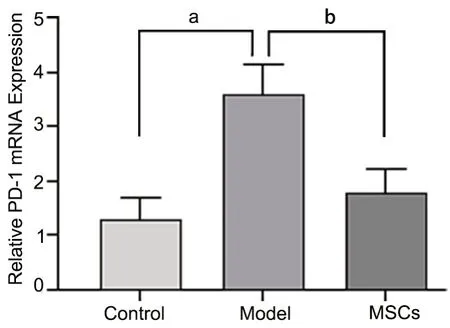
图4 大鼠肺脏组织中PD-1 mRNA 表达水平的RT-qPCR 检测。aP<0.0001;bP<0.0001;n=6Fig. 4 qRT-PCR detection of expression levels of PD-1 mRNA in the lung tissue of the rats. aP<0.0001; aP<0.0001; n=6
5 PD-L1 mRNA 在MSCs 的表达
qRT-PCR 结果显示, MSCs 组的PD-L1 mRNA表达明显高于MSCs 上清液组(P< 0.0001)(图5)。

图5 MSCs 上清液与MSCs PD-L1 mRNA 水平比较。Sup,MSCs 培养上清组;MSCs,MSCs 组;aP<0.0001;n=8Fig. 5 Comparison of levels of PD-L1 mRNA in MSCs supernatant and MSCs. Sup, supernatant group; MSCs, MSCs group; aP<0.0001; n=8
6 PD-1 促进MSCs 定向迁移(归巢)
Transwell 实验显示:与对照组相比,PD-1 蛋白存在时,MSCs 迁移数量明显增多;与PD-1 组相比,在PD-L1 抗体存在时,MSCs 迁移数量明显减低(图6,表5)
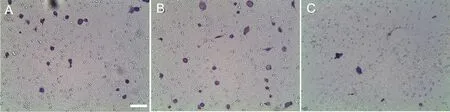
图6 PD-1 及PD-L1 抗体对MSCs 迁移能力影响的结晶紫染色分析。A,对照组;B,PD-1 组;C,PD-L1 抗体组;比例尺,400 μmFig. 6 Crystal violet staining assay for the effect of PD-1 and PD-L1 antibody on the migration ability of MSCs. A, Control Group; B, PD-1 Group; C,PD-L1 antibody Group; scale, 400 μm

表5 PD-1 及PD-L1 抗体对MSCs 迁移能力影响的定量分析Tab. 5 Quantitative analysis of the effects of PD-1 and PD-L1 antibody on the migration ability of MSCs
讨 论
慢性阻塞性肺疾病(COPD)是一种终生疾病,目前主要的治疗手段包括戒烟、定期服药、接受肺部康复训练等,COPD 的症状有时会改善,然而,肺部受损永远无法完全恢复正常[10]。MSCs具有免疫调节、抗炎、修复的功能[11],已被证实在COPD 发生时能够定向迁移到损伤肺部,并在受损的肺部分化为肺上皮细胞和内皮细胞等,发挥组织损伤修复作用,还能在损伤局部反应性分泌一些生长因子和细胞因子,这些因子可能起到治疗甚至是中断COPD进行性发展的作用[12]。本实验结果表明,与COPD模型组相比,注射MSCs 治疗后大鼠肺支气管壁变薄,间质中淋巴细胞、浆细胞等慢性炎症细胞减少,细支气管和肺泡结构正常化,新肺泡结构形成。与过往研究结果一致[13,14],本研究结果证实了MSCs治疗COPD 的可行及有效性。然而,MSCs 归巢到损伤部位的效率,很大程度上影响其治疗作用的发挥。当前用于改善MSCs 归巢的各种策略,包括遗传修饰,细胞表面工程,MSCs 的体外启动,特别是超声技术的应用等[15]。对归巢相关分子机制的了解,能帮助我们改善MSCs 的归巢率。
MSCs 的归巢是指其被“截留”在组织血管中,随后穿越内皮细胞进入靶组织的过程,具体包括MSCs 与内皮细胞的活化-动员、MSCs 在血管内皮上结合-滚动、MSCs 向血管内皮黏附-穿越内皮细胞,最终进入靶组织[16]。MSCs 向损伤肺组织归巢的部分原因是损伤组织释放的一些趋化因子,同时表达特异性的受体或配体,引导MSCs 归巢,此外MSCs 也会表达一些趋化因子受体,释放一些细胞因子,在MSCs 归巢过程中发挥作用。本研究发现,正常大鼠肺组织低表达PD-1,而COPD 肺组织高表达PD-1,同时对正常及COPD 大鼠同时输注GFP 标记的MSCs,发现COPD 组大鼠肺部荧光信号明显强于正常组,表明PD-1 高表达与MSCs 顺利归巢至肺组织存在一定的相关性。
本次实验体外分离纯化的MSCs 上有PD-L1 表达,因此我们提出设想,COPD 损伤肺组织中高表达的PD-1,可能作为一种趋化性刺激,从而促进MSCs的定向迁移过程,这一迁移过程,一定程度上依赖于肺组织中高表达的PD-1 与MSCs 表面的PD-L1 特异性结合而实现的。体外Transwell 迁移实验结果显示,与对照组相比,PD-1 存在时,MSCs 可向其定向迁移,当加入PD-L1 抗体后,由于MSCs 表面的PD-L1 与PD-L1 抗体结合被部分封闭,使与PD-1 结合的MSCs 表面暴露的PD-L1 减少,进而使MSCs迁移数目明显降低。这也证实了PD-1 引起MSCs 定向迁移依赖于MSCs 的PD-L1 表达,这一迁移过程可被PD-L1 抗体特异性阻断。以上均表明PD-1/PDL1 在参与MSCs 归巢过程中发挥了一定的作用。
目前对于MSCs 定向归巢以及PD-1/PD-L1 信号通路促进肿瘤发生免疫逃逸的相关研究较多,但关于PD-1/PD-L1 信号通路参与MSCs 定向归巢的相关报道罕见。MSCs 归巢是个复杂的过程,本次实验证明PD-1/PD-L1 参与了MSCs 定向归巢到COPD 大鼠肺部的过程,但具体是在MSCs 活化-动员,结合-滚动,还是黏附-穿越血管内皮细胞的哪个环节中发挥作用尚待进一步的研究。另外PD-1 在肺组织中高表达,具体是在肺的实质细胞还是肺内的免疫细胞中表达,后续可对COPD 肺组织中的细胞分离后进一步研究。
综上所述,本研究证实体外PD-1 可促进MSCs定向迁移,当加入PD-L1 抗体封闭部分MSCs 上表达的PD-L1 后,MSCs 定向迁移明显减少。相比于正常肺组织,高表达PD-1 的COPD 肺组织伴随MSCs更高的归巢率,本实验提供了一个全新的角度,关于PD-1/PD-L1 在MSCs 归巢过程中的作用。
