miR-31 通过下调FIH 和上调VEGF-A/VEGFR-2促进大鼠主动脉内皮细胞增殖
2024-01-28李咏梅付媛曹利利杜若琛王春芳张轩萍
李咏梅,付媛,曹利利,杜若琛,王春芳*,张轩萍*
(1 山西医科大学生理学系细胞生理学教育部重点实验室,太原 030001;2 山西医科大学基础医学院药理学教研室,晋中 030619;3 山西医科大学实验动物中心,太原 030001)
心血管疾病是全世界最常见的死亡原因之一,近年来,尽管进行了积极的预防工作,但心血管疾病的发病率依旧呈上升趋势[1]。内皮是一个连续的屏障,其表面直接与体内几乎每个系统相互作用[2]。血管内皮细胞位于血浆与血管组织之间,对血管内皮功能及血管稳态直接造成影响,血管内皮功能障碍与广泛心血管疾病直接相关[3,4]。主动脉内皮细胞是探索血管内皮功能特性的重要载体,大量研究采用了大鼠主动脉内皮细胞(rat aortic endothelial cells,RAECs),在体外培养中通过各种刺激模拟不同病理条件时在体内的状态,进而高效、便捷的分析病理机制,为开发防治心血管疾病的策略奠定了重要的基础[5]。在本文中,首先在国内外方法的基础上建立原代RAECs 的分离培养方法。
血管生成是维持正常组织生理的关键过程,通过形成新的血管网络参与组织重塑和再生[6]。微小核糖核酸(microRNAs, miRNA)在不同物种间是保守的,miR-31 是一种亟待进一步研究的短链非编码RNA,是一种关键的基因表达调节因子[7]。缺氧诱导因子抑制因子(hypoxia inducible factor inhibitor, FIH)被证明与血管生成密切相关,且被证明是miR-31 的直接靶标[8,9]。FIH 被证明会调节血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A),表现为FIH 的消耗会诱导VEGF-A 的表达[10]。VEGF-A 诱导血管内皮细胞的增殖,与血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)结合,进而促进血管生成[11]。因此,我们以RAECs 为研究对象,探究miR-31 对其功能的影响及作用机制,对于内皮功能障碍相关的心血管疾病中有重大临床意义。
材料与方法
1 实验动物
12只1月龄SPF 级SD大鼠,体重约为100~120 g,雌雄不限,购自山西医科大学实验动物中心【SCXK(晋)2019-0005】,饲养于山西医科大学实验动物中心屏障环境中【SYXK(晋)2019-0007】。昼夜各半循环照明,湿度恒定,温度控制在 22~25 ℃,洁净通风,自由进食饮水。所有实验操作均符合实验动物伦理学要求(审批号:SYDL2021016)以及中华人民共和国《实验动物管理条例》。
2 主要试剂与仪器
Ⅰ型胶原酶(Macklin,C909787),胰蛋白酶-EDTA 消化液(0.25%,Solarbio,T1300),兔抗CD31抗体、兔抗vWF 抗体、兔抗CD34 抗体(BOSTER,PB9273、PB9273、PB9053),Cy3 标记的miR-31 激动剂/抑制剂(miR-31 agomir/antagomir,广州锐博,R10034.9),转染试剂(INTERFERin®,Polyplus,PT-409-01),miRNA 第一链合成试剂盒(Mir-X miRNA First-Strand Synthesis Kit,Takara,638313),兔抗FIH 抗体、兔抗VEGF-A 抗体、兔抗VEGFR-2 抗体(ABclonal,A5466、A12303、A5609),HRP-标记的山羊抗兔IgG H&L(Abacam,ab6721),Hoechst 33258 染色液(Boster,AR1169)。倒置显微镜和荧光显微镜(OLYMPUS,日本),电泳仪、转膜仪和高灵敏度化学发光成像系统(Bio-Rad,美国)。
3 大鼠主动脉内皮细胞原代培养
腹腔注射戊巴比妥钠(150 mg/kg)以麻醉大鼠,75%乙醇喷洒胸部和腹部消毒。打开大鼠胸腹腔,切开髂总动脉分支处放血,左心室注射预冷磷酸盐缓冲液(PBS)灌注主动脉。沿着脊柱将心脏、主动脉及在外附着的结缔组织和脂肪分离出来,直至髂总动脉分支处,并将其置于含2%青霉素-链霉素的无菌PBS 中,移至超净工作台内,换液2 次,漂洗表面残留血渍,在解剖显微镜下逐步用剪刀、镊子将主动脉剔除干净。将剔除干净的主动脉移入不含双抗的无菌PBS 后纵行剖开,尽量不把主动脉断开,在6 cm 直径单孔培养皿中配制1∶1 的 2 g/L 胶原酶及胰酶的混合消化液,将剖开的主动脉展开放入消化液,培养箱中消化15 min。取出培养皿,加入相同体积含有20% FBS 的培养基终止消化过程,肉眼下用弯镊将血管内膜轻轻刮拭几次,使内皮细胞脱落,力度以不使血管断裂为度。培养基或无菌PBS 冲洗后弃去血管,收集培养皿中液体,离心后弃上清,重悬细胞,吹打分散后用移液器均匀转移至6 孔板的两孔内,于含20% FBS 的DMEM 培养基在培养箱中培养(表1)。培养1 d 后换液,去除未贴壁的细胞;其后每隔2 d 半定量换液1 次,待细胞融合成片,即可传代培养。

表1 大鼠主动脉内皮细胞的原代培养方法Tab.1 Primary culture method of rat aortic endothelial cells
4 目的细胞传代培养
待6 孔板中培养的原代细胞融合度达到90 %以上时,用0.25 %胰蛋白酶-EDTA 消化液消化细胞。重悬后将1 个6 孔板孔内的细胞接种于1 个T25 培养瓶,继续培养。每2~3 d 换液,细胞融合度达85%以上时进行传代或后续实验,定时观察并记录细胞生长状态。
5 CD31、vwF 和CD34 免疫荧光染色
取第2 代近融合的内皮细胞,消化后接种至6孔板,4%多聚甲醛固定、0.5% Triton X-100 室温通透,正常山羊血清封闭后滴加抗体(1∶200)于4 ℃过夜。加入荧光二抗(1∶400)、0.1% Hoechst 避光孵育,封片后荧光显微镜下观察。
6 细胞分组及细胞转染
取第2 代近融合细胞进行实验,将细胞分为3组,对照(Control)组、miR-31 激动剂(miR-31 A)组和miR-31 抑制剂(miR-31 An)。接种细胞后添加含有FBS、无双抗的培养基,当细胞融合度达到30%~50%时,转组染miR-31 agomir 和antagomir(终浓度分别为50 nmol/L 和100 nmol/L)。转染细胞12 h 后,4%多聚甲醛固定、0.1% Hoechst 避光孵育,在荧光显微镜下观察。
7 细胞增殖检测
取第2 代近融合的内皮细胞接种于96 孔板(10000 个细胞/孔),将CCK-8 溶液与培养基1∶9混合,每孔加100 μL 混合液,孵育2 h 后检测在450 nm 处吸光度。转染细胞后连续3 d 测定吸光度。
8 实时荧光定量逆转录PCR(RT-qPCR)
转染细胞后,使用Trizol 法从细胞中提取总RNA,按照说明书将miR-31 反转录成cDNA,以cDNA 为模板进行扩增。在95 ℃预变性1 min;95℃15 s,60 ℃ 1 min 进行40 个循环;95 ℃ 15 s,60 ℃ 1 min, 95 ℃ 15 s 和60 ℃ 15 s 建立熔解曲线。相对miRNA 表达水平以U6 为参考基因,根据公式2-ΔΔCt进行计算。PCR 引物序列见表2。

表2 PCR 引物序列Tab. 2 Primer sequences for PCR
9 蛋白质免疫印迹
提取细胞中的总蛋白并测定蛋白浓度。SDSPAGE 凝胶电泳,转膜、封闭后,与抗FIH(1∶1000)、抗VEGF-A(1∶1000)、抗VEGFR-2(1∶1000)及抗β-actin(1∶2500)一抗,4 ℃过夜。次日,与相应的HRP 标记的二抗(1∶5000)室温下孵育60 min。使用ECL 发光试剂检测条带,使用Image Lab 软件进行分析。
10 统计学方法
实验数据采用IBM SPSS Statistics 26 软件统计分析,采用GraphPad Prism 8.3.0软件作图。数据表示为±s表示,组间比较运用单因素方差分析(oneway ANOVA),以P<0.05 表示两组间差异具有统计学意义。
结 果
1 大鼠主动脉内皮细胞原代与传代培养与鉴定
原代培养1 d 时细胞贴壁,镜下观察到单个散在分布的内皮样细胞,可看到短梭形或多角形细胞形态;培养3~4 d 时细胞变密集,逐渐融合成片,偶见接触抑制现象;培养5 d 时,细胞生长旺盛并连接成片,边缘部分广泛出现接触抑制现象;培养7~8 d 时,细胞融合度达到90%以上,贴壁细胞铺满培养瓶底面,呈典型的单层、三角形、卵型不规则形状,主要见铺路石样单层镶嵌排列(图1)。

图1 原代培养1 d (A)、3 d(B)、5 d(C)和7 d(D)的大鼠主动脉内皮细胞的形态特点。比例尺,100 μmFig. 1 Morphological characteristics of the rat aortic endothelial cells in primary culture for 1 day (A), 3 days (B), 5 days (C) and 7 days (D). Scale bar,100 μm
第2 代细胞接种1 d 时,可见到梭形或多角形的内皮样细胞均匀散在分布;3~4 d 时,细胞可铺满培养瓶底面,呈典型的单层、铺路石样镶嵌式排列(图2)。培养至第5 代时仍能看到典型的内皮细胞形态。

图2 传代培养1 天(A 和B)和3 天(C 和D)的大鼠主动脉内皮细胞的形态特点。比例尺,A、C,100 μm;B、D,50 μmFig. 2 Morphological characteristics of the rat aortic endothelial cells subcultured for 1 day (A and B) and 3 days (C and D) in subculture. Scale bar,100 μm in A and C, 50 μm in B and D
免疫荧光染色显示,传代培养第3代的细胞在细胞膜上和细胞质中均呈CD31、vwF 和CD34 阳性,免疫荧光标记阳性率达98%以上(图3)。
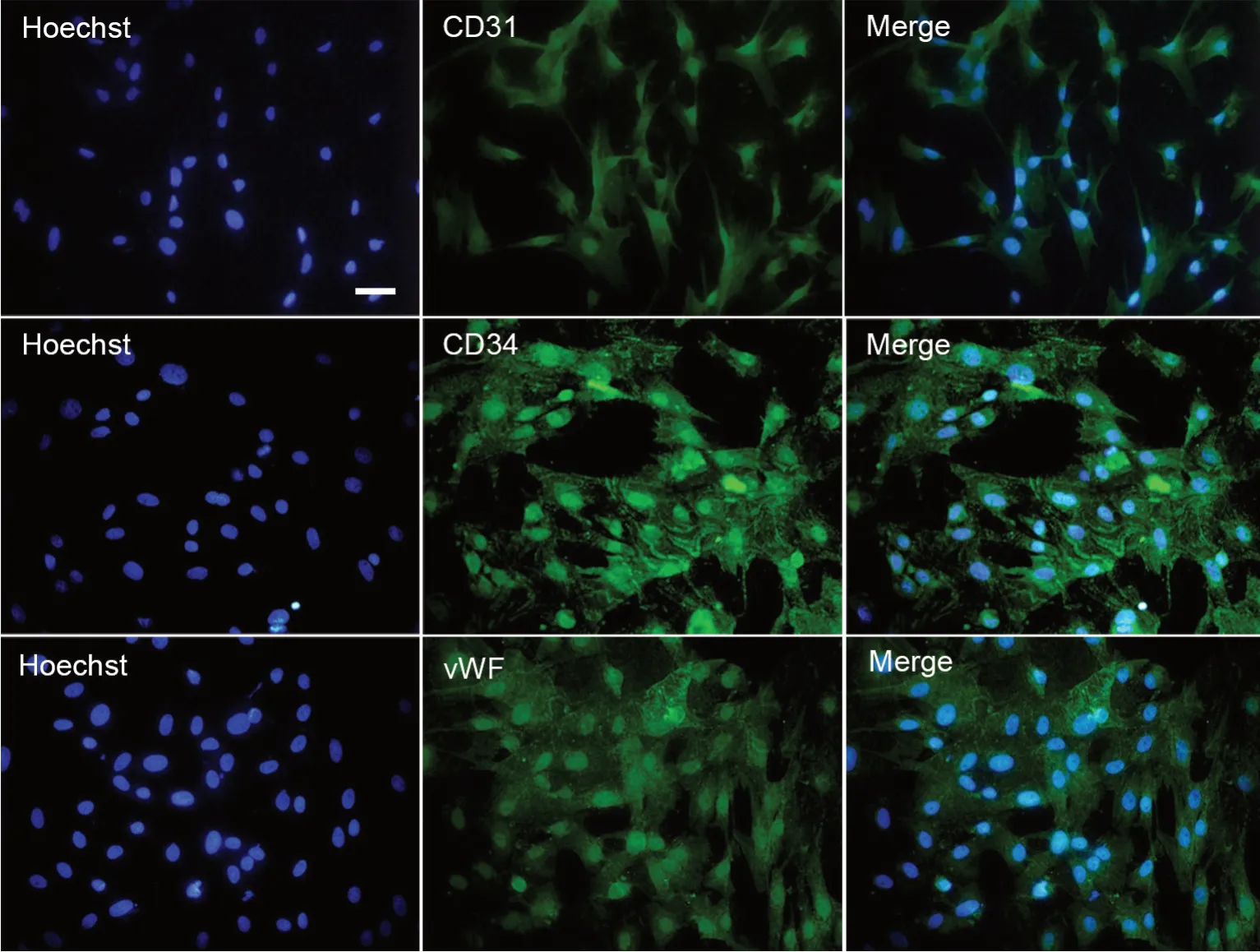
图3 CD31、vwF 和CD34 在传代培养第3 代大鼠主动脉内皮细胞中表达的免疫荧光检测。比例尺,25 μmFig. 3 Immunofluorescent examination of expressions of CD31, vwF and CD34 in subcultured rat aortic endothelial cells at passage 3. Scale bar, 25 μm
2 miR-31 促进主动脉内皮细胞增殖
在传代培养第3 代的主动脉内皮细胞转染miR-31 agomir 或miR-31 antagomir 后,细胞核周围可见红色荧光,表明miR-31 agomir 或miR-31 antagomir 转染成功,阳性率均达97%以上(图4A)。RT-qPCR 检测显示,转染agomir 后 miR-31 含量明显升高,转染antagomir 后miR-31 含量明显下降(图4B),表明miR-31 agomir/miR-31 antagomir 能有效上调/下调miR-31 的表达。

图4 第3 代大鼠主动脉内皮细胞miR-31 agomir/antagomir 转染效率与作用效果分析。A,荧光显微镜观察miR-31 agomir/antagomir 转染效率;比例尺,50 µm。B,RT-qPCR 检测miR-31 agomir (A) / antagomir (An)对miR-31 表达的影响;与Control 组相比,**P < 0.01;n=6Fig. 4 Analysis of transfection efficiency and efficacy of miR-31 agomir/antagomir in subcultured rat aortic endothelial cells at passage 3. A, fluorescence microscopic observation of miR-31 agomir/antagomir transfection efficiency; scale bar, 50 µm. B, RT-qPCR detection of the effect of miR-31 agomir/antagomir on expression of miR-31; **P <0.01, compared with control group; n=6
转染细胞后,定时在显微镜下观察细胞形态。在转染后1 d 时,可观察到miR-31 agomir 和antagomir转染对主动脉内皮细胞有一定的毒性作用,出现细胞漂浮现象。继续培养,对照组细胞生长旺盛,在第2 d 时可见广泛的细胞接触抑制现象;miR-31 agomir组细胞生长较慢,在第3 d 时仍可观察到较多的间隙。CCK-8 分析显示,与Control 组相比, miR-31 agomir 组于转染后1 d 起,细胞增殖速度明显加快;miR-31 antagomir 组在转染后第2、3 d 时,细胞增殖速度明显下降。由此表明miR-31 促进主动脉内皮细胞增殖(图5)。

图5 改变miR-31 表达对大鼠主动脉内皮细胞增殖影响的CCK-8 检测。与对照组比较:*P<0.05,**P <0.01;n=6Fig. 5 CCK-8 assay of the effect of changing miR-31 expression on proliferation of the rat aortic endothelial cells. *P <0.05, **P <0.01,compared with Control; n=6
3 miR-31 下调FIH 且上调VEGF-A 和VEGFR-2
蛋白质免疫印迹分析表明,与对照组主动脉内皮细胞相比,转染miR-31agomir 的主动脉内皮细胞FIH 水平明显下降,VEGF-A 和VEGFR-2 水平明显升高;miR-31 antagomir 的主动脉内皮细胞FIH 水平明显升高,VEGF-A 和VEGFR-2 水平则明显降低(图6),由此表明,在主动脉内皮细胞中,miR-31能下调FIH 水平,上调VEGF-A 和VEGFR-2 水平。

图6 改变miR-31 表达对大鼠主动脉内皮细胞内FIH、VEGF-A 和VEGFR-2 水平影响的免疫印迹分析。A,大鼠主动脉内皮细胞内FIH、VEGF-A 和VEGFR-2 水平的代表性免疫印迹检测。B,大鼠主动脉内皮细胞内FIH、VEGF-A 和VEGFR-2 水平的定量分析;与对照组相比,*P < 0.05,**P < 0.01;n=3Fig. 6 Immunoblotting analysis of the effects of changing miR-31 expression on the levels of FIH, VEGF-A, and VEGFR-2 in the rat aortic endothelial cells. A, representative immunoblotting detection of FIH, VEGF-A, and VEGFR-2 levels in the rat aortic endothelial cells. B, quantitative analysis of FIH, VEGF-A, and VEGFR-2 levels in the rat aortic endothelial cells; *P <0.05, **P <0.01, compared with Control; n=3
讨 论
心血管疾病是一种有严重危害性的疾病,在全球尤其在发展中国家,是人们死亡的主要因素[2]。由于血管内皮细胞直接与循环血液接触,因此很容易受到血液中活性物质的影响[3]。越来越多的证据表明,血管内皮功能障碍是与血管收缩、血栓形成和炎症状态相关的疾病,例如高血压、动脉粥样硬化、心力衰竭、心肌梗死和中风等广泛心血管疾病的标志[4]。
微小RNA(miRNAs)在不同物种之间是保守的[7]。miRNAs 可以在转录后水平上负调节其靶基因,参与调节血管功能等重要的生命过程[8]。研究表明miR-31 可直接靶向FIH,影响细胞增殖、迁移及血管形成过程[9]。高水平的miR-31 会导致体外毛细血管样小管形成增强[12]。此外,研究发现FIH 与VEGF 密切联系,添加VEGF-A 可以减轻由FIH 过度表达引起的血管缺陷[10]。VEGF-A 是维持正常组织生理的关键基因,通过与VEGFR-2 相互结合,参与到血管张力控制、血管生成的一系列过程[13]。在心血管疾病中,活性氧物种(ROS)、氧化脂质等在血管部位的累积会进一步增强VEGF-A 和VEGFR-2的产生,共同导致血管生成[14]。因此,本文在细胞水平上探究miR-31 对RAECs 功能及FIH/VEGF 通路的影响,对于广泛的心血管疾病可能会产生有利的启示。
目前,国内外的原代RAECs 分离培养方法分为植块法及植块法联合消化法,在内皮翻转后结扎烧焦、整体植块法中,使用了缝线、缝合针、加热钳、鼠尾胶包被[15];在内皮外翻或剖开、血管段或组织块植块法中,使用了眼科显微器械[16];在主动脉环植块法中,使用了明胶包被、含肝素的PBS 灌注[17];在内皮外翻、消化压片法中,使用了眼科显微器械、显微针、明胶包被[18],且均另外添加了内皮细胞生长因子、肝素、胰岛素等营养因子,达近融合状态时间在7 ~14 d 不等。本文建立了原代大鼠内皮细胞的分离培养方法,并揭示了miR-31 对RAEC细胞功能的积极作用,可能与血管生成相关的FIH /VEGF-A / VEGFR-2 通路相关。在不进行包被处理、无特殊器械、不添加昂贵营养因子的情况下,成功培养了原代及传代RAECs。而后,通过观察miR-31对RAECs 增殖的作用,以及测定细胞中miR-31 与FIH、VEGF-A 和VEGFR-2 这些血管生成相关通路中关键分子的表达情况,来探索miR-31 对RAEC功能的影响及其潜在机制。结果表明,miR-31 使细胞增殖明显加快,下调FIH 水平,上调VEGF-A 和VEGFR-2 水平,由此提示miR-31 促进RAEC 细胞增殖可能是通过下调FIH、上调VEGF-A 和VEGFR-2实现的。
在之后的研究中,可以在细胞水平上和动物水平上验证miR-31 是否直接靶向FIH,关注于FIH 参与调节的下游因子,还可以在广泛的心血管疾病中进行相关机制的探索。此次研究将miR-31 与内皮细胞联系起来,为开发心血管疾病的新型治疗策略提供了新思路。
