盐度对共代谢降解底泥多环芳烃的影响及微生物群落响应
2024-01-26姚欣泽董文艺王宏杰于晓红赵子龙
王 锋,姚欣泽,杨 跃,赵 玥,董文艺,4,5,6,王宏杰,4,5,6,于晓红,赵子龙,5,6
(1.哈尔滨工业大学(深圳) 土木与环境工程学院,广东 深圳 518055;2.哈尔滨工业大学(深圳) 经济管理学院,广东 深圳 518055;3.深圳能源环保股份有限公司,广东 深圳 518048;4.城市水资源与水环境国家重点实验室(哈尔滨工业大学),哈尔滨 150090;5.深圳市水资源利用与环境污染控制重点实验室(哈尔滨工业大学(深圳)),广东 深圳 518055;6.城市高浓度废水处理与资源化实验室(校企联合),广东 深圳 518055)
目前,城市河道外源污染问题已基本得到有效控制,但由河道底泥引发的“內源”污染依旧对水体造成一定的影响。研究表明,持久性有机物多环芳烃(polycyclic aromatic hydrocarbons,PAHs)广泛存在于河道污染底泥中[1-3],由于其具有致畸、致癌、致突变的危害[4],一直都是河道“内源”污染治理的重难点。美国环境保护署(USEPA)将16种PAHs列为优先控制污染物,主要分为低分子质量PAHs(2~3环),包括萘、苊烯、苊、菲、蒽;中分子质量PAHs(4环),包括荧蒽、芘、苯并[a]蒽、芘;高分子质量PAHs(5~6环),包括苯并[b]蒽、苯并[k]荧蒽、苯并[a]芘、二苯并[a,h]蒽和苯并[g,h,i]芘[5]。目前,针对底泥中以16种PAHs为代表的难降解有机物污染,主要采用强化生物共代谢技术进行处理[5-9]。生物共代谢通过向底泥中投加外源营养物质,如乙酸钠、葡萄糖、邻苯二甲酸、甲醇等[10]作为碳源,促进底泥土著微生物生长繁殖,进而代谢底泥中PAHs等难降解的污染物质[10-11]。因此,微生物菌群是决定共代谢体系降解目标污染物效果的核心[12-16]。
前期研究表明,微生物共代谢降解底泥PAHs中,温度和pH是重要的影响因素。Zhong等[17]研究了温度对共代谢降解PAHs的影响,表明温度对PAHs降解速率影响较大,温度越高,PAHs降解速率越快,但温度对PAHs降解率无明显影响。Tam等[18]研究了底泥pH对共代谢降解PAHs的影响,发现底泥pH对PAHs降解率影响较大,不同微生物对环境pH的要求存在一定差异,底泥碱性越强,PAHs降解率越高。但吴华财等[19-20]的研究表明,高盐环境会改变反应介质的渗透压而影响微生物活性,因此,盐度对微生物共代谢降解底泥中污染物也具有一定的影响。感潮河段水质较常规河道具有高盐度、高硫酸盐的特性,且上覆水受潮汐反复冲刷的影响,盐度不断波动,对底泥中PAHs共代谢降解、底泥微生物群落变化及关键酶的活性、代谢速率等产生了不可预知的影响。

1 实 验
1.1 底泥的采集
试验底泥取自南方某市某河下游入海口感潮段,取样点靠近珠江口(北纬22°75′5718″,东经113°79′1108″),潮汐特征为不规则半日潮,每天受两次涨落潮影响,日平均潮差1.2 m,上覆水盐度整体波动范围为7‰~18‰。采用抓斗采样器取样,采样深度为0~60 cm。采集的底泥及上覆水污染物本底值如表1所示。

表1 供试底泥及上覆水本底值Tab.1 Background value of tested sediment and overlying water
1.2 试验装置
本试验系统由模拟河道、进水海水箱、进水淡水箱和退水水箱组成(图1),泥水体积比为1∶4,水力停留时间为12 h。共5组实验,每组进水水箱中配水盐度不同,配水盐度及反应器主要参数如表2所示。根据河道底泥及上覆水的实际情况,试验系统温度控制在(25±5)℃。考虑试验所用底泥的取样潮汐河段为不规则半日潮,每天高低潮各两个,一个半日潮之间间隔约12 h,故每日早8:00用蠕动泵定时从盐水箱泵入人工海水以模拟海水涨潮,从淡水箱泵入等体积的自来水以模拟上游径流,从最低水位到最高水位之间时间间隔设置为1 h。每日晚20:00定时打开排水管出水以模拟退潮,保留一定体积的出水进入海水水箱,第二天作为涨潮海水重新进入反应器,以模拟近海河道受潮汐影响时往复流的特点,试验周期90 d。
底泥中投加的共代谢药剂为乙酸钠耦合邻苯二甲酸的复配药剂,乙酸钠作为共代谢反应的主要碳源,邻苯二甲酸作为底泥微生物好氧共代谢反应的促进剂,单位干泥投加量依据前期预实验[22]最终确定为乙酸钠40 mg/g,邻苯二甲酸0.02 mg/g。
1.3 样品处理、分析和质量控制
样品处理:准确称取15.0 g底泥样品置离心管(250 mL)中,加入30 mL体积比为1∶1的二氯甲烷-丙酮溶液静置2 h,匀浆提取1 min后,微波振荡提取15 min,10 000 r/min转速下离心分离5 min,提取过程重复2次,取上层有机相清液5 mL,用浓缩仪40 ℃浓缩干,正己烷定容至2.5 mL,漩涡15 s后过0.22 μm滤膜至进样瓶,等待上机。
样品分析:用气相色谱-质谱联用仪(GC-MS,Agilent 6890 Plus GC-5973MSD,美国)对底泥中16种PAHs进行分析,采用两种升温分析程序。仪器分析条件及升温分离程序如下:选择性离子扫描模式(SIM)定量,HP-5MS细管色谱柱(30 m×0.25 mm×0.25 μm),以He作载气,流速mL/min;无分流进样(进样体1 μL),进样口温度280 ℃,PAHs测定初始炉温60 ℃;程序升温到300 ℃(5 ℃/min),整个程序运行时间68 min。MS条件: EI电离源70 eV,离子源温度230 ℃,扫描范围50~550 u。
质量控制:实验过程进行严格的质量控制,根据特征分子离子峰、保留时间以及质谱图的质谱数据库(NIST2002)匹配分析对样品中的组分进行定性分析,用指示物的回收率监测和评价实验质量。为了保证数据质量,采用了方法空白和样品平行样等质控手段,控制实验流程中的人为因素污染以及操作过程的准确性。16种PAHs的标准曲线相关系数均大于99.9%,底泥样品中一批测13个样,包括1个空白、1个平行、1个加标回收率,有效数据10个,PAHs的空白加标回收率为75.5%~100%。
1.4 检测方法
1.4.1 常规指标检测方法
1.4.2 微生物群落结构测定
底泥细菌总DNA提取、PCR操作和16S rRNA测序由上海美吉生物医药公司完成。首先,采用Power Soil DNA提取试剂盒(MO Biomedical,U. S.)对样本中的DNA进行提取;然后,选取细菌基因的V3~V4区进行聚合酶链式反应(PCR)扩增,引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。PCR反应体系(20 μL):5×FastPfu Buffer 4 μL,dNTPs 2 μL,引物各0.8 μL,FastPfu聚合酶0.4 μL,模板DNA 10 ng,加无菌水至20 μL。PCR条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,35个循环,最后72 ℃延伸5 min。2%(质量分数)琼脂糖凝胶电泳检测PCR产物,PCR采用ABI GeneAmp 9700型PCR仪。在使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物后,用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后,根据每个样本的不同测序量要求进行相应比例混合。最后,按照Illumina MiSeq平台的测序要求进行测序。
1.4.3 数据处理与分析
采用Excel 2021和Origin 2018进行数据处理和作图,运用SPSS 20.0进行单因素方差(ANOVA)分析,采用最小显著差异法(LSD)比较数据组间的差异(P<0.05)。采用Mothur软件计算土中细菌的ACE指数、Chaol指数、Shannon指数和Simpson指数,采用R语言的“gtern”包对不同样本的物种组成进行比较分析。
2 结果与讨论
2.1 多环芳烃的降解效果
上覆水不同盐度波动条件下(0~50‰),90 d内底泥微生物共代谢降解PAHs质量分数变化如图2所示。随着上覆水盐度波动,底泥中16种PAHs的降解率经历了两次大幅下降。当盐度波动从0~20‰升高到>20‰~40‰时,PAHs的降解率从42.0%下降至29.0%;当盐度波动从>20‰~40‰升高到>40‰~50‰时,PAHs的降解率从29.2%下降至12.9%。低盐环境(0~20‰)下底泥PAHs的降解率是高盐环境(>20‰~50‰)的1.5~3.3倍。在反应第90 天时,0~10‰、>10‰~20‰、>20‰~30‰、>30‰~40‰和>40‰~50‰盐度条件下底泥PAHs的质量分数分别为3 073、3 117、3 821、3 809和4 683 μg/kg。这些结果表明盐度的升高对共代谢降解底泥PAHs具有显著影响(P<0.05),这是因为高盐环境会抑制传统微生物的生长和降解能力,破坏正常的代谢功能,抑制PDO、C12O、C23O等关键的PAHs降解酶活性[23]。彭子淇等[24]也证明,高盐度环境会迫使PAHs降解菌发生脱水和PDO、C12O酶失活,致使PAHs降解率较低。Thomas和Vijendra等[25-26]的研究表明,共代谢降解过程主要通过促进PAHs降解菌的生长富集来加强PAHs的降解。本研究在相同菌群特征的5组供试底泥中,给予同等的碳源水平,乙酸钠为底泥土著微生物的生长提供了优质的碳源,邻苯二甲酸作为酶促反应的中间产物,有效促进了厌氧降解反应的正向进行[27]。随着不同反应体系中盐度的升高,PAHs的去除率逐渐降低,可见过高盐度会抑制底泥微生物共代谢降解PAHs。
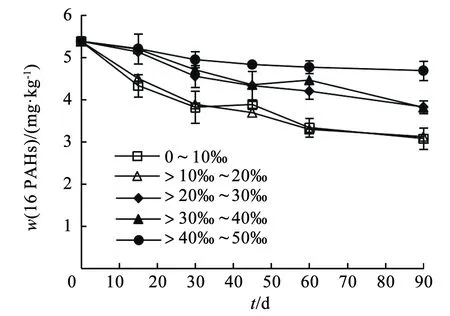
图2 上覆水盐度波动对PAHs降解效果的影响Fig.2 Effect of salinity fluctuation of overlying water on PAHs degradation
2.2 总有机碳质量分数变化
不同盐度波动条件下,底泥微生物共代谢降解周期90 d内TOC质量分数的变化如图3所示。共代谢全周期内不同上覆水盐度条件下,TOC质量分数均呈现先上升,然后缓慢下降并逐渐稳定的趋势。不同盐度下底泥TOC的质量分数在前10 d内均有提高,这是因为共代谢中添加的乙酸钠和邻苯二甲酸为外加碳源,使得底泥中TOC质量分数迅速升高。反应前期(第0~60天),上覆水盐度在低盐(>10‰~30‰)条件下TOC降解率高于上覆水过低盐度(0~10‰)和高盐度(>30‰~50‰)情形。共代谢反应后期(第60~90天),不同上覆水盐度波动条件下,TOC降解率相近。5组实验组反应60 d时,底泥TOC的质量分数分别为2.38%、1.99%、2.08%、2.34%和2.56%,反应90 d时,各组底泥TOC的质量分数分别为1.91%、2.10%、2.31%、1.99%和2.04%,上覆水盐度不再是共代谢降解TOC的限制因素。共代谢前期低盐环境(>10‰~30‰)底泥TOC降解率是过低盐环境(0~10‰)的1.1~1.2倍,高盐环境(>30‰~50‰)的1.1~1.3倍(P<0.05)。前期过低盐度上覆水(0~10‰)TOC降解效果相对较低,原因可能是过低盐环境下降解TOC的相关微生物为非优势菌属[28];前期高盐环境(>30‰~50‰)下,TOC降解效果同样受到限制,这是因为高盐环境会抑制土著微生物的代谢,致使共代谢速率下降,导致底泥TOC残留量较高[29];而后期盐度对TOC降解率的影响降低,这可能与后期盐度达到泥-水平衡有关[30]。因此,适宜的上覆水盐度对底泥TOC的降解效果具重要意义。

图3 上覆水盐度波动对TOC降解效果的影响Fig.3 Effect of salinity fluctuation of overlying water on TOC degradation
2.3 底泥理化性质变化
2.3.1 pH
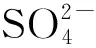

图4 上覆水盐度波动对底泥pH和ORP变化的影响Fig.4 Effect of salinity fluctuation of overlying water on the changes of sediment pH and ORP
2.3.2 ORP
上覆水不同盐度波动条件下,底泥微生物共代谢90 d内ORP的变化如图4(b)所示。
在整个代谢周期内,随着共代谢反应的进行,底泥ORP整体呈下降趋势。当上覆水盐度较低(0~20‰)时,底泥ORP下降显著,反应90 d时,0~10‰、>10‰~20‰盐度条件下底泥ORP分别为-369、-333 mV;当上覆水盐度较高(>20‰~50‰)时,底泥ORP下降相比低盐环境受到一定程度抑制,反应90 d时,>20‰~30‰、>30‰~40‰、>40‰~50‰盐度条件下底泥ORP分别为-287、-269、-284 mV。由此可知,过高的盐度会对底泥中的微生物厌氧代谢过程造成一定的抑制,减缓ORP的下降。这主要是由于高盐环境产生的高渗透压会使底泥中多数厌氧微生物脱水而失去活性,抑制了底泥中厌氧代谢反应,改变微生物群落结构[19-20],使得微生物共代谢反应和速率下降。
2.4 底泥硫形态的转化
2.4.1 AVS质量分数
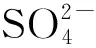
2.5 底泥微生物群落响应
2.5.1 微生物群落的丰富度和多样性
对不同上覆水盐度波动条件下底泥微生物群落的丰富度和多样性进行分析,每个样本获得超过76 000个序列(表3)。低盐度环境(0~10‰)下底泥中的OTUs总数较高(774),当盐度上升到>40‰~50‰时,OTUs总数下降为616。不同上覆水盐度波动条件下,底泥样本微生物多样性指标Shannon指数在5.663~6.369变化,Simpson指数在0.006~0.032变化。其中,Shannon指数与上覆水盐度呈正相关,上覆水盐度越高,Shannon指数越高;Simpson指数与上覆水盐度呈负相关,上覆水盐度越高,Simpson指数越低。Shannon指数和Simpson指数分别反映了微生物群落的异质性和多样性[38-39],可见上覆水盐度越高时样品中微生物群落均匀性越差;上覆水盐度越低时样品中微生物个体分配越均匀。

表3 不同上覆水盐度波动条件下底泥细菌多样性指数Tab.3 Bacterial diversity index of sediment under different overlying water salinity fluctuation conditions
表3中的覆盖率指数为0.977~0.981,表明本研究构建的序列库涵盖了微生物群落的多样性,5组样品中上覆水盐度越低的组别覆盖率指数越高。Chaol指数为3 160~3 748,ACE指数变化范围为3 201~3 848。其中,低盐度环境(0~10‰)下底泥样品中Chao1指数和ACE指数都是5组中最高,表明在低盐环境下底泥样品中微生物物种数最多。高盐度环境(>40‰~50‰)下底泥样品中Chao1指数和ACE指数都是5组中最低,表明厌氧微生物对盐度胁迫环境的适应性,在上覆水盐度较高的环境条件下,底泥微生物种类数量减少但生物多样性得以保持稳定。
2.5.2 微生物群落结构的变化
通过高通量测序技术分析底泥样品中细菌群落特性,解析上覆水盐度波动变化对微生物群落结构的影响。所有底泥样本的OTUs均在97%鉴别阈值控制内。门水平和属水平上底泥微生物群落的变化如图6所示。

图6 不同上覆水盐度波动下底泥微生物门水平群落组成图和属水平群落丰度热图Fig.6 Horizontal community composition diagram and genus level community abundance heat map of sediment microbial phylum under different overlying water salinity fluctuations
图6(a)显示,低盐度环境下(0‰~10‰)底泥样品中微生物群落主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)3个优势菌门组成,分别占比52%、16%和7%。随着盐度增加,Proteobacteria和Firmicutes种群丰度逐渐降低;相反,脱硫杆菌门(Desulfobacter)和绿弯菌门(Chloroflexi)的丰度显著增加。低盐度环境(0~10‰)中,Desulfobacter和Chloroflexi种群丰度占比分别为2%和5%,当上覆水盐度逐步增加至高盐(>40‰~50‰)状态时,Desulfobacter和Chloroflexi种群丰度占比达到21%和10%。已有报导表明,Proteobacteria和Firmicutes是典型的芳烃类污染物高效降解菌[40]。Firmicutes可以诱导底泥中大分子有机物快速向代谢中间产物有机酸转化,进而加快共代谢降解PAHs的速率[41]。由此可推测,上覆水盐度是通过抑制Proteobacteria和Firmicutes这两类污染物降解菌群的丰度,进而导致共代谢降解PAHs的能力下降。Desulfobacter是一种化能自养型细菌[42],在氧化硫化物的过程中获得能量,当上覆水盐度升高时,硫酸盐质量浓度也相应增加,在微生物共代谢过程中转化成的硫化物随反应时间延长逐渐增多,进而诱导了Desulfobacter种群丰度的大幅增长。
图6(b)显示了随上覆水盐度的增加,底泥微生物属水平上群落结构的变化,不同上覆水盐度波动条件下底泥样品中微生物种群丰度和组成相差较大。在低盐度环境下(0~10‰),海细菌属(Marinobacterium)和海杆菌属(Marinobacter)为优势属(相对丰度高于2%),Marinobacterium和Marinobacter相对丰度分别为2.94%和2.88%。Marinobacter属于α-变形菌(α-Proteobacteria)的优势菌属,参与芳香烃的共代谢降解[43]。当上覆水盐度升高(超过10‰),底泥中广泛存在的Arcobacteraceae、Denitrovibrio、Oceanicaulis和Thalassospira的种群丰度显著降低,可见高盐环境对河道底泥土著菌群的胁迫影响。随上覆水盐度的升高,livecontrolB21、Sulfurovum、SBR1031和VadinHA17的种群丰度显著升高,说明此4类菌属与Arcobacteraceae等受高盐胁迫的菌属具有不同的环境适应机制,高盐环境诱导了其种群丰度的增长。
3 结 论
1)低盐环境更利于微生物共代谢降解底泥PAHs。上覆水盐度过高对乙酸钠联合邻苯二甲酸的共代谢降解体系存在抑制作用,底泥PAHs降解率受限。同样,对底泥TOC的降解也表现出类似的影响。
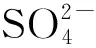
3)高盐环境对河道底泥土著微生物菌群具有胁迫效应。低盐环境下Marinobacterium和Marinobacter为共代谢降解PAHs的优势菌属,而在高盐胁迫下这两类优势菌群的活性受到抑制,耐盐菌SBR1031和Sulfurovum逐渐成为新的优势菌属。
4)在实际工程应用中,上覆水为低盐环境(0~20‰)下,更适合采用微生物共代谢技术降解污染河道底泥PAHs。
