铜死亡相关LncRNA预测胃癌的预后及免疫反应
2024-01-26白红艳王硕费素娟苗蓓
白红艳 王硕 费素娟 苗蓓


收稿日期:2023-07-24;修回日期:2023-09-01。
作者简介:白红艳,硕士研究生。
* 通信作者:苗蓓,副教授,主要从事胃肠道常见病及肠脑互动紊乱疾病等的研究。E-mail: miaobei@ xzhmu.edu.cn。
摘 要:基于生物信息学分析构建预后相关的预测模型,探讨铜死亡相关LncRNA与胃癌(GC)在免疫和预后方面的关系。从癌症基因组图谱(TCGA)数据库下载胃癌患者的RNA测序和临床数据,基于共表达分析筛选出铜死亡相关LncRNA,通过LASSO回归和多因素Cox回归分析构建出与胃癌预后密切相关的铜死亡相关LncRNA风险预测模型,并计算所有胃癌患者样本的风险评分。通过Kaplan-Meier生存分析、回归分析和受试者工作特征(ROC)曲线等证实模型的预后预测性能,并分析风险评分与通路富集分析、免疫浸润细胞、免疫检查点基因、体细胞基因突变及抗癌药物敏感性的相关性。差异表达分析结果表明,LncRNA HAGLR在肿瘤组织中的表达上调。通过实时荧光定量PCR(qRT-PCR)检测LncRNA HAGLR在69例行根治性手術胃癌患者的癌组织及癌旁组织的表达。结果表明,相比于癌旁组织,胃癌组织中HAGLR表达上调,且与肿瘤大小、浸润深度、肿瘤TNM分期、分化程度及淋巴结转移成明显相关性(P<0.05)。本研究构建的铜死亡相关LncRNA预后模型具有较高的预测价值,并且与免疫细胞浸润异质性明显相关,在预测患者免疫治疗效果及指导化疗药物选择方面具有一定的临床价值。
关键词:铜死亡;LncRNA;胃癌;免疫逃避;预后
中图分类号:R735.2 文献标志码:ADOI:10.3969/j.issn.1007-7146.2023.05.009
Cuproptosis-related LncRNA Predict Prognosis and Immune Response in Gastric Cancer
BAI Hongyan, WANG Shuo, FEI Sujuan, MIAO Bei*
(Department of Gastroenterology, Affiliated Hospital of Xuzhou Medical University, Xuzhou 221004, China)
Abstract: Based on bioinformatics analysis, a prognosis-related prediction model was constructed to explore the relationship between copper death-related LncRNA and gastric cancer (GC) in immunity and prognosis. RNA sequencing and clinical data of gastric cancer patients were downloaded from the Cancer Genome Atlas (TCGA) database, copper death-related LncRNA were screened based on co-expression analysis, and a copper death-related LncRNA risk prediction model closely related to the prognosis of gastric cancer patients was constructed by LASSO regression and multivariate Cox regression analysis, and the risk scores of all gastric cancer patient samples were calculated. The prognostic prediction performance of the model was confirmed by Kaplan-Meier survival analysis, regression analysis and ROC curve, and the correlation between risk score and pathway enrichment analysis, immune infiltrating cells, immune checkpoint genes, somatic gene mutations and anticancer drug sensitivity was analyzed. The results of differential expression analysis showed that the expression of LncRNA HAGLR in tumor tissues was upregulated. The expression of LncRNA HAGLR in cancer tissues and paracancerous tissues in 69 patients with radical surgery was detected by quantitative real-time PCR (qRT-PCR). The qRT-PCR results showed that the expression of HAGLR in gastric cancer tissues was upregulated compared with adjacent tissues, and was significantly correlated with tumor size, the depth of invasion, clinical stage, degree of differentiation and lymph node metastasis (P<0.05). The prognostic model constructed from copper death-related LncRNA has high prognostic value and is significantly related to the heterogeneity of immune cell infiltration, and has certain clinical value in predicting the effect of immunotherapy and guiding the selection of chemotherapy drugs in patients.
Key words: cuproptosis; LncRNA; gastric cancer; immune invasion; prognosis
(Acta Laser Biology Sinica, 2023, 32(5): 460-472)
胃癌(gastric cancer,GC)是全球惡性肿瘤中第三大最常见的死亡原因[1]。据统计,2020年新增病例1 089 103例,死亡病例768 793例[2]。随着早期诊断技术的发展,胃癌的发病率呈现一定的下降趋势,但晚期患者无法手术,且对抗癌药物的反应各不相同,5年生存率仍然很低,预后仍然很差[3]。手术和术后辅助治疗是GC的主要治疗方法,而近年来,肿瘤免疫疗法显示出使肿瘤消退的强大作用,已成为治疗中越来越重要的一部分。然而,大量患者对这些疗法没有反应,迫切需要探索治疗耐药机制,寻求有效的生物标志物,以更好地预测预后和指导临床治疗。
铜诱导的细胞死亡不同于其他形式的调节性细胞死亡[4]。细胞对铜的耐受性有一定的阈值,过量的铜会导致氧化应激和细胞毒性[5]。铜在线粒体中的积累和直接结合驱动脂酰化TCA循环酶的聚集[6]。作为一种关键的微量元素,铜也是免疫系统功能所必需的。缺铜可能会影响免疫细胞在组织中的分布或白细胞的成熟模式[7]。此外,瘤内铜可以调节程序性死亡配体(programmed death-ligand 1,PD- L1)表达并影响肿瘤免疫逃避[8]。许多研究表明,铜死亡与癌症(包括乳腺癌、结肠癌、肝癌和肺癌)的进展、预后及治疗密切相关[9-10]。重要的是,铜死亡抑制胃癌细胞生长[11]并诱导抗肿瘤活性[12]。因此,铜死亡在新兴免疫疗法中发挥着重要作用,靶向诱导铜死亡为胃癌提供了有效的治疗方向。
长链非编码RNA (long non-coding RNA,LncRNA)是一类长度超过200个核苷酸的非编码转录本[13],除了参与基因组转录、翻译和翻译后修饰等过程[14],还在肿瘤中发挥重要调控作用[15]。例如,LncRNA参与免疫系统的基因表达,并调节抗肿瘤免疫反应[16]。此外,最近的研究观察到,LncRNA与癌细胞中的程序性细胞死亡相关[17],这表明,LncRNA与铜死亡之间存在潜在联系。值得关注的是,关于胃癌与铜死亡相关LncRNA之间关系的研究较少,铜死亡相关LncRNA在胃癌预后和免疫反应中的作用机制有待进一步阐明。
本研究旨在筛选出与铜死亡相关的LncRNA,构建适用于胃癌患者的预测生存结局和免疫反应的预后模型,同时对胃癌组织样本进行LncRNA HAGLR的表达分析,以期为改善胃癌患者预后、开辟新的治疗靶点提供证据支持。
1 材料和方法
1.1 TCGA数据集
从TCGA数据库获得胃癌患者的转录组数据和临床资料。本研究共获得371例患者样本。临床资料包括性别、年龄、肿瘤分期、肿瘤分级、生存状况、生存时间。从先前发表的一项研究中提取了49个与铜死亡相关的基因[4]。本研究获得徐州医科大学附属医院伦理委员会的批准,伦理批号:XYFY2023-KL263。遵照伦理相关规定收集了69例GC患者(年龄为28~92岁,平均年龄为63岁)的肿瘤组织和匹配的邻近癌旁组织(距离肿瘤边缘至少5 cm)。这些患者于2021年1月至2022年12月在徐州医科大学附属医院接受了常规根治性手术。
1.2 铜死亡相关LncRNA的筛选
“limma”包用于进行LncRNA和铜死亡基因相关性分析,筛选出与49个铜死亡基因共表达的LncRNA,设定阈值为|Cor|>0.4和P<0.05。
1.3 基于铜死亡相关LncRNA的预后模型构建
采用等效抽样方法将样本分为训练组(260例)和验证组(111例)。进行单变量Cox回归分析以筛选出训练组中与预后有关的铜死亡相关LncRNA(0.05作为阈值),并绘制森林样地图。为了提高预测准确性和避免过度拟合,使用“survival”和“glmnet”包进行最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)Cox回归分析,并进行1 000倍交叉验证。最后,通过多变量Cox回归分析识别风险基因并计算风险系数,风险评分计算公式如下:
风险评分 =系数×LncRNA
训练组中风险评分的中位数设为临界值,将胃癌样本分为高危组和低危组。
1.4 铜死亡相关LncRNA预后模型的验证
采用Kaplan-Meier方法比较两组的总体生存时间差异,并使用ggplot2软件包创建风险评分与患者生存状态之间的危险因素关联图。进行包括风险评分和临床资料在内的单变量和多变量Cox回归分析,以确定该模型是否可以作为临床预后的独立预测因子。根据受试者工作特征(receiver operating characteristic curve,ROC)曲线和无进展生存期(progression free survival,PFS)分析评估风险模型预测GC患者的总生存期(overall survival,OS)和PFS的预测准确性,并构建一致性指数模型进一步验证它们的预测能力。
1.5 免疫检查点基因分析
为了探究免疫检查点基因阻断的治疗效果,我们根据TCGA-LIHC基因表达谱,将筛选出的12个LncRNA与关键免疫检查点基因建立共表达网络(P<0.05),包括LILRB4、CTLA4、CD86和CD274等,并分析关键免疫检查点基因与铜死亡相关LncRNA的相关性。
1.6 肿瘤免疫细胞浸润与免疫应答分析
使用“ssGSEA”包进行单样本基因集富集分析(single sample gene set enrichment analysis,ssGSEA)以评估23种免疫细胞在所有患者的富集差异和免疫功能。随后,利用“ESTIMATE”包计算样本肿瘤微环境(tumor microenvironmrnt,TME)中免疫细胞和基质细胞的成分。运行肿瘤免疫功能障碍与排斥算法(tumor immune dysfunction and exclusion,TIDE)计算数据集(http://tide.dfci.harvard.edu)中每个患者的免疫治疗评分,展示风险评分和免疫检查点阻断治疗之间的关系。
1.7 功能富集分析
采用R编程语言(4.1.3)版本中的clusterProfiler包进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,以确定涉及GC的关键基因和通路。
1.8 风险评分与肿瘤突变负荷的关系
肿瘤突变负荷(tumor mutation burden,TMB)是每兆碱基肿瘤DNA的总外显子突变计数。使用R包“maftools”计算每位患者基于LIHC样本突变数据的TMB评分。
1.9 药物敏感性评估
使用“pRRophetic”R包对如塞卡替尼、达沙替尼、吉非替尼和甲氨蝶呤等药物进行药敏分析,并采用Wilcoxon秩和检验比较高危组和低危组的半抑制浓度(half maximal inhibitory concentration,IC50)差异。数据来自肿瘤药物敏感性基因组学(genomics of drug sensitivity in cancer,GDSC)数据库(https://www.cancer-rxgene.org/)。
1.10 实时荧光定量PCR(qRT-PCR)
高灵敏度染料法定量PCR检测试剂盒和逆转录酶试剂盒均购自南京诺唯赞生物科技股份有限公司。利用Trizol试剂快速提取法提取组织中总RNA。逆转录反应按照逆转录酶试剂盒说明,在20 μL体系中加2 μg总RNA进行cDNA的合成。采用2×SYBR Green PCR Master Mix对cDNA进行扩增。LncRNA HAGLR上游引物:5'-CATTCTCCTCCTGTATTCTCT-3',下游引物:5'-GTCCTGGTCACTGGTAAG- 3';内参GAPDH上游引物:5'-GACTCATGACCACAAGTCCATGC-3',下游引物:5'-AGAGGCAGGGATGATGTTCTG- 3'。每个样本进行3次重复试验,以GAPDH作为内参照。采用2-△△Ct法[18]将LncRNA相对的表达量计算出来,△Ct值=樣本和内参基因的Ct值之差。
1.11 统计处理
单变量和多变量Cox回归分析用于计算风险比并确定独立的风险因素。利用ROC曲线评估预后模型的敏感度和特异性。利用Wilcoxon秩和检验进行两组之间基因差异分析,Spearman相关检验分析基因表达间的相关性。qRT-PCR试验采用两组配对样本t检验。所有统计分析均使用R语言(版本4.1.3)进行。P<0.05被认为是显著统计学差异的标准。
2 结果与分析
2.1 在GC样本中鉴定铜死亡相关LncRNA
使用GENCODE数据库在TCGA-LIHC表达矩阵中鉴定了16 876个LncRNA。Pearson分析鉴定出801个铜死亡相关LncRNA。这些LncRNA与ABCB6、BACE1、COX19、DAXX、FDX1、GLS、SNCA等49个铜死亡相关基因相关。从TCGA数据库中获得371例GC患者的详细临床病理特征,随机分为训练组和验证组,两组临床指标基本一致,具有可比性。数据见表1。
2.2 铜死亡相关LncRNA预后模型的构建
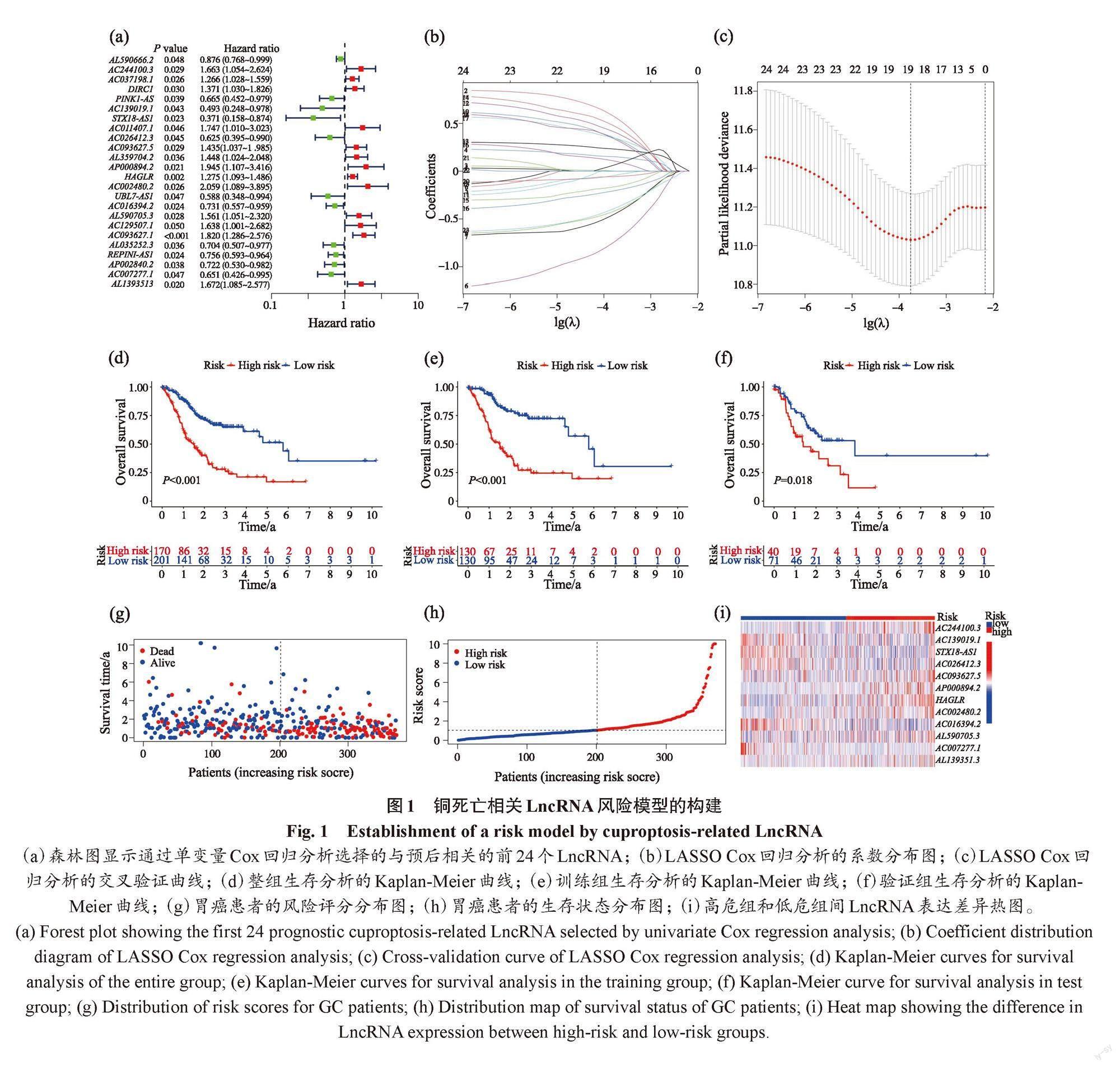
利用单因素Cox回归分析筛选出与胃癌患者OS显著相关的260个铜死亡相关LncRNA(P<0.05),图1a显示了前24个的风险比和P值,其中13个均为HR>1的危险基因(P<0.05)。然后,采用LASSO Cox回归分析和多变量Cox回归分析筛选得到12个与预后最相关的变量,构建了风险预后模型(图1b~1c)。风险评分=(0.29×Expression HAGLR)+(0.86×Expression AC244100.3)-(1.00×Expression STX18-AS1)+(0.40×Expression AC093627.5)-(1.15×Expression AC139019.1)-(0.52×Expression AC026412.3)+(0.78×Expression AP000894.2)+(0.91×Expression AC002480.2)-(0.40×Expression AC016394.2)+(0.51×Expression AL590705.3)-(0.66×Expression AC007277.1)+
(0.56×Expression AL139351.3)。Kaplan-Meier生存曲线表明,高危组的OS明显低于低危组(图1d~1f)。患者的死亡例数随着风险评分的上升明显上升(P<0.05),这表明风险评分和生存时间显著相关,见图1g~1h。热图展示出高危和低危组中12个LncRNA的表达含量差异(图1i)。
2.3 铜死亡相关LncRNA预后模型的预后价值
单变量Cox回归分析结果表明,年龄(P=0.004,HR=1.026,95%CI[1.008,1.044])、肿瘤分期(P<0.001,HR=1.534,95%CI[1.241,1.896])和风险评分(P<0.001,HR=1.082,95%CI[1.056,1.108])是胃癌进展的危险因素,见图2a。多变量Cox回归分析结果表明,在调整其他混杂因素影响后,风险评分(P<0.001,HR=1.085,95%CI[1.058,1.113])仍为一个独立的预后因素(图2b)。低危组GC患者具有更好的PFS(P<0.05,图2c)。时间依赖性ROC曲线分析结果显示,1年、3年和5年OS的预后LncRNA模型的曲线下面积(area under curve,AUC)值分别为0.736、0.763和0.740(图2d)。分类ROC曲线显示,风险评分模型的AUC值远高于其他临床因素的AUC值,一致性指数再次证实模型具有优于临床病理特征的预测预后能力,见图2e~2f。
2.4 免疫检查点基因分析
多个免疫检查点(包括CTLA4、CD274、CD86和LILRB4)与铜死亡相关LncRNA及风险评分明显相关(P<0.05,图3a),CD86和LILRB4表达与风险评分呈正相关,而CTLA4和CD274表达与风险评分呈负相关(图3b~3e),这4个免疫检查点基因可能受12个铜死亡相关LncRNA调控。
2.5 基于预后模型亚组的综合免疫浸润分析
采用ssGSEA分析评估高危组和低危组GC患者13种免疫相关功能的状态。如热图所示,type_II_IFN_response、APC_co_stimulation、CCR和MHC_class I在高危组和低危组之间的差异有统计学意义(图4a)。分析TCGA肿瘤免疫浸润数据,两组之间大多数免疫细胞的浸润存在显著差异。高危人群的适应性免疫细胞浸润特别丰富,例如,γδT细胞、未成熟的树突状细胞、巨噬细胞、肥大细胞、自然杀伤T细胞和调节性T细胞(图4b)。尽管两组之间的免疫评分没有显著差异,但低危组患者表现出更高的肿瘤纯度和较低的基质成分(图4c~4d)。两组之间的TIDE评分差异有统计学意义(图4e)。据报道,肿瘤基质细胞参与免疫调节[19],能够阻止免疫细胞进入肿瘤实质,还可以阻止T细胞杀死肿瘤细胞[20]。TIDE分析可以评估不同风险模式患者的免疫治疗反应是否存在差异。高危组GC患者的基质成分和TIDE评分明显高于低危组。这表明低危组患者的免疫治疗效果可能更好。风险评分可作为GC患者免疫治疗效果的有意义的预测指标。
2.6 风险评分与肿瘤突变负荷相关性
根据TCGA数据库中GC患者的体细胞突变数据,计算并比较两组之间的TMB评分。结果表明,两组之间TMB评分具有显著差异,高危组的TMB水平更低(图5a)。采用TMB中位数评分将GC患者分为高TMB组和低TMB组。Kaplan-Meier生存曲线分析显示,高TMB组患者的OS明显高于低TMB组(图5b)。此外,我们以瀑布图形式可视化了两组的前15个高频突变基因,两组突变频率最高的基因均为TTN(图5c~5d)。
2.7 功能富集分析
为了了解导致高危组与低危组之间TME和PFS差异的潜在生物学机制,对两组间差异表达基因进行了GO功能富集分析和KEGG通路分析。生物学过程参与受体-配体相互作用、糖胺聚糖结合和激素活性的调节。细胞成分主要在细胞外基质、内质网和脂蛋白复合物中调节。分子功能主要调节水解酶、激素运输和血浆脂蛋白。根据KEGG分析,铜死亡相关LncRNA主要富集于分解代谢、蛋白加工和激素分泌等过程(图6a~6b)。
2.8 GC患者抗癌药物敏感性预测
使用“pRRophetic”R包共鉴定出6种药物,其敏感性(IC50)在高危组和低危组之间的差异有统计学意义(P<0.05)(图7),表明这些药物可能有助于指导GC患者的个性化治疗,并且阿糖胞嘧啶、达沙替尼和塞卡替尼可能是高危组患者治疗的预测候选药物。
2.9 胃癌LncRNA HAGLR表达
利用TCGA数据库检索发现,胃癌组织中LncRNA HAGLR表达明显上调,胃癌组织和癌旁组织样本中LncRNA HAGLR相对表达量分别为1.689和1.116,差异有统计学意义(图8a,P<0.05)。Kaplan-Meier生存曲线表明,LncRNA HAGLR与患者生存预后有关,高表达的患者具有较差的OS(图8b)。qRT-PCR结果显示,收集的胃癌组织和癌旁组织中LncRNA HAGLR相对表达量分别为1.39±0.70、0.75±0.39,差异有统计学意义(t=4.663,P<0.01),见图8c。并且LncRNA HAGLR的表达水平与性别、年龄及肿瘤部位无关(P>0.05),与肿瘤直径、浸润深度、分化程度、临床分期及淋巴结转移有关,差异有统计学意义(P<0.05),见表2。
3 讨论
鉴于胃癌的高度异质性,可用于靶向治疗的主要驱动基因尚未确定,而免疫疗法在治疗晚期和复发性胃癌患者方面拥有放疗和化疗所不具备的优势,具有重要的临床应用价值和前景。因此,识别肿瘤相关基因改变也许可以为胃癌的预后和免疫治疗提供一定的思路。
作为一个新术语,铜死亡被用来描述由铜引起的独特的生物过程。越来越多的研究表明,较高水平的铜与恶性肿瘤有关[21]。然而,许多研究都集中在铜死亡在癌症进展机制中的作用,预测癌症存活率方面的研究很少。LncRNA是一类没有编码功能的RNA,可以调节基因表达和蛋白质功能,形成复杂的监管网络。LncRNA的异常表达可直接或间接影响肿瘤微环境中的其他细胞,从而参与肿瘤免疫的形成[22]。随着研究深入,铜死亡相关LncRNA与肿瘤进展的关系愈加紧密,其在肿瘤预后预测中的潜在价值逐渐显现,但目前对于其在胃癌预后中价值的相关研究较少。
本研究系统地证明了铜死亡相关LncRNA在胃癌预后和肿瘤微环境中的作用。首先,基于TCGA数据集确定了新的与铜死亡相关的LncRNA预后特征,共鉴定出24种与铜死亡相关的预后LncRNA,通过LASSO回归筛除假阳性LncRNA,其中12个LncRNA被选入预测模型。然后,采用Kaplan-Meier生存分析、ROC曲線和一致性指数验证风险模型的预后价值。生存曲线证明高危组患者预后更差,ROC曲线中1、3、5年的 AUC分别为0.736、0.763、0.740,这表明模型在预测长期结果方面具有较高的准确性。此外,单因素、多因素Cox回归分析和一致性指数分析明确了模型的独立且优于临床特征的预测预后价值。
尽管免疫疗法对胃癌有效,但由于对肿瘤微环境及个体差异的不完全了解,其疗效并不一致。目前,一些临床数据表明,基因变化与免疫治疗反应之间存在相关性[23]。因此,有必要确定哪些患者最有可能对免疫治疗产生反应。CTLA-4是除PD-1/PD-L1之外的T细胞的关键负调节因子,它限制了抗肿瘤免疫反应[24],免疫检查点分析结果显示,其与风险评分呈负相关。ssGSEA结果表明,铜死亡相关LncRNA预后模型与GC组织中免疫细胞的富集有关。高肿瘤突变负荷也已成为预测许多癌症对免疫疗法反应的敏感生物标志物,包括肺癌、膀胱癌和头颈癌[25-26]。风险评分连同突变数据揭示了不同组间转录组水平基因变异频率的显著差异。在高危组和低危组中,分别有151名(90.42%)和173名(89.18%)患者被鉴定出体细胞突变。本研究对这些患者中最常见的15种突变进行了排序。TTN、TP53和MUC16基因的突变频率最高,与其他一些研究相似[27]。肿瘤中的非同义突变负荷较高可导致形成更多的新抗原,从而增加免疫原性并增强免疫治疗反应[28]。本研究中低危组表现出较高的肿瘤突变负荷以及较低的TIDE评分。这些结果提示,低危组较好的预后可能与其对免疫治疗产生反应有关,并且可从抗CTLA-4抗体治疗中受益更多。高危组更可能表现出免疫逃逸和免疫治疗耐药。另外,许多独立研究调查了化疗耐药现象中的个别LncRNA[29],但关于铜死亡相关LncRNA在预测化疗耐药性中的作用和功能的研究仍然缺乏。本研究利用TCGA数据库对胃癌样本数据进行分析,发现多种抗肿瘤药物在两组间具有明显差异,可用于预测胃癌患者的耐药倾向。
LncRNA常形成高度穩定的二级结构,在多种肿瘤生物学过程中发挥着重要作用。截至目前,在预测预后的12个铜死亡相关LncRNA中,只有HAGLR和AC007277.1被报道与癌症相关[30-31]。根据最近的一项研究,HAGLR(也称为HOXD-AS1和Mdgt)在胃癌细胞中明显过表达,敲除HAGLR可使JAK2/STAT3通路失活,从而抑制胃癌进展[30]。本研究纳入69例胃癌患者,比较了胃癌患者胃癌及癌旁组织中LncRNA HAGLR的相对表达量。结果证实,胃癌患者肿瘤组织中LncRNA HAGLR的相对表达量显著上调,并且HAGLR过表达与肿瘤大小、淋巴结转移、浸润深度、分化程度、临床分期有关。这表明,LncRNA HAGLR作为促癌基因有望成为提示胃癌预后的重要生物学指标,并为模型在临床应用提供了病理组织学证据。目前铜死亡相关LncRNA在胃癌中具体的生物学功能尚不十分明确,HAGLR极有可能是胃癌患者的一种潜在的治疗靶标,具有重要的研究价值。未来还需要通过细胞和动物试验等进一步探索LncRNA HAGLR、AC007277.1等参与胃癌进展的上下游分子机制。其余10种LncRNA尚未报道参与调控癌症的发生发展。本研究率先强调了他们作为胃癌患者临床诊治的潜在标志物和预后评估指标的潜力,对深入挖掘胃癌增殖、侵袭的多种调控途径有一定的提示和指导意义。这些发现都为未来控制胃癌提供强了有力的理论支持和新方向。
综上所述,本研究分别从生物信息学和临床组织学角度突出了铜死亡相关LncRNA在胃癌中的预测生存结局和临床应用价值,利用模型的评分系统赋予临床胃癌患者风险评分,可评估患者1、3、5年的生存率、免疫细胞浸润、体细胞突变负荷、免疫治疗疗效和指导用药选择,为胃癌患者个体化治疗提供了新的途径和思路。
参考文献(References):
[1] SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648.
[2] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA-A Cancer Journal for Clinicians, 2021, 71(3): 209-249.
[3] KARIMI P, ISLAMI F, ANANDASABAPATHY S, et al. Gastric cancer: descriptive epidemiology, risk factors, screening, and prevention[J]. Cancer Epidemiology Biomarkers & Prevention, 2014, 23(5): 700-713.
[4] TSVETKOV P, COY S, PETROVA B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins[J]. Science, 2022, 375(6586): 1254-1261.
[5] TANG D L, CHEN X, KROEMER G. Cuproptosis: a copper-triggered modality of mitochondrial cell death[J]. Cell Research, 2022, 32(5): 417-418.
[6] COBINE P A, BRADY D C. Cuproptosis: cellular and molecular mechanisms underlying copper-induced cell death[J]. Molecular Cell, 2022, 82(10): 1786-1787.
[7] PERCIVAL S S. Copper and immunity[J]. American Journal of Clinical Nutrition, 1998, 67(5 Suppl): 1064S-1068S.
[8] VOLI F, VALLI E, LERRA L, et al. Intratumoral copper modulates PD-L1 expression and influences tumor immune evasion[J]. Cancer Research, 2020, 80(19): 4129-4144.
[9] CHEN Y Q, TANG L, HUANG W T, et al. Identification and validation of a novel cuproptosis-related signature as a prognostic model for lung adenocarcinoma[J]. Frontiers in Endocrinology, 2022, 13: 960220.
[10] JIANG Z R, YANG L H, JIN L Z, et al. Identification of novel cuproptosis-related lncRNA signatures to predict the prognosis and immune microenvironment of breast cancer patients[J]. Frontiers in Oncology, 2022, 12: 988680.
[11] XIA Y, LIU X K, ZHANG L P, et al. A new schiff base coordinated copper(II) compound induces apoptosis and inhibits tumor growth in gastric cancer[J]. Cancer Cell International, 2019, 19: 81.
[12] LIU Y, GUAN X, WANG M L, et al. Disulfiram/Copper induces antitumor activity against gastric cancer via the ROS/MAPK and NPL4 pathways[J]. Bioengineered, 2022, 13(3): 6579-6589.
[13] KUNG J T Y, COLOGNORI D, LEE J T. Long noncoding RNAs: past, present, and future[J]. Genetics, 2013, 193(3): 651-669.
[14] JIA Y L, TIAN C, WANG H Y, et al. Long non-coding RNA NORAD/miR-224-3p/MTDH axis contributes to CDDP resistance of esophageal squamous cell carcinoma by promoting nuclear accumulation of beta-catenin[J]. Molecular Cancer, 2021, 20(1): 162.
[15] DU R Y, BAI Y, LI L. Biological networks in gestational diabetes mellitus: insights into the mechanism of crosstalk between long non-coding RNA and N-6-methyladenine modification[J]. BMC Pregnancy and Childbirth, 2022, 22(1): 384.
[16] XU M, XU X N, PAN B, et al. LncRNA SATB2-AS1 inhibits tumor metastasis and affects the tumor immune cell microenvironment in colorectal cancer by regulating SATB2[J]. Molecular Cancer, 2019, 18(1): 135.
[17] PAN J H, ZHANG X Y, FANG X D, et al. Construction on of a ferroptosis-related lncRNA-based model to improve the prognostic evaluation of gastric cancer patients based on bioinformatics[J]. Frontiers in Genetics, 2021, 12:739470.
[18] KOLENDA T, RYS M, GUGLAS K, et al. Quantification of long non-coding RNAs using qRT-PCR: comparison of different cDNA synthesis methods and RNA stability[J]. Archives of Medical Science, 2019, 17(4): 1006-1015.
[19] CHEN D S, MELLMAN I. Elements of cancer immunity and the cancer-immune set point[J]. Nature, 2017, 541(7637): 321-330.
[20] ZHANG B, WU Q, LI B, et al. m(6)A regulator-mediated methylation modification patterns and tumor microenvironment infiltration characterization in gastric cancer[J]. Molecular Cancer, 2020, 19(1): 53.
[21] STEPIEN M, JENAB M, FREISLING H, et al. Pre-diagnostic copper and zinc biomarkers and colorectal cancer risk in the European Prospective Investigation into Cancer and Nutrition cohort[J]. Carcinogenesis, 2017, 38(7): 699-707.
[22] CAO J, DONG R, JIANG L, et al. LncRNA-MM2 Pidentified as a modulator of macrophage M2 polarization[J]. Cancer Immunology Research, 2019, 7(2): 292-305.
[23] BURR M L, SPARBIER C E, CHAN Y C, et al. CMTM6 maintains the expression of PD-L1 and regulates anti-tumour immunity[J]. Nature, 2017, 549(7670): 101-105.
[24] BAAS P, SCHERPEREEL A, NOWAK A K, et al. First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743): a multicentre, randomised, open-label, phase 3 trial[J]. Lancet, 2021, 397(10272): 375-386.
[25] CHAN T A, YARCHOAN M, JAFFEE E, et al. Development of tumor mutation burden as an immunotherapy biomarker: utility for the oncology clinic[J]. Annals of Oncology, 2019, 30(1): 44-56.
[26] JANG B S, HAN W, KIM I A. Tumor mutation burden, immune checkpoint crosstalk and radiosensitivity in single-cell RNA sequencing data of breast cancer[J]. Radiotherapy and Oncology, 2020, 142: 202-209.
[27] LIU Y Q, CHENG L, HUANG W, et al. Genome instability-related miRNAs predict survival, immune landscape, and immunotherapy responses in gastric cancer[J]. Journal of Immunology Research, 2021, 2021: 2048833.
[28] RIZVI N A, HELLMANN M D, SNYDER A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer[J]. Science, 2015, 348(6230): 124-128.
[29] ADRIAENS C, STANDAERT L, BARRA J, et al. p53 induces formation of NEAT1 lncRNA-containing paraspeckles that modulate replication stress response and chemosensitivity[J]. Nature Medicine, 2016, 22(8): 861-868.
[30] ZHENG L, CHEN J T, ZHOU Z Y, et al. Knockdown of long non-coding RNA HOXD-AS1 inhibits gastric cancer cell growth via inactivating the JAK2/STAT3 pathway[J]. Tumor Biology, 2017, 39(5): 1010428317705335.
[31] ZHANG Y, LI L Y, TU Y, et al. A DCS-related lncRNA signature predicts the prognosis and chemotherapeutic response of patients with gastric cancer[J]. Bioscience Reports, 2022, 42(9): 1-17.
