乌苏酸对人胰腺癌细胞PANC-1 增殖和凋亡的影响
2024-01-26金俊华赵承伟郑桂茹
金俊华,赵承伟,付 佳,郑桂茹△
(1. 浙江省金华市人民医院药剂科,浙江金华 321000; 2. 温州医科大学药学院<诸暨>生物医药研究院,浙江诸暨 311800)
胰腺癌(PC)为恶性程度极高的肿瘤疾病,病情进展快,预后极差,5年生存率低于6%[1-2]。近年来,我国PC 总体发病率和死亡率均呈增长趋势。有Ⅲ期临床试验报道,厄洛替尼联合吉西他滨(GEM)较GEM 单药治疗的生存获益显著,患者的总生存期(OS)和无进展生存期(PFS)均得到一定延长[3],但获益时间有限,且伴随强烈的药品不良反应。乌苏酸(UA)又称熊果酸,属乌苏烷型三萜类化合物,在植物中分布广泛[4]。有研究表明,UA 主要从诱导肿瘤细胞凋亡[5]、自噬[6],抑制肿瘤细胞转移[7]、炎性反应[8]、上皮-间充质转化[9]、肿瘤血管生成[10],逆转放射治疗和化学药物治疗(简称放化疗)药物的耐药性[11],阻滞细胞周期[12],调节免疫功能[13]等方面发挥抗肿瘤作用,但是对PC 的作用并不明确。磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)是细胞内重要的生存信号通路,其激活与肿瘤细胞的增殖、分化、凋亡、化疗耐药性及血管生成密切相关[14]。抑制该通路的激活可阻止肿瘤细胞的生长、增殖,促进凋亡[15]。本研究旨在探讨UA对人胰腺癌细胞PANC-1活性、迁移、增殖、凋亡等的影响,并研究PI3K/Akt/mTOR 信号通路在PC发生、发展中的作用,为开发PC治疗新药提供思路。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:MIKRO 200R/ 220R 型台式离心机(德国Hettich 公司);CKX41 型倒置显微镜(日本Olympus 公司);INCO108-246型二氧化碳细胞培养箱(德国Memmert 公司);Synergy 超纯水系统(美国Millipore 公司);1600 型凝胶成像系统(上海天能科技有限公司);IC1000 型细胞计数仪(上海睿钰生物科技有限公司);Synergy H1 型多功能酶标仪(美国BioTek 公司);DK -S22 型电热恒温水浴锅(上海精宏实验设备有限公司);IMMULITE®2000 XPi 型免疫分析系统(西门子< 中国> 有限公司);KQ3200E 型超声波清洗器(昆山舒美超声仪器有限公司);AL104型电子分析天平(瑞士Mettler Toledo公司);GL-802A型台式小型真空泵(海门市其林贝尔仪器制造有限公司)。
试药:UA(CAS:77 - 52 - 1,含量> 99%),二甲基亚砜(DMSO,CAS:67 - 68 - 5,含量> 99.9%),均购自西格玛奥德里奇(上海)贸易有限公司;GEM(美国Med-ChemExpress 公司,批号为HY-17026);DMEM 培养基(美国Sigma公司,批号为D6429);1%青霉素-链霉素-谷氨酰胺、胎牛血清(美国Gibco 公司,批号分别为10378016,10099141C);PI3K,磷酸化蛋白激酶B(p -Akt),Akt,磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR),mTOR,β - Actin、活化半胱氨酸蛋白酶3(Cleaved Caspase-3),B 淋巴细胞瘤-2(Bcl-2),Bcl-2 关联X 蛋白(Bax)一抗(美国Cell Signalling Technology 公司,批号分别为#4249,#4060,#5536,#9272,#2972,#3700,#9661,#4223,#2772);辣根过氧化物酶标记的山羊抗兔二抗(生工生物工程< 上海> 股份有限公司,批号为D110058)。
细胞:人胰腺癌细胞株PANC-1(中国科学院上海细胞库)。
1.2 方法
细胞培养:细胞培养于含10%胎牛血清和1%青霉素- 链霉素双抗的DMEM 培养基(以下简称培养基)中,置37 ℃及饱和湿度,5%CO2的条件下培养,待细胞贴壁生长2~3 d后釆用胰蛋白酶消化。
细胞活性:采用四氮唑盐(MTT)法。取细胞,置96孔板中孵育(细胞密度3×103个/孔)。分别加入不同浓度的UA(1.25,2.5,5.0,10.0,25.0,50.0µmol/L)和GEM(0.16,0.31,0.63,1.25,2.5,5.0,10.0,20.0µmol / L);对照细胞加入等体积的DMSO。设6 个复孔。培养24,48,72 h后加入5 mg/mL MTT溶液20µL,继续培养4 h,吸去上清液,各组加入DMSO 150 µL,振荡2 min 至晶体完全溶解。在570 nm 波长处检测吸光度值(OD)。细胞存活率(%)=OD实验细胞/OD对照细胞×100%。
细胞形态:取对数生长期的细胞,制成细胞密度为2 × 105个/mL 的混悬液,取1 mL 于12 孔板中,实验设对照1 组(等体积DMSO),UA 低、中、高剂量组(5,10,20 µmol/L),各组细胞相应培养24 h 后,电子显微镜下观察细胞形态学变化,并拍照记录。
细胞增殖:采用集落形成实验。取细胞,接种于6孔板中(细胞密度为1×103个/孔)。实验分组同“细胞形态”项,各组细胞予相应处理,设置3个复孔。培养5 d后显微镜下观察直径大于0.5 mm的细胞集落数。
细胞迁移:采用细胞划痕实验。实验设对照2组(等体积DMSO)和UA 组(10µmol/L)。取细胞,接种于6孔板中(细胞密度为5×105个/孔),待生长至80%汇合度时除去培养基,用20µL 移液枪头末端刮擦产生划痕,加入培养基,各组细胞予相应处理,分别培养48 h和72 h后,显微镜下观察细胞的迁移情况。
蛋白表达水平:采用Western blot 法。实验分组同“细胞形态”项,各组细胞予相应处理48 h,用胰蛋白酶消化并离心,加入细胞裂解缓冲液,冰上裂解细胞。4 ℃、12 000 r/min 离心20 min,取上清液。用BCA 法测定蛋白质含量,加入等体积2 × loading 缓冲液,混合并煮沸10 min使蛋白质变性,凝胶电泳后转膜,封闭2 h,加入PI3K,p - Akt,Akt,p - mTOR,mTOR,Cleaved Caspase-3,Bcl-2,Bax,β-actin抗体(1∶1 000,V/V)4 ℃下过夜。以羊抗兔二抗(1∶5 000,V/V)室温振摇1 h,洗膜3 次,置凝胶成像仪扫描成像,使用Image J 软件分析条带,以β-actin 条带平均光密度为参考,计算目的蛋白的相对表达量。
分子对接模拟:从蛋白数据库下载目标蛋白PI3K(PDB ID:3APD[16])和Akt 2(PDB ID:3E8D[17])用薛定谔分子对接软件(2018 版)预处理蛋白,生成对接盒子,使用UA 结构进行模拟对接,查看评分结果,对接结果图以PyMOL软件导出或Ligand interaction键生成。
1.3 统计学处理
采用GraphPad Prism 10.0统计学软件分析。计量资料以±s表示,行t检验。P<0.05为差异有统计学意义。
2 结果
2.1 细胞活性
GEM 和UA 对细胞活性的影响见图1(因GEM 疗效确切,故未进行48 h 及72 h 实验)。可见,随着UA 药物浓度的升高,细胞活性逐渐减弱,且有剂量依赖性。在24 h 时,UA 的IC50为7.89 µmol / L,显示出与上市药物GEM(IC50= 2.20 µmol / L)相同数量级的肿瘤细胞活性抑制效果。UA 在48 h 和72 h 时的IC50分别为6.26µmol/L和5.06µmol/L。
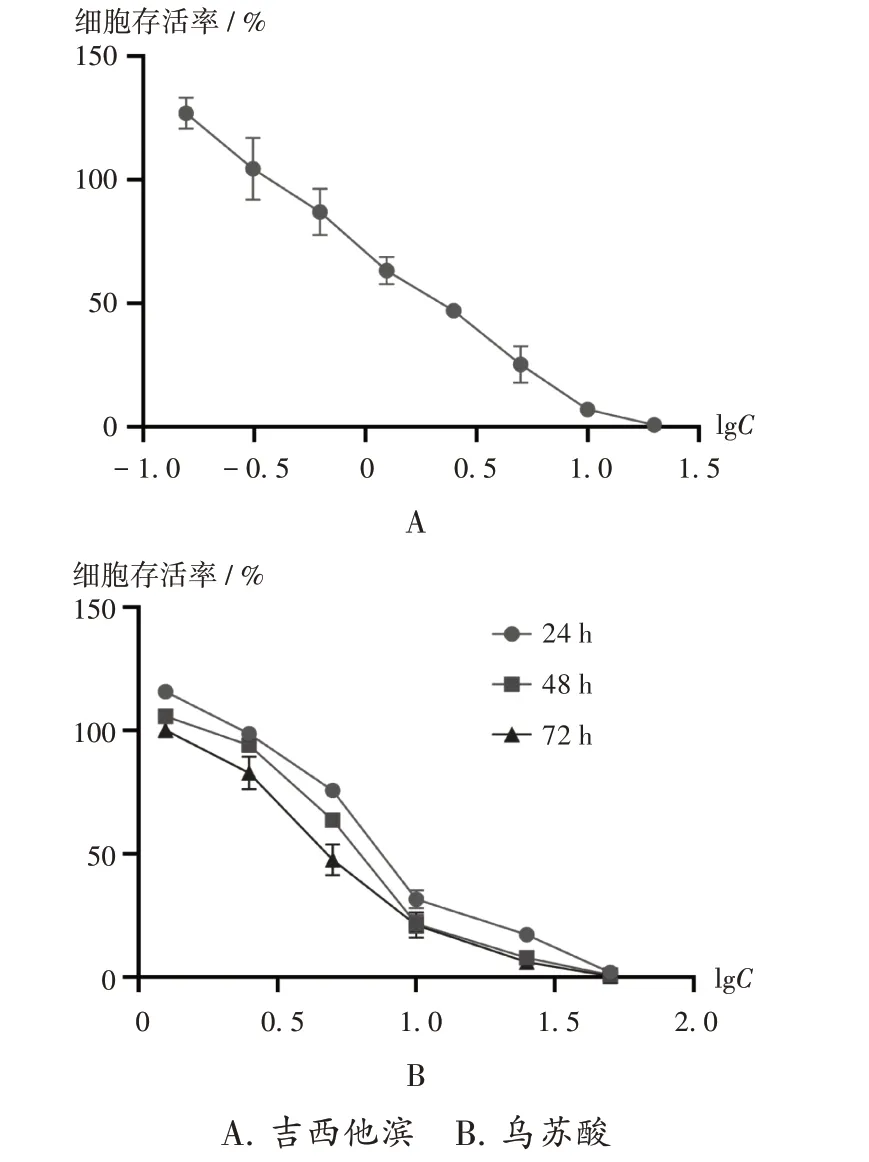
图1 细胞活性A.Gemcitabine B.Ursolic acidFig.1 Cell viability
2.2 细胞形态
对照1 组细胞形态正常,贴壁,呈不规则梭形或圆形,细胞生长状态较好。UA 各剂量组细胞随着浓度的增加,逐渐失去原有形态,变形细胞数量随之增加,细胞边界模糊不清,贴壁细胞数量变少,部分细胞悬浮于培养基中,细胞显示出较差的生长特点。详见图2。

图2 细胞形态Fig.2 Cell morphology
2.3 细胞增殖
与对照1 组比较,UA 各剂量组细胞数量均显著减少(P<0.05),且呈一定的浓度依赖性。详见图3。
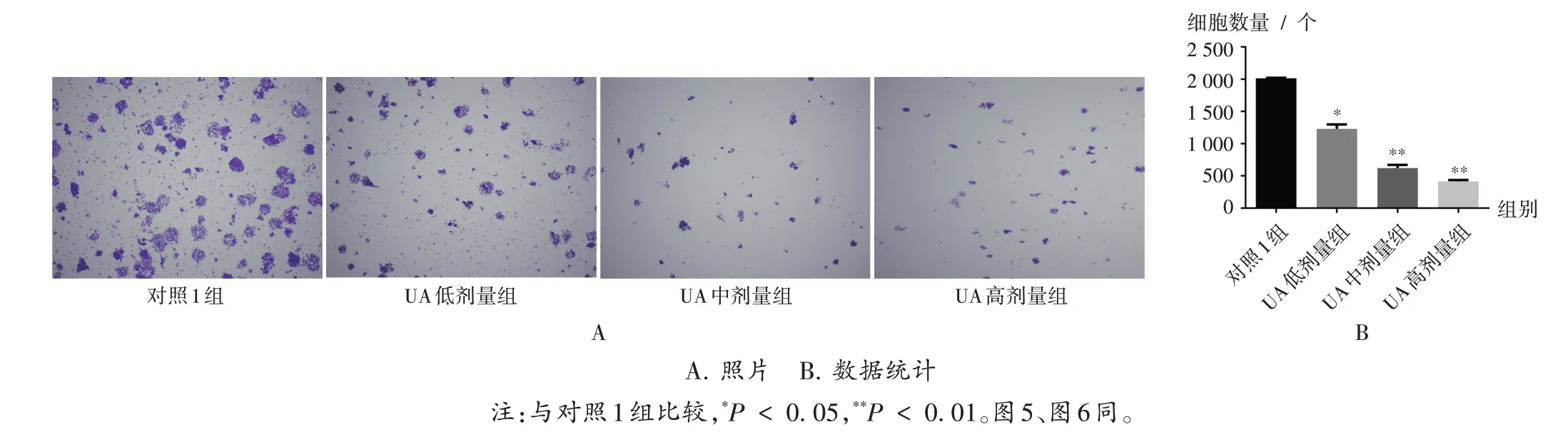
图3 细胞增殖能力A.Photos B.Data statisticsNote:Compared with those in the control group one,*P < 0.05,**P <0.01(for Fig.3 and Fig.5 - 6).Fig.3 Cell proliferation
2.4 细胞迁移
与对照2 组比较,UA 组细胞48 h 和72 h 的迁移距离缩短。详见图4。

图4 细胞迁移情况Fig.4 Cell migration
2.5 相关蛋白表达水平
与对照1组比较,UA各剂量组细胞Cleaved Caspase-3及Bax 的表达水平均显著升高(P<0.05);UA 中、高剂量组细胞Bcl - 2 表达水平均显著降低(P< 0.05);UA高剂量组细胞PI3K 表达水平,UA 中、高剂量组细胞p-Akt 表达水平,UA 各剂量组细胞p-mTOR 表达水平均显著降低(P<0.05)。详见图5、图6。
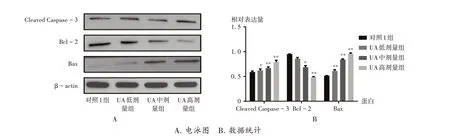
图5 细胞中凋亡相关蛋白表达水平A.Electropherograms B.Data statisticsFig.5 Expression levels of apoptosis - related proteins in cells

图6 细胞中PI3K/Akt/mTOR信号通路相关蛋白表达水平A1,A2.Electropherograms B.Data statisticsFig.6 Expression levels of PI3K / Akt / mTOR signaling pathway - related proteins in cells
2.6 分子对接
结果见图7。可见,UA 中的乌苏烷型三萜类结构可进入PI3K 与Akt2中三磷酸腺苷(ATP)结合位点竞争性结合疏水口袋,从而影响PI3K,Akt2 蛋白与ATP 的结合,抑制其激活。其中UA 结构中的羧酸部分,可与PI3K蛋白中的Lys890,Thr887 产生氢键相互作用。UA 中的羟基部分也可与Akt2中的Asp293产生氢键相互作用。
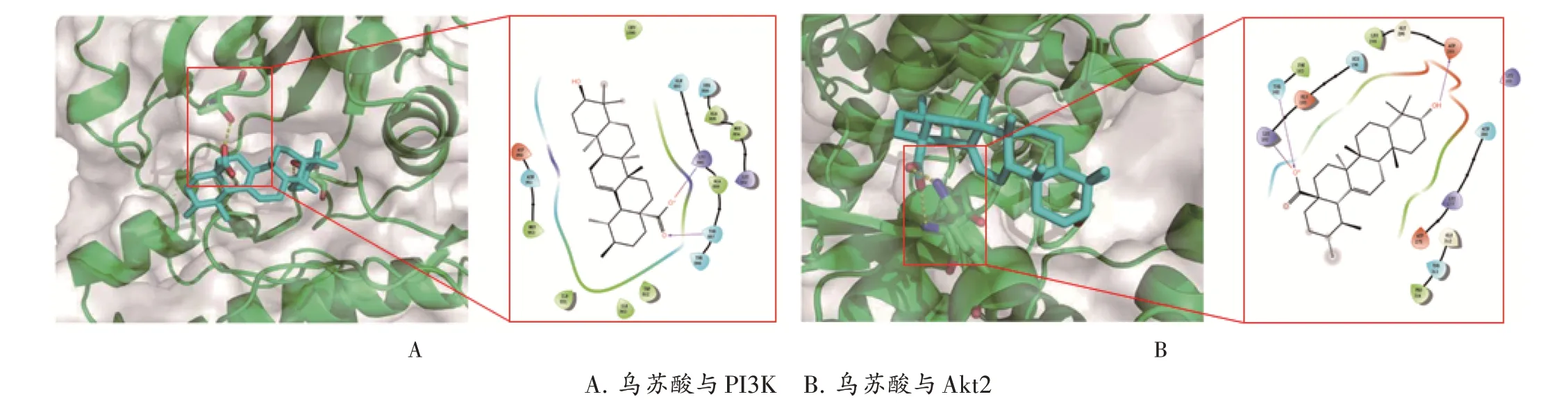
图7 分子对接结果A.Ursolic acid and PI3K B.Ursolic acid and Akt2Fig.7 Results of molecular docking
3 讨论
PC 的发病率与死亡率相近,仅20%的患者可通过手术切除获得长期生存[18]。PC 相较于其他实体肿瘤具有解剖结构特殊、富间质、高度异质性、细胞恶性潜能大及肿瘤代谢模式异常等特点。临床治疗PC 的主要手段是手术切除,但切除后仍有复发的可能。非手术疗法有放疗、化疗、靶向药物治疗及传统中医药辅助治疗[19-20]。免疫疗法、内分泌疗法作为新兴的治疗手段[21],其疗效并不确定。故临床迫切需要开发新型PC治疗药物和方法来提升PC 的治疗效果。中医药作为肿瘤辅助联合治疗的重要组成部分,有其独特的治疗优势。UA 由于抗瘤谱广,对正常细胞毒性低,同时具有免疫增强功能,其抗肿瘤作用日益受到关注[22]。本研究结果显示,极低浓度GEM 和UA 有可能促进细胞增殖;UA具有抑制PANC- 1 细胞活性的效果,且在DMEM 培养基中培养24 h 的IC50与GEM 处在同一个数量级;且UA可影响PANC-1细胞形态,诱导其凋亡,抑制增殖。
PI3K/ Akt/ mTOR 信号通路的作用机制包括细胞受生长因子等的刺激后,PI3K 激活并聚集到细胞膜上,将其底物3,4 - 二磷酸磷脂酰肌醇(PIP2)转化为3,4,5 - 二磷酸磷脂酰肌醇(PIP3),PIP3 再激活其下游的Akt 蛋白等。PIP3 通过与Akt 的PH 结构域相互作用,聚集Akt 到细胞膜上,并通过3-磷脂酰肌醇依赖性蛋白激酶1(PDK-1)将其Thr308 和羧基端的Ser473 位点同时磷酸化,激活后的p-Akt蛋白再转移,通过直接或间接途径激活下游的mTOR,调节蛋白质合成,基因转录等,从而达到对细胞生存和凋亡的调控[23]。随着研究的不断深入,PI3K/Akt/mTOR 信号通路所涉及的多种下游信号分子在许多常见肿瘤的发生、发展过程中的重要角色也日益凸显,针对该信号通路的关键分子靶点的肿瘤治疗策略令人期待[24]。本研究结果显示,UA 能降低PANC - 1 细胞中PI3K,p - Akt,p - mTOR 的蛋白表达水平,抑制PI3K/Akt/mTOR 信号通路的激活影响肿瘤功能,以及上调凋亡相关蛋白Cleaved Caspase-3和Bax,下调Bcl-2诱导PANC-1细胞的凋亡。分子对接结果发现,UA中的乌苏烷型三萜类结构可与PI3K和Akt2蛋白相互作用,从而影响蛋白质功能,抑制其激活。
综上所述,UA 作为多靶点抗肿瘤天然产物,在体外能显著抑制PANC-1细胞的增殖,诱导细胞凋亡,抑制细胞迁移,其机制可能与抑制PI3K/Akt/mTOR 信号通路的激活和影响凋亡相关蛋白Cleaved Caspase - 3,Bax,Bcl-2表达相关。
