不同配伍比例大黄-丹参有效成分溶出率及抗模型大鼠肾纤维化作用比较*
2024-01-26徐子寒高俪原
孟 颖,徐子寒,高俪原,韩 怡
(江苏省张家港市中医医院,江苏张家港 215600)
慢性肾脏病(CKD)是全球性公共卫生问题[1],目前全球有6.98 亿病例,中国患者达1.323 亿[2]。肾纤维化是CKD 的标志,也是肾功能进行性改变和不可逆转的重要原因[3]。相较于西药,传统中医药对CKD 具有独特的治疗优势。大黄为泻下良药,具有逐瘀破结功效;丹参为活血化瘀良药;两药配伍,为中医临床治疗CKD 的高频使用药对[4-5]。近年来,含大黄-丹参药对的中成药如肾康注射液(大黄- 丹参,1∶1)[6]和肾衰宁胶囊(大黄-丹参,1∶1.75)[7],临床经验方如抗纤灵冲剂(上海中医药大学附属曙光医院,大黄-丹参,1∶1.25)[8],固本泄浊饮(张家港市中医医院,大黄- 丹参,1∶2)[9]等广泛用于临床,疗效均较好。已有研究多集中于大黄、丹参单味药材或其单体成分治疗CKD 肾纤维化[10-12],药对也仅限于1∶1 配伍[13-14],两药不同配伍比例下的有效成分及疗效未见研究。为此,本研究中探讨了不同配伍比例大黄-丹参对有效成分溶出率及抗模型大鼠肾纤维化的作用。现报道如下。
1 仪器、试药与动物
1.1 仪器
e2695 型高效液相色谱仪,包括PDA2998 型检测器(美国Waters 公司);MS105 型电子天平(瑞士Mettler Toledo 公司),7170A 型全自动生化分析仪(日本Hitachi公司),精度均为0.01 mg;SCQ - 250 型超声波清洗器(上海声彦超声波仪器有限公司);ST16R型低温离心机(美国Thermo Fisher公司)。
1.2 试药
芦荟大黄素对照品(批号为PRF9022841,含量97.72%),大黄酸对照品(批号为PRF9083142,含量98.36%),大黄素对照品(批号为PRF8070501,含量99.44%),大黄酚对照品(批号为PRF8022726,含量99.67%),大黄素甲醚对照品(批号为PRF9031428,含量97.24%),均购于成都普瑞法科技开发有限公司;丹参酮ⅡA对照品(批号为MUST - 20121710,含量99.56%),丹酚酸B 对照品(批号为MUST - 21030110,含量98.60%),均购于成都曼斯特生物科技有限公司;磷酸、甲醇均为分析纯,水为娃哈哈纯净水。大黄饮片(批号为210527010),丹参饮片(批号为210710010),均购于苏州天灵中药饮片有限公司,经张家港市中医医院余辉主任中药师鉴定为正品。
1.3 动物
SPF级SD大鼠35只,雄性,7周龄,体质量(180±10)g,购于北京维通利华实验动物技术有限公司,实验动物使用许可证号SYXK(京)2022-0025。饲养于南京中医药大学实验动物中心,室温(23±2)℃,相对湿度(60±5)%,12 h 明暗交替,实验期间大鼠自由进食饮水。本实验经我院实验动物伦理委员会批准(批件号:2020 伦申第1040号)。
2 方法与结果
2.1 有效成分溶出率研究
2.1.1 色谱条件
色谱柱:ThermoHypersilBDSC18柱(250mm×4.6mm,5 µm);流动相:乙腈(A)- 0.1%磷酸(B),梯度洗脱(0~5 min时5%A,5~15 min时5%A →30%A,15~25 min时60%A,25~35 min 时60%A →75%A,35~45 min 时75%A,45~65 min时75%A →5%A);流速:1.0 mL/min;检测波长:254 nm;柱温:35 ℃;进样量:10µL。
2.1.2 溶液制备
大黄混合对照品溶液:称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品各适量,精密称定,分别置5 mL容量瓶中,加甲醇溶解并定容,制成单一对照品溶液①- ⑤(质量浓度分别为0.996 7,0.946 2,0.938 7,1.521 0,0.958 8 mg / mL)。分别精密吸取740,740,660,1 400,660µL,置同一10 mL容量瓶中,加甲醇稀释并定容,制成混合对照品溶液Ⅰ(质量浓度分别为73.756,70.019,61.954,212.940,63.281µg/mL)。
丹参混合对照品溶液:称取丹酚酸B、丹参酮ⅡA对照品各适量,精密称定,分别置5 mL 容量瓶中,加甲醇溶解并定容,制成单一对照品溶液⑥和⑦(质量浓度分别为1.312 2 mg/ mL 和1.366 6 mg/ mL)。分别精密吸取1 800µL 和940µL,置同一10 mL 容量瓶中,加甲醇稀释并定容,制成混合对照品溶液Ⅱ(质量浓度分别为236.196µg/mL和128.460µg/mL)。
大黄、丹参单提液:分别取大黄饮片、丹参饮片样品各适量,置陶瓷煲中,加水300 mL,武火煮沸后转文火继续煎煮30 min,滤过,除去药渣,药液浓缩并定容至100 mL,精密吸取药液25 mL,置具塞锥形瓶中,精密加入甲醇25 mL,30 ℃下超声(功率200 W,频率45 kHz)提取10 min,冷却至室温,取上清液,经0.45µm 微孔滤膜滤过,取续滤液,即得。
不同配伍比例大黄- 丹参混提液(供试品溶液):按大黄-丹参配伍比例1∶1、1∶1.25、1∶1.75、1∶2、1∶3、1∶4 分别称取大黄饮片样品粉末3.0 g(6 份)及丹参饮片样品粉末3.0,3.75,5.25,6.0,9.0,12.0 g,精密称定,分别提取并配伍制备,得供试品溶液①-⑥;按相同配伍比例分别称取丹参饮片样品粉末15.0 g(6份)及大黄饮片样品粉末15.0,12.0,8.57,7.5,5.0,3.75 g,精密称定,分别提取并配伍制备,即得供试品溶液⑦-○12。
2.1.3 方法学考察
系统适用性试验:取上述对照品溶液、供试品溶液各适量,按2.1.1项下色谱条件进样测定,记录色谱图。结果,理论板数按丹酚酸B 峰计应不低于3 000;分离度均大于1.5,基线分离良好。详见图1。
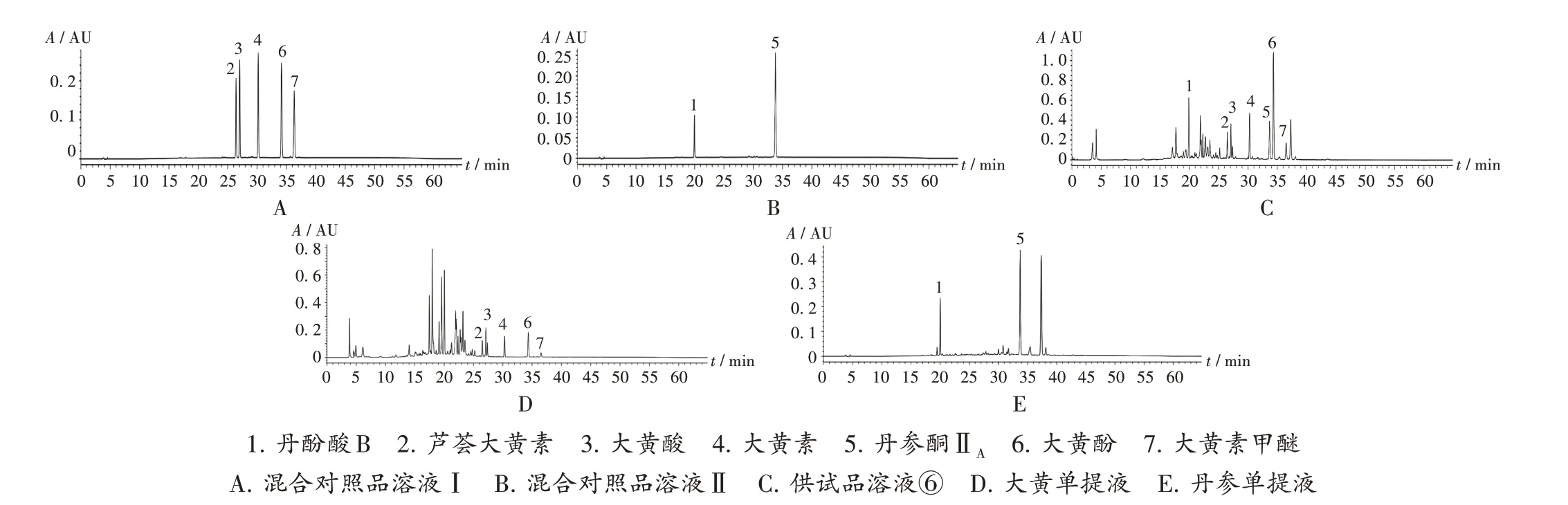
图1 高效液相色谱图1.Salvianolic acid B 2.Aloe - emodin 3.Rhein 4.Emodin 5.Tanshinone ⅡA 6.Chrysophanol 7.PhyscionA.Mixed reference solution Ⅰ B.Mixed reference solution Ⅱ C.Test solution ⑥ D.Extract of Rhei Radix et Rhizoma E.Extract of Salviae Miltiorrhizae Radix et RhizomaFig.1 HPLC chromatograms
线性关系考察:分别精密量取2.1.2项下单一对照品溶液①-⑦0.1,0.2,0.5,1.0,1.5,2.0 mL,置10 mL容量瓶中,加甲醇定容,制成系列单一对照品溶液。精密量取10µL,按2.1.1项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(X,µg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程。结果见表1。
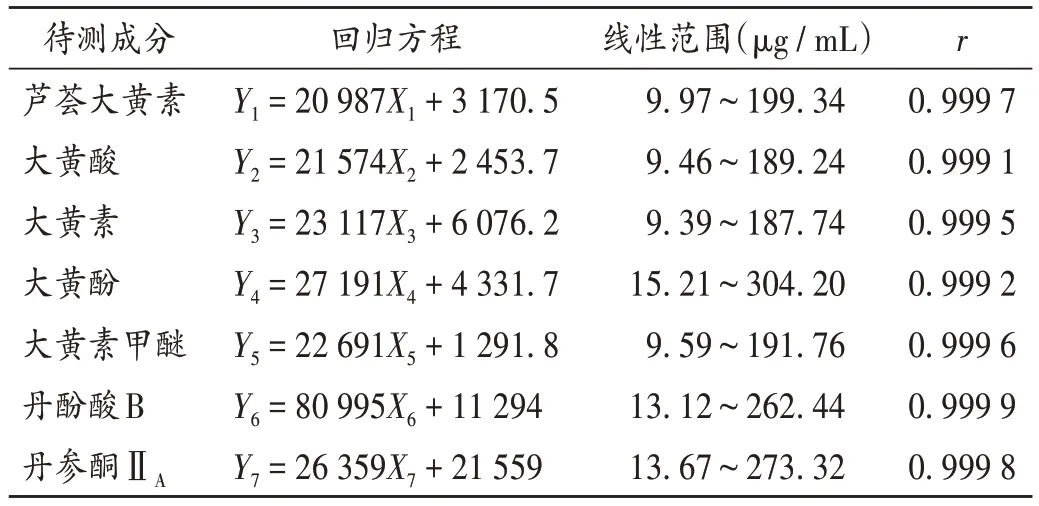
表1 线性关系考察结果Tab.1 Results of the linear relation test
精密度试验:取2.1.2项下混合对照品溶液Ⅰ和Ⅱ,按2.1.1 项下色谱条件连续进样测定6 次,记录峰面积。结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、丹酚酸B、丹参酮ⅡA峰面积的RSD分别为0.61%,0.58%,0.46%,0.42%,0.79%,0.52%,0.44%(n=6),表明仪器精密度良好。
稳定性试验:取供试品溶液⑥适量,分别于室温下放置0,2,4,8,16,24 h时按2.1.1项下色谱条件进样测定,记录峰面积。结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、丹酚酸B、丹参酮ⅡA峰面积的RSD分别为1.01%,1.23%,0.99%,1.16%,0.92%,1.01%,1.23%(n=6),表明供试品溶液在室温放置24 h内基本稳定。
重复性试验:称取饮片样品适量,精密称定,各6 份,按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定,记录峰面积,并计算含量。结果芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、丹酚酸B、丹参酮ⅡA峰面积的RSD分别为0.41%,0.39%,0.43%,0.35%,0.58%,0.38%,0.51%(n= 6),表明方法重复性良好。
加样回收试验:取已知含量的饮片样品适量,共6 份,分别加入一定质量浓度的混合对照品溶液Ⅰ和Ⅱ,按2.1.2 项下方法制备供试品溶液,按2.1.1 项下色谱条件进样测定,记录峰面积,并计算加样回收率。结果见表2。

表2 加样回收试验结果(n=9)Tab.2 Results of the recovery test(n=9)
2.1.4 样品含量测定
取饮片样品各适量,分别按2.1.2项下方法制备供试品溶液,按2.1.1项下色谱条件进样测定,平行测定3次,记录峰面积,计算样品含量及溶出率。结果见表3、图2。
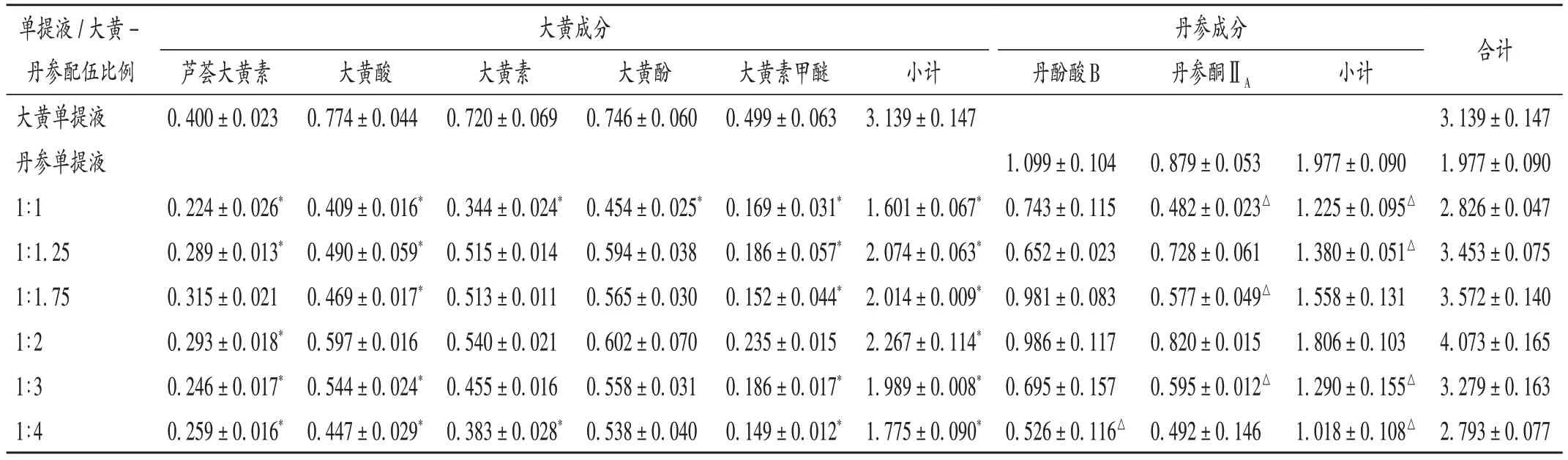
表3 不同配伍比例大黄-丹参药对中7个有效成分含量测定结果(mg/g,n=3)Tab.3 Results of content determination of seven active ingredients in Rhei Radix et Rhizoma - Salviae Miltiorrhizae Radix et Rhizoma drug pair with different compatibility proportions(mg/g,n=3)
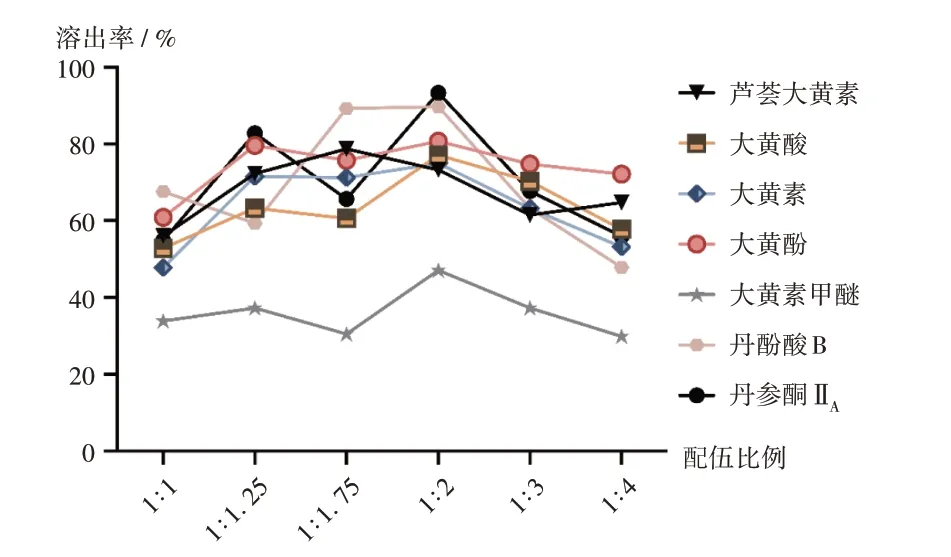
图2 不同配伍比例大黄-丹参药对中7种有效成分溶出率折线图Fig.2 Line graphs of dissolution rates of seven active ingredients in Rhei Radix et Rhizoma - Salviae Miltiorrhizae Radix et Rhizoma drug pair with different compatibility proportions
2.2 抗单侧输尿管梗阻(UUO)模型大鼠肾纤维化研究
建模、分组及给药:将35只大鼠随机分为假手术组(纯净水)、模型组(纯净水)、大黄组(大黄单提液)、丹参组(丹参单提液)、大黄-丹参(1∶1.25)组(1∶1.25 组)、大黄-丹参(1∶1.75)组(1∶1.75组)、大黄-丹参(1∶2)组(1∶2组)。大鼠禁食不禁饮12 h后,腹腔注射2.0%戊巴比妥钠(30 mg/kg)麻醉,左侧腹切口,暴露并分离左侧输尿管,在肾盂开口处和输尿管上1/3 处结扎,从2 个结扎点中间剪断左侧输尿管,逐层缝合,并注射青霉素,以复制UUO 大鼠模型。各组灌胃纯净水或相应剂量煎液,按普通成人(体质量以60 kg 计)10 g/d 的中药量计,大鼠剂量为1.042 g/ kg,每天1 次,持续2 周。假手术组大鼠仅腹腔游离左侧输尿管后缝合腹腔。
肾脏病理形态:取大鼠左侧肾组织,将制得标本置4%多聚甲醛固定液中,脱水、包埋、切片,Masson 染色,观察病理改变。结果表明,与假手术组比较,模型组肾间质蓝色区域显著增多,大量胶原纤维沉积,肾纤维化明显;与模型组比较,各给药组中胶原纤维沉积减少,肾脏纤维化程度降低,其中大黄组肾损伤改善作用更优。详见图3。
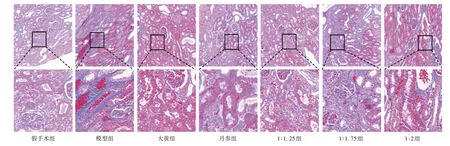
图3 大鼠肾脏病理形态(Masson,×400)Fig.3 Pathological morphology of kidney in rats(Masson,× 400)
肾脏生化指标:用全自动生化分析仪检测大鼠血尿素氮(BUN)、血清肌酐(SCr)、24 h 尿蛋白(24 h -UTP)水平。与假手术组比较,模型组大鼠BUN 和SCr水平显著升高(P< 0.05);与模型组比较,各给药组大鼠BUN,SCr,24 h-UTP 水平均显著下降(P<0.05)。但各给药组组间无显著差异(P>0.05),大黄组SCr 显著优于丹参组。详见表4。
表4 各组大鼠肾功能指标比较(±s,n=5)Tab.4 Comparison of renal function indexes in each group(±s,n=5)

表4 各组大鼠肾功能指标比较(±s,n=5)Tab.4 Comparison of renal function indexes in each group(±s,n=5)
注:与假手术组比较,*P < 0.05;与模型组比较,#P < 0.05;与大黄组比较,△P < 0.05。Note:Compared with those in the sham surgery group,*P < 0.05.Compared with those in the model group,#P < 0.05. Compared with those in the Rhei Radix et Rhizoma group,ΔP < 0.05.
24 h-UTP(mg)5.26±1.10 14.90±2.29*8.13±0.70#9.07±1.29#8.59±0.85#8.51±1.41#8.94±0.70#组别假手术组模型组大黄组丹参组1∶1.25组1∶1.75组1∶2组BUN(mmol/L)5.98±0.69 16.01±1.29*9.65±1.27#11.72±0.74#10.71±1.58#10.58±1.16#11.57±1.02#SCr(µmol/L)22.99±3.29 56.03±6.60*36.41±4.91#46.50±3.52#△42.50±4.59#43.44±4.82#44.41±4.65#
3 讨论
3.1 大黄-丹参药对现代药理学
大黄通腑泄浊,具有推陈致新、清泄浊毒之功效。现代药理学研究发现,大黄具有抗炎、抗菌、通便、抗癌等药理作用,大黄提取物具有改善肾损伤、抑制肾组织细胞凋亡和炎性因子释放等功效[15]。丹参活血化瘀,具有祛瘀生新、通行血脉之效。现代药理学研究发现,丹参提取物具有减轻肾脏炎性反应,修复肾损伤,改善肾功能等功效[16-17]。王宏等[14]发现,大黄- 丹参药对可减轻慢性肾衰竭模型大鼠肾间质炎性细胞浸润、纤维化程度和结肠上皮屏障结构损伤程度,从而有效保护模型大鼠肾功能。大黄- 丹参药对也可显著抑制UUO模型大鼠肾组织中miR - 21/PTEN/Akt 信号通路,从而发挥对肾纤维化的改善作用[13]。
3.2 大黄-丹参药对配伍比例选择
2020年版《中国药典(一部)》规定大黄的用量为3~15 g,丹参的用量为10~15 g;临床以大黄治疗肾病的常用剂量为6~30 g[18],丹参为10~37.3 g[19]。结合大黄丹参汤、抗纤灵冲剂、固本泄浊饮等含大黄-丹参药对的中药复方对肾脏疾病的临方遣药经验[20-22],本研究中选择了大黄-丹参药对临床使用较多的6 种配伍比例,研究大黄-丹参混提液中7个有效成分溶出率的变化规律。
3.3 不同配伍比例对大黄- 丹参药对中7 个主要有效成分溶出率的影响
从溶出率测定结果可知,大黄-丹参混提液中7个有效成分含量均低于大黄、丹参单提液;大黄中5 个游离蒽醌的溶出率随着与丹参配伍比例改变的变化规律不一致,当大黄-丹参配伍比例为1∶2时,5个游离蒽醌的总溶出率最高(72.22%);丹参中2 个有效成分总量随着丹参配伍比例的增大总体呈上升趋势,当大黄-丹参配伍比例为1∶2 时,丹酚酸B 和丹参酮ⅡA的总溶出率最高为91.35%;从7个有效成分总量来看,在大黄-丹参配伍比例为1∶2 时的溶出率最高(79.61%)。综合考虑,选取溶出率相对较高的大黄-丹参3种不同配伍比例(1∶1.25、1∶1.75、1∶2)及大黄、丹参单提液共5 组进行药效学最佳配伍比例研究。
3.4 不同配伍比例对UUO 模型大鼠肾纤维化的影响
由药效学实验结果可见,给药后大黄、丹参及其配伍均能显著提升模型大鼠的BUN,SCr,24 h - UTP 水平,大黄- 丹参配伍后在抗肾纤维化作用方面未产生协同作用,其中大黄单提液药效表现最佳,其余配伍比例无显著差异。病理学检测结果与药效一致,各给药组大鼠肾脏纤维化程度均明显降低,其中大黄单提液改善肾纤维化作用更优。
3.5 方法评价
所建立的含量测定方法可用于大黄-丹参药对中7 个主要有效成分的含量测定;大黄-丹参不同比例配伍后有效成分溶出率均小于单提液;大黄-丹参配伍后在抗肾纤维化作用方面未产生协同作用,大黄单提液抗肾纤维化作用最佳。
