强志组方调控PI3K/Akt/TNF-α信号通路干预抽动障碍的实验研究
2024-01-25詹婷姜韫赟王妹靳无菲李婷阎兆君
詹婷,姜韫赟,王妹,靳无菲,李婷,阎兆君
(1.山东中医药大学,山东 济南 250355;2.山东中医药大学附属医院,山东 济南 250014)
抽动障碍(tic disorder,TD)是一类常见于儿童与青少年的突然的、反复出现的、无节律的以运动或发声为主的神经精神障碍性疾病[1]。本病病情复杂,常伴注意力缺陷多动障碍、强迫障碍、睡眠障碍等,对患者的生活质量与身心健康造成不良影响。最新的全国精神病学流行病学调查结果显示,我国儿童及青少年抽动障碍的发病率为2.5%,且发病率呈上升趋势[2]。西医以药物治疗为主,但患者治疗后不良反应及复发率较高,远期预后较差[3],而中医药治疗具有不良反应小、无依赖性的优点,在临床运用广泛。阎兆君教授在研究中医文献和长期临床实践基础上,基于《黄帝内经》从志意辨证角度出发,提出TD患者病机为“肾志不足”,以益肾强志为主要治法,自拟强志组方治疗TD患儿。强志组方由制巴戟天、制远志、清半夏、山药、木香、茯神、生白术组成,具有强志定意、安魂助勇的功效[4]。Meta分析结果显示,强志组方治疗TD具有较好疗效[5]。网络药理学研究显示,强志组方主要作用在多巴胺系统、感染、炎症反应以及miRNA通路,PI3K/Akt、雌激素、肿瘤坏死因子信号通路三个重要途径参与强志组方对TD的治疗[6]。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/肿瘤坏死因子(TNF-α)信号通路与TD的关联已在实验中得到验证[7]。课题组前期研究发现,强志组方通过作用于大鼠DA、NE系统,能明显缓解大鼠的抽动症状与刻板行为[8-9]。为进一步研究强志组方治疗TD的作用机制,本研究以PI3K/Akt/TNF-α信号通路为出发点,探究TD的发病机制,进一步研究强志组方通过PI3K/Akt/TNF-α信号对TD模型大鼠的影响,为强志组方的临床运用提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠 42只(北京维通利华实验动物有限公司),3~8周龄,体质量(200±20)g,实验动物使用许可证号:SCXK(京)2021-0011。饲养于山东中医药大学动物实验中心SPF级动物房,温度(23±2)℃,湿度(55±5)%,12 h光照/黑暗循环(08:00~20:00),自由进食饮水,适应性饲养1周后开始实验。本实验经山东中医药大学动物实验伦理审查委员会批准(伦理批号:SDUTCM20220224001)。
1.2 药物
强志组方组成:制巴戟天9 g,制远志9 g,清半夏9 g,山药24 g,木香6 g,茯神24 g,生白术18 g;饮片由亳州市沪谯药业有限公司提供。使用纯水浸泡饮片30 min后置于砂锅内,加入药材5倍量的水,煎煮2次,每次30 min。将2次药液混合,制备成含生药量为1 g/mL的药液,保存于4 ℃冰箱备用。盐酸硫必利片(江苏恩华药业股份有限公司,批号:LY210105),药物研磨成粉后,制备成0.1 mg/mL的硫必利混悬液。亚氨基二丙腈(iminodipropionitrile,IDPN)(美国Sigma公司,批号:317306),将IDPN溶液稀释至30 mg/mL备用。
1.3 主要试剂与仪器
BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,货号:P0010S);RIPA组织/细胞裂解液、脱脂奶粉(北京索莱宝科技有限公司,货号:R0020、D8340);磷酸酶抑制剂(美国APEXBIO公司,货号:K1015);PVDF 膜(德国 Millipore公司,货号:IPVH00005);PI3K、Akt、p-Akt、TNF-α兔单克隆抗体(英国Abcam公司,货号:ab191606、ab179463、ab192623、ab205587);GAPDH 兔多克隆抗体(武汉三鹰生物技术有限公司,货号:10494-1-AP);辣根酶标记山羊抗兔IgG抗体(北京中衫金桥有限公司,货号:ZB2301);ECL超灵敏化学发光检测试剂盒(上海雅酶生物医药科技有限公司,货号:SQ202);多色荧光成像系统(美国GE公司,型号:GE Amersham Imager600);总RNA提取试剂(Biosharp生物公司,货号:BS259A);快速逆转录试剂盒(上海奕衫生物科技有限公司,货号:RT001);SYBR Green Fast qPCR Mix(ABclonal生物科技有限公司,货号:RX21203);PI3K、Akt、TNF-α引物(上海生工生物工程股份有限公司,货号:2413357427、2413357429、2413357431);TNFα、IL-6酶联免疫吸附测定试剂盒(上海江莱生物科技有限公司,货号:JL13202、JL20884);SuperMaze动物行为分析系统(上海欣软有限公司,型号:XR-Xmaze);紫外分光光度计(美国Thermo Scientific公司,型号:NANODROP 2000);PCR仪(美国BIO-RAD公司,型号:T100);全波长酶标仪(美国BioTek公司,型号:BioTek Cytation5)。
2 方法
2.1 动物模型复制及评价
采用随机数字表法将大鼠分为空白组(7只)与造模组(35只)。除空白组外,其余大鼠依据文献[10]的方法腹腔注射IDPN 300 mg/(kg·d)制备模型,连续7 d。根据文献[11-12]中对造模组大鼠进行刻板行为与运动行为进行评分,评分 ≥ 2分时,说明大鼠造模成功。
2.2 动物分组与给药
造模成功后的大鼠随机分为模型组、硫必利组和强志组方低、中、高剂量组,每组7只。按照人鼠等效剂量换算[13],强志组方低、中、高剂量组分别按照4.455、8.91、17.82 g/(kg·d)剂量灌胃强志组方水煎液,硫必利组给予0.027 g/(kg·d)硫必利混悬液,空白组与模型组大鼠给予等剂量生理盐水,连续干预28 d。
2.3 行为学测试
2.3.1 运动行为评分
参考文献中[11]的评分方法,在造模前、造模后、灌胃28 d后对大鼠进行运动行为评分。先用75%乙醇清洁鼠笼,将大鼠放入鼠笼内适应10 min。采用双盲法,由两名不知道动物分组信息的实验人员观察20 min,并记录评分,最终结果取两名实验人员评分的平均值。0分:安静或正常活动;1分:过度兴奋表现;2分:探索行为增加,不连续吸鼻;3分:不停跑动;4分:不停跑动伴惊跳。
2.3.2 刻板行为评分
根据Diamond等[12]的方法,在造模前、造模后、灌胃28 d后对大鼠进行刻板行为评分。先用75%乙醇清洁鼠笼,将大鼠放入清洁干燥的鼠笼里适应10 min,采用双盲法,由两名不知道动物分组信息的实验人员观察20 min,并记录评分,最终结果取两名实验人员评分的平均值。0 分:无刻板行为;1 分:旋转行为;2 分:头和颈部过多垂直运动;3 分:头、颈部的垂直运动和旋转行为;4 分:头部侧摆合并头颈部的垂直运动过多。
2.4 标本采集
末次给药后,大鼠禁食不禁水8 h,采用2%戊巴比妥钠,2 mL/kg腹腔注射麻醉大鼠。大鼠腹主动脉取血4 mL,静置后离心备用。将大鼠断头,冰盒上剥离双侧纹状体组织,急投液氮,取材完成后放入-80 ℃冰箱保存用于后续检测。
2.5 Western blot检测大鼠纹状体PI3K、Akt、TNF-α蛋白表达水平
将纹状体组织称重后加入组织裂解液、PMSF、磷酸酶抑制剂,放入钢珠后研磨提取蛋白。BCA法检测蛋白浓度,根据浓度,加入5×loading buffer与PBS,金属浴95 ℃加热5 min使其变性后备用。采用制胶试剂盒制胶后,准备电泳,依次上样各组蛋白样本与Marker。电泳结束后采用湿转法转膜,5%脱脂奶粉室温封闭2 h,TBST冲洗后裁膜放入一抗PI3K、Akt、p-Akt、TNF-α、GAPDH(1∶1 000、1∶1 000、1∶1 000、1∶1 000、1∶5 000),4 ℃孵育过夜后。TBST冲洗3次,室温二抗摇床孵育1 h。TBST冲洗3次后,均匀滴加ECL显影液后进行显影,以全自动化学发光图像分析系统扫描。用ImageJ软件分析条带灰度值,以GAPDH为内参,目的蛋白灰度值比上内参灰度值即样本蛋白的相对表达量,磷酸化指标用磷酸化蛋白比上总蛋白计算该蛋白的表达是否改变。
2.6 qPCR检测大鼠纹状体PI3K、Akt、TNF-α mRNA表达水平
称取10~20 mg的纹状体组织置于研磨管,TRIZOL法提取RNA,Nanodrop检测其浓度,使用快速逆转录试剂盒配制反应体系,将RNA反转录为cDNA,引物由上海生工有限公司设计合成,见表1。按照说明书,设定程序进行于实时荧光定量PCR仪中进行扩增,反应程序如下:95 ℃预变性 3 min,1个循环;95 ℃ 5 s,45个循环;60 ℃ 30 s,45个循环。反应完成得到CT值,将GAPDH作为内参,采用2-ΔΔCT法计算出样本mRNA相对表达量。
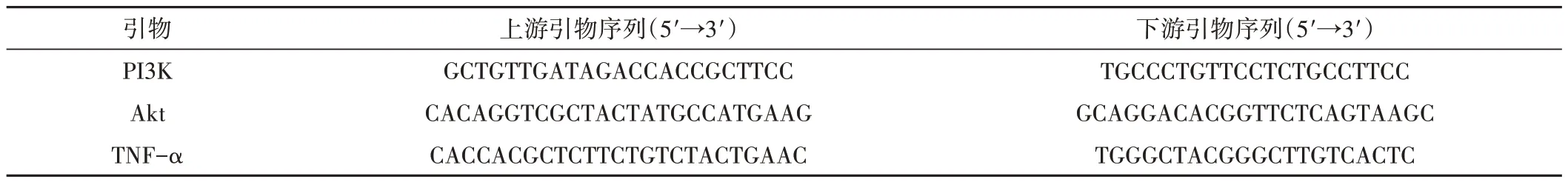
表1 PCR引物序列
ΔCT=目的基因CT值 - 内参基因CT值
ΔΔCT=实验组ΔCT值 - 对照组ΔCT
2.7 ELISA检测大鼠血清IL-6、TNF-α含量
使用酶联免疫吸附试验试剂盒测定。血液样本稀释5倍后待用,将标准品按照说明书进行梯度稀释,加样后,37 ℃恒温箱内孵育1 h后弃液。每孔加入抗体工作液,孵育1 h后弃液,洗板3次。每孔加入浓缩酶结合物,孵育1 h后弃液,洗板5次。加入底物,避光孵育1 h,加入终止液,在酶标仪450 nm处测得各孔OD值。
2.8 统计学方法
采用SPSS27.0软件对实验数据进行统计分析,计量资料以±s表示,两组间比较采用t检验,三个及以上独立样本均值差异采用F检验(单因素方差分析),结果P< 0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠行为学结果比较
3.1.1 运动行为评分比较
造模后,与空白组比较,造模组大鼠出现异常运动行为。药物干预28 d后,与模型组比较,硫必利组与强志组方各剂量组大鼠运动行为评分显著降低(P<0.001)。见表2。
表2 各组大鼠运动行为评分比较(±s,分)
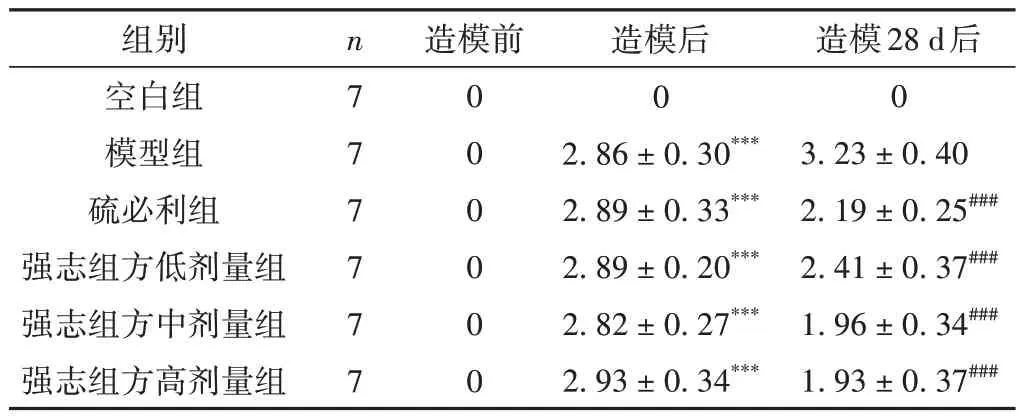
表2 各组大鼠运动行为评分比较(±s,分)
注:与空白组比较,***P < 0.001;与模型组比较,###P < 0.001。
组别空白组模型组硫必利组强志组方低剂量组强志组方中剂量组强志组方高剂量组造模28 d后0 3.23±0.40 2.19±0.25###2.41±0.37###1.96±0.34###1.93±0.37###n7 7 7 7 7 7造模前0 0 0 0 0 0造模后0 2.86±0.30***2.89±0.33***2.89±0.20***2.82±0.27***2.93±0.34***
3.1.2 刻板行为评分比较
造模前,各组大鼠未发现刻板行为。造模后,除空白组外其余各组大鼠均出现不同程度的刻板行为。药物干预28 d后,与模型组比较,硫必利组、强志组方各剂量组大鼠刻板行为评分降低(P< 0.05)。见表3。
表3 各组大鼠刻板行为评分比较(±s,分)
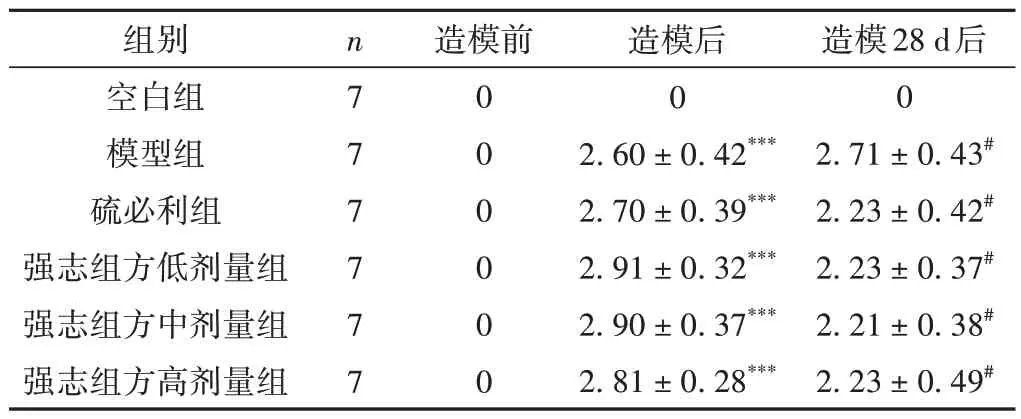
表3 各组大鼠刻板行为评分比较(±s,分)
注:与空白组比较,***P < 0.001;与模型组比较,#P < 0.05。
造模前造模28 d后0 2.71±0.43#2.23±0.42#2.23±0.37#2.21±0.38#2.23±0.49#组别空白组模型组硫必利组强志组方低剂量组强志组方中剂量组强志组方高剂量组n7 7 7 7 7 7 0 0 0 0 0 0造模后0 2.60±0.42***2.70±0.39***2.91±0.32***2.90±0.37***2.81±0.28***
3.2 各组大鼠纹状体PI3K、Akt、TNF-α蛋白表达水平比较
与空白组比较,模型组大鼠纹状体PI3K、TNF-α蛋白表达水平及p-Akt/Akt磷酸化水平升高(P<0.01,P< 0.001,P< 0.05)。与模型组比较,强志组方低剂量组的大鼠纹状体PI3K、TNF-α蛋白表达水平降低(P< 0.05),p-Akt/Akt磷酸化水平有降低趋势(P> 0.05);强志组方中、高剂量组大鼠纹状体PI3K、TNF-α蛋白及p-Akt/Akt磷酸化表达水平降低(P<0.001,P< 0.05),硫必利组纹状体蛋白表达水平无明显变化。见表4。
表4 各组大鼠纹状体PI3K、Akt、TNF-α蛋白表达比较(±s)
注:与空白组比较,*P < 0.05,**P < 0.01,***P < 0.001;与模型组比较,#P < 0.05,###P < 0.001。
TNF-α/GAPDH 0.72±0.08 1.06±0.07***0.92±0.17 0.84±0.09#0.87±0.06#0.87±0.08#组别空白组模型组硫必利组强志组方低剂量组强志组方中剂量组强志组方高剂量组n3 3 3 3 3 3 PI3K/GAPDH 0.94±0.18 1.29±0.13**1.14±0.09 1.03±0.09#0.85±0.11###0.77±0.21###p-Akt/Akt 0.78±0.10 1.07±0.06*0.96±0.26 0.94±0.11 0.70±0.11#0.79±0.20#
3.3 各组大鼠纹状体PI3K、Akt、TNF-α mRNA表达水平比较
与空白组比较,模型组纹状体PI3K、Akt、TNF-α mRNA表达水平升高(P< 0.001,P< 0.01,P< 0.05);与模型组比较,强志组方低剂量组纹状体PI3K、Akt、TNF-α mRNA表达水平降低(P< 0.05),强志组方中剂量组与高剂量组纹状体PI3K、Akt、TNF-α mRNA表达水平降低(P< 0.01,P< 0.05),硫必利组纹状体PI3K、Akt、TNF-α mRNA表达降低,但差异无统计学意义(P> 0.05)。见表5。
表5 各组大鼠纹状体PI3K、Akt、TNF-α mRNA表达水平比较(±s)

表5 各组大鼠纹状体PI3K、Akt、TNF-α mRNA表达水平比较(±s)
注:与空白组比较,*P < 0.05,**P < 0.01,***P < 0.001;与模型组比较,#P < 0.05,##P < 0.01。
TNF-α 1.00±0.10 1.18±0.11*1.16±0.12 0.98±0.09#0.96±0.03#0.97±0.06#组别空白组模型组硫必利组强志组方低剂量组强志组方中剂量组强志组方高剂量组n3 3 3 3 3 3 PI3K 0.45±0.02 1.05±0.12***0.96±0.06 0.88±0.06#0.84±0.08##0.86±0.02##Akt 1.00±0.04 1.26±0.13**1.17±0.09 1.05±0.09#1.01±0.10##1.03±0.04##
3.4 各组大鼠血清IL-6、TNF-α含量比较
与空白组比较,模型组大鼠血清IL-6、TNF-α含量升高(P< 0.001,P< 0.01)。与模型组比较,硫必利组血清IL-6含量降低(P< 0.01),TNF-α水平无明显变化(P> 0.05);与模型组比较,强志组方各剂量组血清IL-6含量降低(P< 0.001);强志组方低、中、高剂量组血清TNF-α含量降低(P< 0.01,P< 0.05)。见表6。
表6 各组大鼠血清IL-6、TNF-α含量比较(±s)

表6 各组大鼠血清IL-6、TNF-α含量比较(±s)
注:与空白组比较,**P < 0.01,***P < 0.001;与模型组比较,#P <0.05,##P < 0.01,###P < 0.001。
TNF-α 5.03±0.61 6.74±0.48**7.38±0.43 5.31±0.24##4.84±0.73##5.47±1.00#组别空白组模型组硫必利组强志组方低剂量组强志组方中剂量组强志组方高剂量组n4 4 4 4 4 4 IL-6 12.92±1.71 58.94±5.01***44.83±6.56##33.47±3.04###27.22±8.15###30.34±3.37###
4 讨论
TD是一类不自主的、快速的、无节律的,以运动抽动或发声抽动为主要表现的神经精神障碍。西医治疗TD以药物为主,包括DA受体阻滞剂、DA系统稳定剂、选择性单胺能拮抗剂、中枢性α受体激动剂、抗癫痫药等,但复发率高,不良反应明显。硫必利是目前治疗TD的一线药物,临床使用过程中发现其有头晕、恶心、乏力,嗜睡等不良反应[14]。
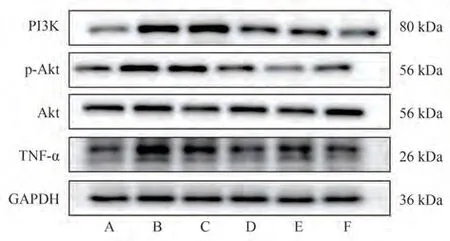
图1 蛋白电泳图
中医学并无TD的病名,据TD临床表现,可将其归属于“瘛疭”“慢惊风”范畴。《灵枢·本藏》言:“志意者,所以御精神,收魂魄,适寒温,和喜怒者也”“志意和则精神专直,魂魄不散,悔怒不起,五脏不受邪”。志意调和者,能够正常驭收精神与魂魄活动,对外界环境变化的感知适应能力强,从而免受邪气的侵袭。《内经》早已明确了志意在精神、动作、行为驾驭、驭收、发用及对内外环境的感知、反馈、调适的生理作用[15]。阎兆君教授以《内经》为理论基石,修复并创建志意辨证理论,广泛运用于精神动作行为疾病中,创新性提出TD总的病机为肾志不足,脾意任越,魂魄不安[16]。肾志不足,志少于行,则会出现反复的、不可控制的眨眼、耸肩、清嗓、喉中发声等行为;肾志不足,对情绪、情感活动的控制力减弱,则会表现出脾气急躁、易冲动;肾志不足,则行为不够果断勇敢,胆小遇事易退缩。均符合TD患者的疾病及性格特点。
基于志意辨证理论,阎兆君教授自拟强志组方治疗TD,方中巴戟天补肾增志,木香强志,远志益志开窍,茯神开心益智、安定魂魄,清半夏调和阴阳,山药强肾志、安神魂、定精魄,白术健脾益气,诸药共行益肾强志之功。
PI3K/Akt信号通路[17]是常见的炎症信号通路,具有广泛的生物学效应。PI3K家族在炎症、免疫、肿瘤、肥胖等疾病的发病机制中发挥着重要作用,细胞内PI3K在外界信号刺激后,会有不同程度的升高[18]。Akt是PI3K下游的直接靶蛋白,磷酸化后的PI3K与Akt的PH结构域结合,使得Akt磷酸化[19]。磷酸化的Akt进一步激活Akt下游炎性蛋白TNF-α。已有实验证明了PI3K/Akt信号通路与TD的相关性。HONGYAN等[7]研究发现,使用PI3K抑制剂抑制LY294002能明显缓解TD大鼠的抽动症状,显著降低大鼠纹状体与血清炎症因子水平,说明PI3K/Akt信号通路可能介导了TD的病理过程。
TD伴随着免疫功能紊乱,ZHONG等[20]研究显示,IDPN建立的TD大鼠模型脑内IL-6和TNF-α等细胞因子明显高于正常组。TAO等[21]对1 724例TD患者和550例对照组患者分别进行细胞因子IL-2、IL-4、IL-6、IL-10、TNF-α和IFN-γ水平的检测,结果发现TD患者血清IL-6浓度明显高于对照组。一项对多发性抽动症患者的促炎细胞因子和T细胞的Meta分析结果显示,多发性抽动症患者包括IL-6、TNF-α在内的促炎因子水平增加[22]。本实验研究结果与上述文献研究结果一致。
本实验成功复制TD大鼠模型,通过Western blot、qPCR与Elisa法探究强志组方是否通过调控PI3K/Akt/TNF-α信号通路发挥防治TD的作用。实验结果显示,强志组方能够降低大鼠运动行为与刻板行为评分,下调纹状体PI3K、Akt、TNF-α蛋白及mRNA表达水平,降低血清IL-6、TNF-α水平。说明强志组方能抑制大鼠纹状体PI3K/Akt/TNF-α通路的激活和外周炎症因子生成,有效减轻TD大鼠抽动症状。
5 结论
强志组方能改善TD大鼠异常的运动行为与刻板行为,其机制与调控纹状体PI3K/Akt/TNF-α通路的过度激活,降低外周炎症因子有关。本研究从PI3K/Akt/TNF-α信号通路入手,为TD发病机制及有效防治提供新思路和新靶点。但TD的发病是多因素作用的结果,强志组方治疗TD的深入病因机制仍需进一步研究。
