CT引导微波消融结合载药栓塞微球经肝动脉化疗栓塞治疗原发性肝癌的临床疗效
2024-01-25王秀香李海霞李辉王明月代树本
王秀香,李海霞,李辉,王明月,代树本
(沧州市第三医院,1.CT室;2.放射科;3.肝病一科;4.内镜室,河北 沧州 061001)
调查[1]显示,仅有20%~25%的原发性肝癌患者可进行肝切除术,剩余患者均因漏诊或误诊等错过手术治疗最佳时期。近年来,微波消融术由于具有确切的疗效及穿透性强、消融范围广等优势被越来越多的患者和医生认可,并将其视为一线治疗手段[2-3]。肝动脉化疗栓塞术(TACE)是一种非手术的方式,可将肿瘤供血动脉精确栓塞,使抗肿瘤药物得以充分发挥作用,避免化疗药物在患者全身范围内过度暴露,临床应用率较高。另外,近年研究[4]的一大热点就是新型栓塞剂,载药微球(durg-eluting bead,DEB)可以同时实现载药和栓塞,是一种优良的栓塞材料。DEB-TACE通过经动脉注射释放携带抗癌药物微球直接作用于肿瘤血供,实现药物释放及肿瘤血管栓塞。关于两种疗法联合治疗原发性肝癌的报道目前国内外尚无。基于此,本研究拟观察CT引导微波消融(CT-MWA)结合载药栓塞微球经肝动脉化疗栓塞(DEB-TACE)治疗原发性肝癌的临床疗效及分析影响术后无瘤生存时间的危险因素。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月至2021年2月沧州市第三医院收治的80例原发性肝癌患者的临床资料。按照治疗方式不同将患者分为研究组和对照组,每组各40例。其中,研究组男性25例,女性15例,年龄35~78岁,肿瘤直径13~76 mm;对照组男性26例,女性14例,年龄34~69岁,肿瘤直径14~75 mm。两组患者性别、年龄、肝功能分级及肿瘤直径等一般资料比较,差异无统计学意义(P>0.05)。见表1。纳入标准:(1)符合原发性肝癌诊断标准[5];(2)经病理学及影像学检测结果证实;(3)Child-Pugh肝功能分级A或B;(4)生存期预计≥6个月。排除标准:(1)有器官移植史;(2)门静脉主干癌栓或累及左/右支的癌栓;(3)远处转移;(4)严重凝血障碍及出血倾向者;(5)严重传染性者。
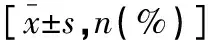
表1 两组患者一般资料比较
1.2 治疗方法
两组患者均采用DEB-TACE技术,使患者采取仰卧位置,同时术中采用心电监护。吸取200 μm CalliSpheres微球6 mL,静置0.5 h后弃去上清,剩余液体溶于等比混合的5%葡萄糖溶液及吡柔比星30 mg(深圳万乐药业生产),充分混合摇匀,按照等比例加入碘佛醇后摇匀备用。选取股动脉进行赛尔丁格法穿刺,并选取肝动脉附近进行远端造影,影像学确定病灶部位及血流分布后将载药微球以1 mL/min匀速且缓慢的注入供血动脉,观察造影情况,若造影剂出现流速减慢或完全停滞现象,则停止注射。5 min后可根据情况再次进行血管造影,同时观察是否完全将肿瘤供血血管处栓塞,术后止血包扎。嘱咐患者卧床静置6 h。
研究组于两周后联合用CT-MWA进行治疗,术前给予患者禁水禁食,局麻后在CT影像学引导下尽可能避免损伤胃肠管、胆囊及重要血管,选择进针路径。消融范围以完全覆盖至肿瘤边缘1 cm为宜,时间范围为3~6 min,功率范围为30~55 W。术中持续检测患者生命指标,术毕边退针边消融针道。术后对患者进行镇痛等对症治疗。
1.3 观察指标
1.3.1 临床疗效评价 参照实体瘤疗效评价标准(re-sponse evaluation criteria in solid tumors,RECIST)于手术结束后1个月对患者术后临床疗效进行判定。术后肝癌病灶体积减少>50%,且在近1个月内疾病未出现进展为完全缓解(CR);肝癌病灶体积减少25%~50%为部分缓解(PR);病灶体积减少<25%,且未发现有新的肿瘤病灶为疾病稳定(SD);肝癌病灶体积出现增大且增大范围>25%,或有新的出现为疾病进展(PD)。临床有效率=完全缓解率+部分缓解率[6]。
1.3.2 肝功能及肿瘤标志物 (1)肝功能:于治疗前及治疗后的两周采用全自动生化分析仪(东芝LST008)对患者肝功能指标ALT、AST、TBIL及ALB进行检测。检查前禁食、禁水12 h,于清晨空腹取12 mL肘静脉血。将其分别放置于2支试管,1支用于检测肝功能,将试管放置于-4 ℃的环境下按照3 000 r/min的速度进行离心处理,取上层血清检测肝功能。(2)肿瘤标志物:另1支用于检测肿瘤标志物水平。肿瘤标记物阳性标准如下:甲胎蛋白>40 ng/mL;CA199>37 U/L[7]。
1.3.3 不良反应发生情况 记录并比较两组呕吐、发热、腹痛及腹胀等不良反应的发生情况,对比治疗安全性。
1.4 统计学分析
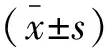
2 结果
2.1 两组患者治疗有效率比较
治疗后,研究组患者治疗有效率高于对照组(P<0.05)。见表2。

表2 两组患者治疗有效率比较[n(%)]
2.2 两组治疗前后肝功能指标比较
治疗后两周内,两组ALT、AST、TBIL均降低,且研究组低于对照组(P<0.05);ALB均升高,且研究组高于对照组(P<0.05)。见表3。

表3 两组治疗前后肝功能指标对比
2.3 两组不良反应发生率比较
治疗后,两组患者均出现呕吐、发热、腹痛及腹胀等不良反应,研究组不良反应发生率(10.0%)较对照组(30.0%)更低(P<0.05)。见表4。
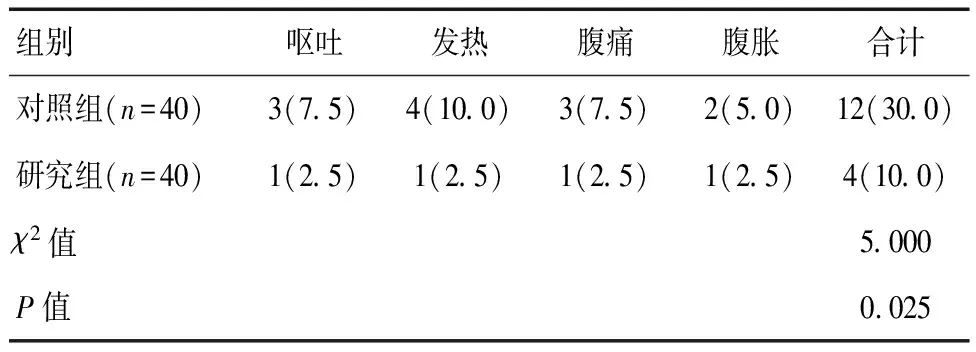
表4 两组不良反应发生率对比[n(%)]
2.4 影响无瘤生存及总生存时间的单因素分析
肿瘤多发、肿瘤大小>3 cm及甲胎蛋白值>20 μg/L患者的平均无瘤生存时间更短(P<0.05);有肝病病史、肿瘤数量多发、肿瘤大小>3 cm及单纯采用DEB-TACE术式平均总生存时间更短(P<0.05)。见表5。

表5 影响无瘤生存及总生存时间的单因素分析
2.5 影响无瘤生存期及总生存期的多因素分析
Child-Pugh分级B级、肿瘤数量多发、肿瘤大小>3 cm、甲胎蛋白>20 μg/L、单纯采用DEB-TACE手术方式的患者平均无瘤生存时间更短(P<0.05);存在肝病病史、肿瘤数量多发、肿瘤大小>5 cm及单纯采用DEB-TACE手术方式的患者平均总生存时间更短(P<0.05)。见表6及表7。

表7 影响生存时间的多因素分析
3 讨论
原发性肝癌在确诊时大多已经是中晚期,患者肝组织灌注困难,肝功能受损严重,患者生活质量和生存质量极低[8]。对中晚期肝癌患者来说,采用手术切除的方式局限性较大,极易受到肝功能、病灶大小等因素的影响,整体治疗效果不佳[9]。
DEB-TACE是一种新型介入治疗方式,可将肿瘤部位的供血有效阻断,并通过将化疗药物注入肿瘤部位有效杀灭肿瘤细胞[10]。现有研究[11]指出,DEB-TACE具有更高的安全性及更优的治疗效果,尤其在延长两年生存率方面,栓塞载药脂微球的使用可有效提高肝癌治疗效果,延长生存期,肿瘤的复发率较低,临床价值显著[12]。肝动脉栓塞化疗可靶向化疗药物至肿瘤部位,但是将血供阻断的方式会导致化疗药物作用范围有限,治疗效果不佳且病情易反复。载药微球具有栓塞和载药功能,是一种优良的栓塞材料[13],借助离子交换机理高效吸附抗肿瘤药物,使药物在肿瘤部位实现平稳释放,提高血药浓度,减少对机体正常细胞的损伤,降低副作用[14]。
经皮微波消融的优点是消融范围广、穿透性强、疗效确切,是近年来广泛用于临床的重要治疗方法[15]。该方式的治疗原理在于可以利用肿瘤细胞耐热性较正常细胞更差,借助微波的热量凝固肿瘤细胞来治疗疾病。同时经皮微波消融操作相对简便,患者接受度高,合并肝硬化的患者也可采用此方法治疗,且对疗效影响较小,可提升生存率[16]。
本研究中研究组整体疗效较对照组明显,且治疗安全性较高,提示CT-MWA联合DEB-TACE可有效抑制肿瘤病灶,提高预后。DEB-TACE具有亲水性和精确定制的特质,可携带高浓度的化疗药物,延长作用于肿瘤细胞的时间,CalliSpheres微球可混悬协载及吸附化疗药物,通过控制药物在肿瘤部位的药代动力学实现缓释功能,降低副作用。同时,载药微球可通过碘油的导热性能有效提升消融疗效,改善肿瘤标志物水平。在改善肝功能方面,研究组优于对照组(P<0.05),表明联合治疗可进一步改善患者肝肾功能[17]。研究[18-19]指出,肿瘤难治愈的主要原因在于其易转移和易复发的特性,因此,无论进行肝移植、肝切除还是消融术等,局部治疗的方式难以从根本上解决肿瘤转移和复发的问题。本研究中Child-Pugh分级﹑甲胎蛋白>20 μg/L、肿瘤直径>5 cm及肿瘤多发等均是影响患者生存期的独立危险因素,对于符合上述指标的患者,肿瘤复发的概率较大,因此并不适合肝移植和肝切除等有创的治疗方式。术前对患者病情进行评估,根据病情选择合适的治疗方式,并在治疗后进行定期进行随访,可有效控制病情。
