改性磁珠吸附剂脱汞及脱附再生动力学研究*
2024-01-22谢占军魏书洲赵永椿张军营
谢占军 魏书洲, 杨 威 赵永椿 常 林,4 张军营
(1.国能三河发电有限责任公司,065201 河北三河;2.河北省燃煤电站污染防治技术创新中心,065201 河北三河;3.华中科技大学煤燃烧与低碳利用全国重点实验室,430074 武汉;4.国家能源集团新能源技术研究院有限公司,102209 北京)
0 引 言
汞具有较强的生物累积性、挥发性、高毒性等特性,是危害人类健康的有毒污染物之一[1]。人为汞排放是造成全球汞污染的重要来源。其中,煤燃烧造成的汞排放量占全球人为活动汞排放量的比例超过20%[2]。为了减少燃煤汞排放,美国要求燃煤电厂烟气中的汞含量不得超过1.36 μg/(kW·h),而中国规定火电厂排放的汞质量浓度必须低于30 μg/m3[3]。烟气中的汞主要由单质汞(Hg0)、二价汞(Hg2+)和颗粒态汞(Hgp)组成[4-6]。颗粒态汞和二价汞可以分别通过布袋除尘器/静电除尘器和湿法脱硫装置脱除[7]。由于单质汞具有高挥发性和低水溶性,因此现有的污染物脱除设备很难有效地控制单质汞的排放[8]。
近年来,一系列烟气脱汞技术如吸附脱汞、催化氧化等技术被开发出来[9-14]。在这些现有的技术中,活性炭喷射技术被认为是最有效的汞控制技术之一,但高成本限制了该技术的发展[15]。因此,开发高效低廉的脱汞技术是降低脱汞成本的有效方法。磁性吸附剂由于具有容易与飞灰颗粒分离的特性,目前已有不少学者提出采用合成的磁性颗粒脱除烟气中的单质汞[16-17]。合成的吸附剂固然能获得较高的汞氧化和脱除率,但是合成的磁性吸附剂成本也很高[18-19]。飞灰中的磁珠颗粒是一种具有一定孔隙结构和吸附能力的磁性物质,能够从飞灰中有效分离出来,被认为是活性炭的最佳替代品。但是,与活性炭相比,磁珠的脱汞能力有限,不利于其未来的应用。因此,增加磁珠的活性位点是改善磁珠汞吸附性能的有效方法之一。在课题组之前的工作中[20-24],开发出一种高效的可回收的氯化铜改性磁珠吸附剂,并系统地研究了该吸附剂的汞吸附性能、脱汞机理和再生性能等。通过氯化铜的改性,磁珠吸附剂的表面增加了铜离子和氯离子等有利于脱汞的活性位点,因此促进了汞的脱除。吸附反应动力学是研究吸附剂吸附机制和吸附过程的重要手段,可以较好地描述吸附剂的吸附过程和预测吸附速率控制步骤。目前,关于汞在氯化铜改性磁珠吸附剂表面的吸附动力学研究较少。因此,开展改性磁珠吸附剂脱汞的吸附动力学研究具有重要的理论意义和参考价值。
本实验采用浸渍法制备了氯化铜改性磁珠吸附剂,并将其用于控制烟气中Hg0的排放,研究了反应温度、烟气流量、吸附剂用量和烟气组分(NO,SO2)对Hg0脱除性能的影响。采用程序升温脱附(temperature programmed desorption,TPD)的方法探讨了改性磁珠吸附剂的脱附再生过程。通过准一级和准二级吸附动力学模型对改性磁珠吸附剂的脱汞过程进行了分析,以期为低成本磁性吸附剂的开发和应用提供参考。
1 实验部分
1.1 样品制备
通过浸渍法制备了氯化铜改性磁珠吸附剂(颗粒的粒径分布见表1)。首先,称取10 g的CuCl2·2H2O,并将其溶解在129.4 g的去离子水中,配置成CuCl2的质量分数为6.0%的溶液。称取10 g的磁珠,并将其与6.0%的CuCl2溶液混合,超声振荡0.5 h。CuCl2混合溶液用量与磁珠的饱和吸水量相同。经过振荡后的混合溶液先在30 ℃的条件下干燥12 h,然后继续在110 ℃条件下干燥12 h。获得的样品被命名为Cu-MF。

表1 改性磁珠吸附剂颗粒的粒径分布
1.2 实验装置
样品脱除Hg0的实验装置如图1所示。该装置主要包括烟气模拟系统、反应系统、测试系统和尾气处理系统。汞蒸气(Hg0)由汞渗透管产生,汞质量浓度为100 μg/m3。每次实验都要将一定量的样品均匀放置于固定床反应器中。反应器进出口处的汞质量浓度可用在线测汞仪(VM3000,德国Mercury Instruments公司)测量,该仪器的测量范围为0 μg/m3~2 000 μg/m3,测量误差小于0.1 μg/m3。为了防止汞蒸气和水蒸气的凝结,系统中的所有管路用加热带进行保温。实验系统中的废气需要尾气处理系统充分净化。具体的实验条件见表2。样品的汞吸附性能可以由脱汞效率和单位汞吸附量来表示。具体的计算方程式为:
(1)
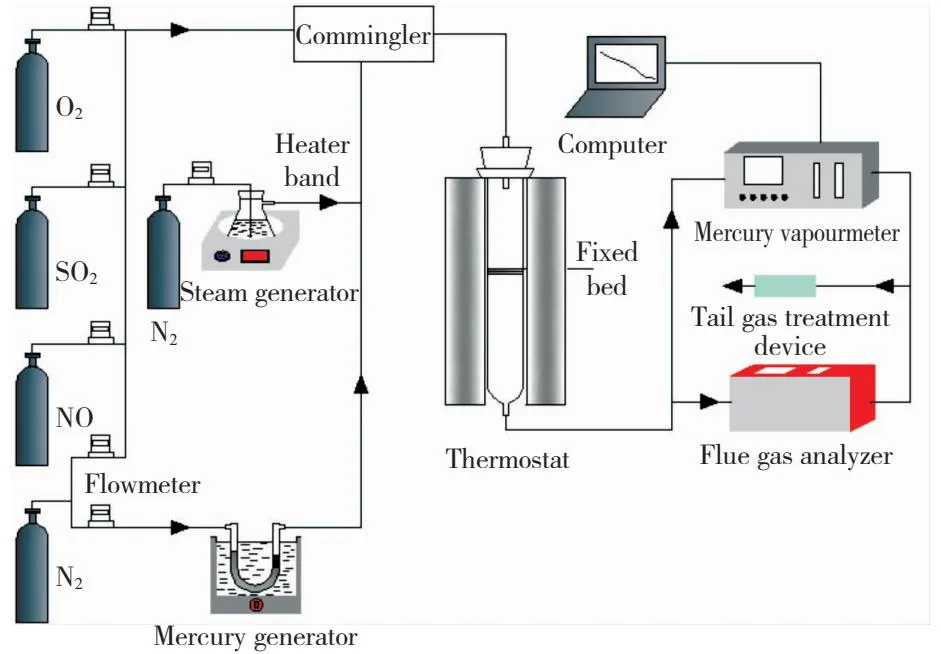
图1 汞定量吸附反应实验系统

表2 实验工况
(2)
式中:η为样品的脱汞效率,%;ρin和ρout分别为反应器进出口处的Hg0质量浓度,μg/m3;q为样品的单位汞吸附量,μg/g;m为样品的质量,g;Q为烟气总流量,L/min;t为反应时间,min。
吸附剂表面汞的形态采用Hg-TPD方法确定,实验系统如图2所示。该系统主要由程序升温脱附系统、高温Hg分解还原系统和测试系统三部分组成。Hg-TPD实验系统反应器为内径10 mm、长400 mm的圆柱形石英管。吸附汞后的吸附剂置于反应器中,由可程序控温的管式炉精确控制和调节温度,可将吸附剂由30 ℃加热至800 ℃,升温速率可调节。在实验前采用热电偶校准反应器温度。反应器出口处的Hg0质量浓度可用在线测汞仪测量。
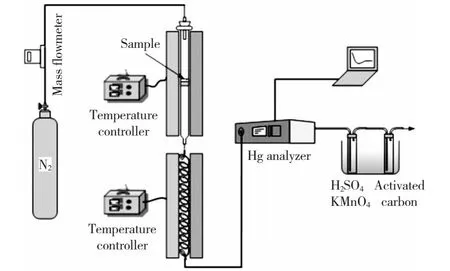
图2 程序升温汞脱附(Hg-TPD)实验系统
1.3 动力学方程
本研究主要利用准一级动力学模型和准二级动力学模型来研究改性磁珠吸附剂的吸附动力学过程。准一级和准二级动力学模型的具体表达式如式(3)和式(4)所示。
(3)
(4)
式中:t为吸附反应时间,min;qt为t时吸附剂的吸附量,μg/g;qe为吸附平衡时吸附剂吸附量,μg/g;k1为准一级动力学模型的反应速率常数,1/min;k2为准二级动力学模型的反应速率常数,g/(μg·min)。
2 结果与讨论
2.1 改性磁珠吸附剂对汞的定量吸附动力学行为
2.1.1 反应温度的影响
反应温度是影响化学反应的最主要因素之一,有研究表明一定范围内反应温度每升高1 ℃,化学反应速率将提升一个数量级。改性磁珠吸附剂Cu-MF在不同反应温度条件下对汞的吸附性能如图3所示。由图3可以看出,可再生吸附剂在不同反应温度下均表现出较好的汞脱除能力,瞬时脱汞效率在反应初始时迅速提升,随后缓慢下降。当反应温度由100 ℃升高到135 ℃时,反应温度的提高有助于减缓瞬时脱汞效率下降趋势;当反应温度继续升高到180 ℃时,汞脱除效率衰减性增强。这主要是由于在温度较低时,升高反应温度可有效提高吸附剂Cu和Cl元素的反应能力,进一步提高反应温度会对汞在吸附剂表面的吸附带来不利影响,因而汞脱除效率有所降低。在应用过程中可将磁珠吸附剂注入到温度在120 ℃~150 ℃区间的烟气内,可保证吸附剂具有较高的汞脱除能力。因此,135 ℃被认为是最佳的反应温度。
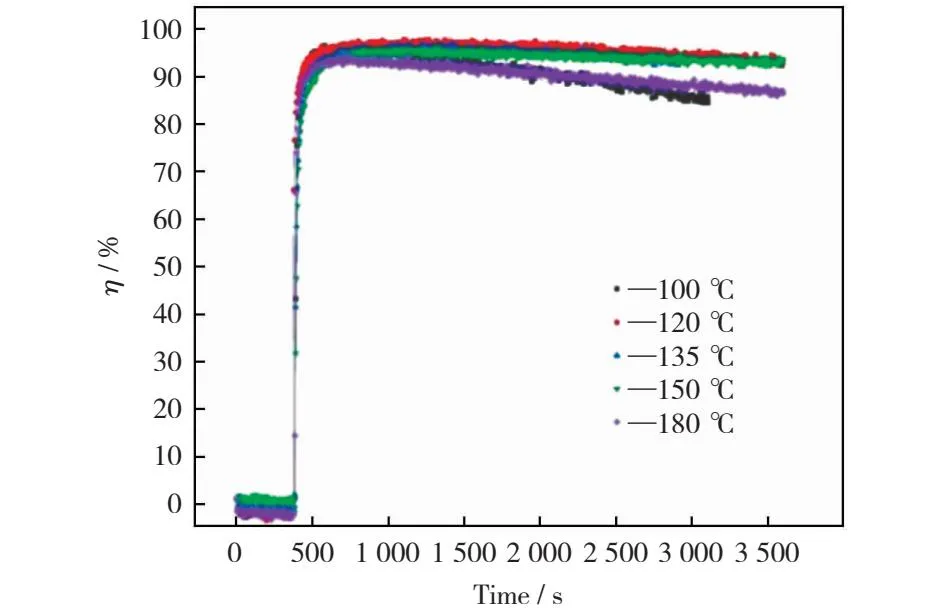
图3 温度对改性磁珠吸附剂吸附汞的影响
基于准一级动力学模型及准二级动力学模型对不同温度下可再生磁珠动力学反应特性进行拟合分析,结果见表3。由表3可以看出,在120 ℃~150 ℃温度范围内,可再生磁珠汞吸附反应动力学较好地符合准一级和准二级吸附动力学模型,其中在150 ℃时,两种吸附模型的R2值均超过0.9,表明该温度范围内磁珠对汞的吸附行为受物理吸附及化学吸附行为双重因素控制。
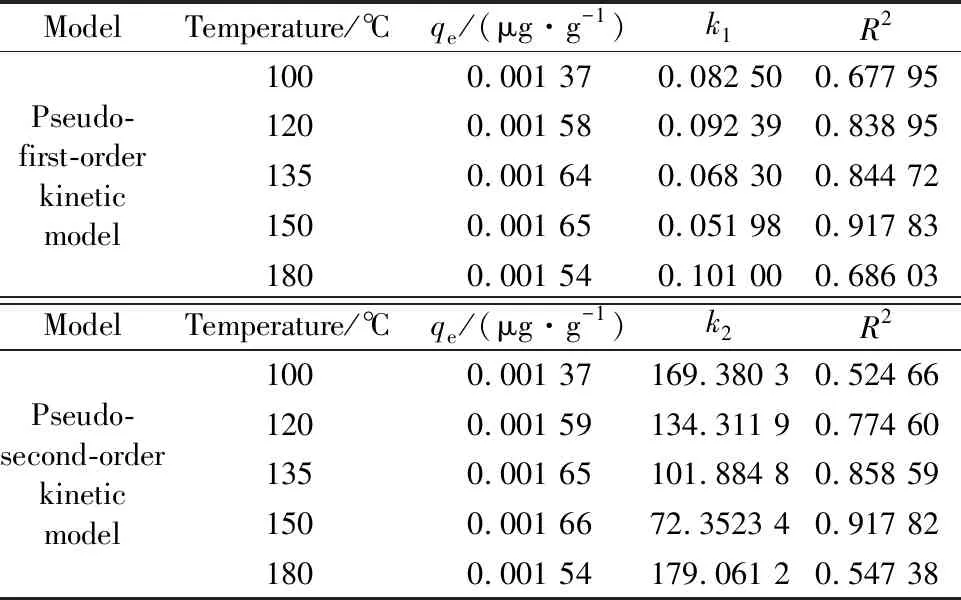
表3 温度影响下的动力学参数
2.1.2 烟气流量的影响
本节主要讨论不同烟气流量对改性磁珠吸附剂脱汞效率的影响。考察单位面积通过单位吸附剂用量的气相体积流量,可对单位质量吸附剂与气相反应物反应接触时间进行评价。实验套管内衬内径截面积约为1.7 cm2,烟气流量为0.8 L/min,1.2 L/min和1.5 L/min,改性磁珠对汞的吸附性能如图4所示。
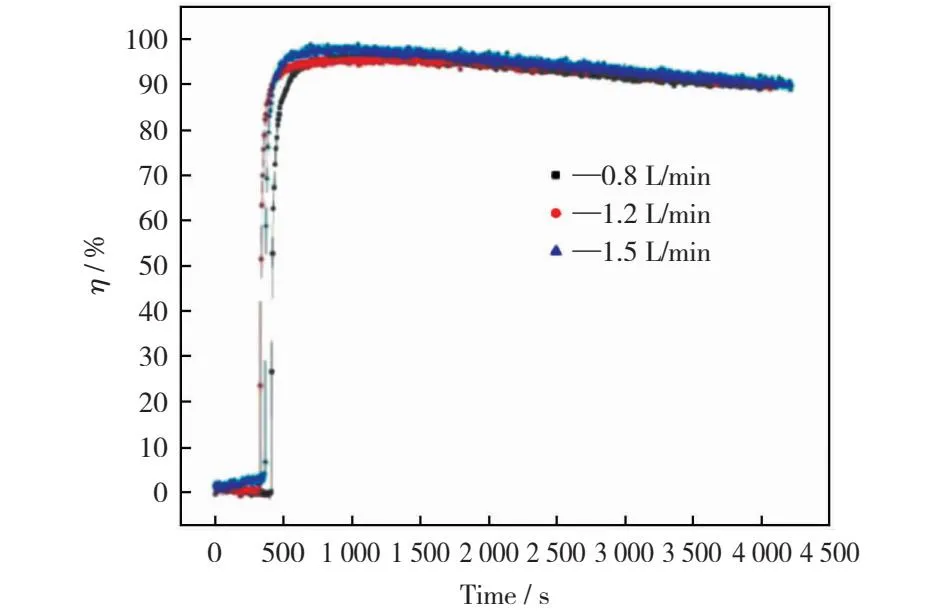
图4 烟气流量对改性磁珠吸附剂吸附汞的影响
由图4可以看到,不同烟气流量对可再生磁珠吸附剂脱除汞的效果影响不明显,在反应初期达到瞬时脱汞效率峰值后,脱汞效率均呈缓慢下降趋势,三种条件下降低幅度较为一致,因此可以认为可再生磁珠吸附剂具有较强的汞吸附性能,在实际工程应用过程中可避免工况或负荷调整对可再生磁珠吸附剂汞吸附性能的影响。综合考虑实验成本和效率,本实验选取1.2 L/min作为最佳的烟气流量,并用于以下实验。
基于准一级动力学模型和准二级动力学模型对不同烟气流量下可再生磁珠动力学模型进行拟合分析,结果见表4。由表4可以看到,准一级和准二级动力学模型的R2随着烟气流量的增加而增加,说明可再生磁珠汞吸附反应动力学较好地符合准一级和准二级吸附动力学模型。当烟气流量为1.5 L/min时,准一级和准二级动力学模型的相关系数分别为0.912 42和0.915 58,表明改性磁珠吸附剂在该烟气流量内的汞吸附过程受物理吸附及化学吸附行为双重因素控制。
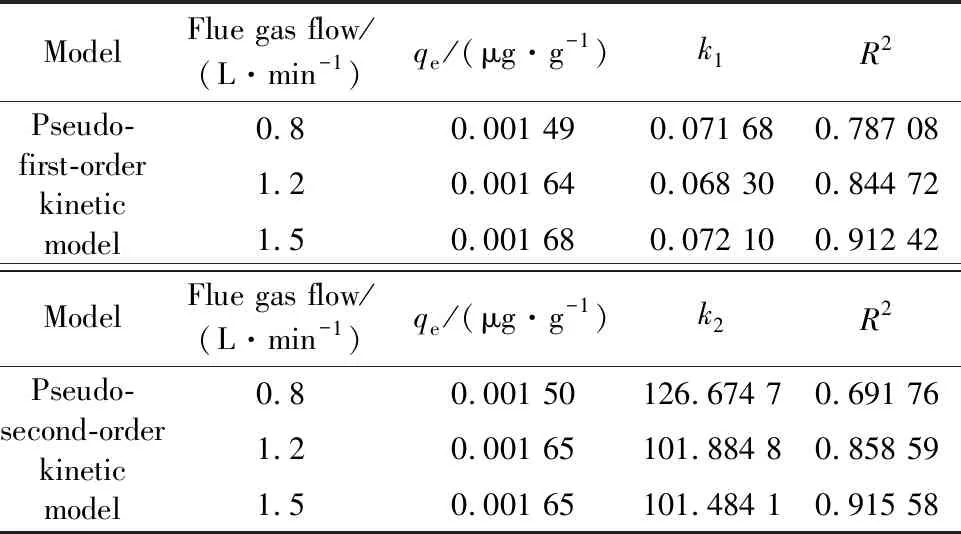
表4 烟气流量影响下的动力学参数
2.1.3 吸附剂用量的影响
改性磁珠吸附剂用量分别为0.2 g,0.5 g和1.0 g时对汞的吸附性能见图5。由图5可以看出,整体模拟烟气汞脱除效率随可再生磁珠吸附剂的用量提高而增大,当磁珠吸附剂用量为0.2 g时,反应初始瞬时脱汞效率峰值为95.1%,随后迅速降低,反应1 h后,瞬时脱汞效率降低到70%;当磁珠吸附剂用量为0.5 g时,反应初始瞬时脱汞效率峰值迅速提高到90%以上并逐步达到96.2%,随后缓慢下降,反应结束时瞬时汞脱除效率保持在90%以上;进一步提高磁珠吸附剂用量到1.0 g时,反应初始瞬时脱汞效率进一步提高到97.9%,并在反应过程中始终保持在较高水平,反应结束时的瞬时脱汞效率仍保持在95%以上。这主要是由于磁珠吸附剂用量提高,吸附剂表面可用活性位点绝对量增大,单位时间内结合的Hg0含量增大,吸附剂用量进一步增大时,单位时间内消耗吸附剂活性位点过剩,此时汞脱除效率提升受其他反应条件制约。因此,综合考虑可再生磁珠吸附剂使用成本及磁珠在烟道内实际有效反应窗口时间,0.5 g的吸附剂用量被认为是最佳的吸附剂用量,并用于以下实验。
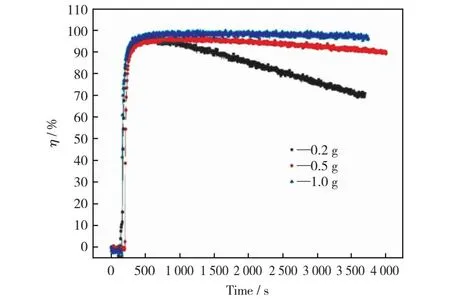
图5 改性磁珠吸附剂用量对吸附汞的影响
基于准一级动力学模型和准二级动力学模型对不同磁珠用量下可再生磁珠动力学模型进行拟合分析,结果见表5。由表5可以看出,当吸附剂用量大于0.5 g时,可较好地符合准一级和准二级吸附动力学模型。吸附剂用量为1.0 g时,准二级吸附模型的R2拟合系数超过0.9,表明吸附剂用量接近1.0 g时,可提供足够的吸附活性位,其吸附行为受物理吸附及化学吸附行为双重因素控制。当吸附剂用量低于1.0 g时,吸附剂活性位绝对数量相对较少,无法满足汞质量浓度较高条件下的稳定吸附,因此脱除效率仅在反应初始阶段达到较高水平,随后持续下降。
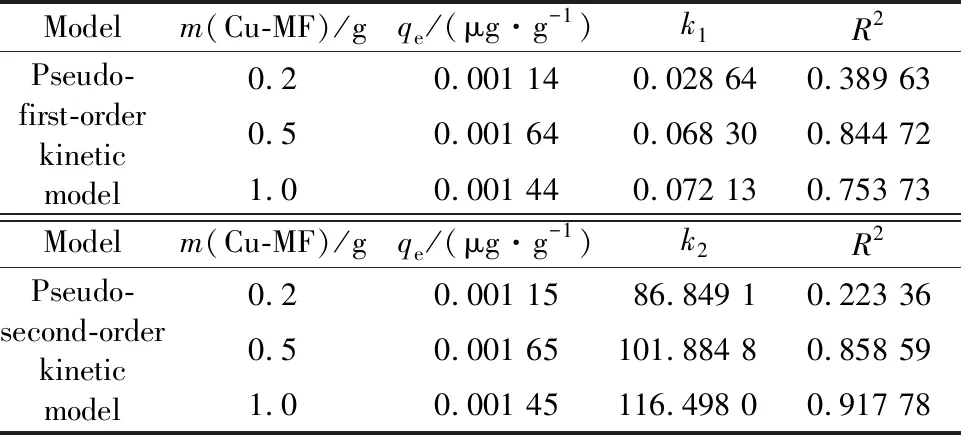
表5 改性磁珠吸附剂用量影响下的动力学参数
2.1.4 烟气组分SO2的影响
SO2易占据吸附剂的活性吸附位点导致催化剂中毒,是影响吸附剂脱除汞的性能的主要因素之一。在最佳实验条件和纯N2气氛下考察了改性磁珠吸附剂Cu-MF在不同SO2体积分数(800×10-6,1 000×10-6和1 200×10-6)下的汞脱除性能,结果见图6。由图6可以看到,模拟烟气中SO2组分含量对磁珠吸附剂脱除汞的性能影响并不明显。这一结果说明改性磁珠吸附剂Cu-MF具有较强的抗SO2的能力,这与之前的研究结果[20]是一致的。

图6 SO2体积分数对改性磁珠吸附剂吸附汞的影响
通过对不同体积分数SO2条件下磁珠脱除汞性能的动力学拟合结果进行分析(见表6),可以看到SO2对磁珠脱除汞的影响在SO2体积分数为1 200×10-6时的相关系数最高,较好地符合准一级动力学模型,可以认为SO2对可再生磁珠脱除汞的影响受物理吸附影响,烟气中的SO2被吸附在吸附剂上,占据吸附剂表面活性位,进而影响汞的脱除。
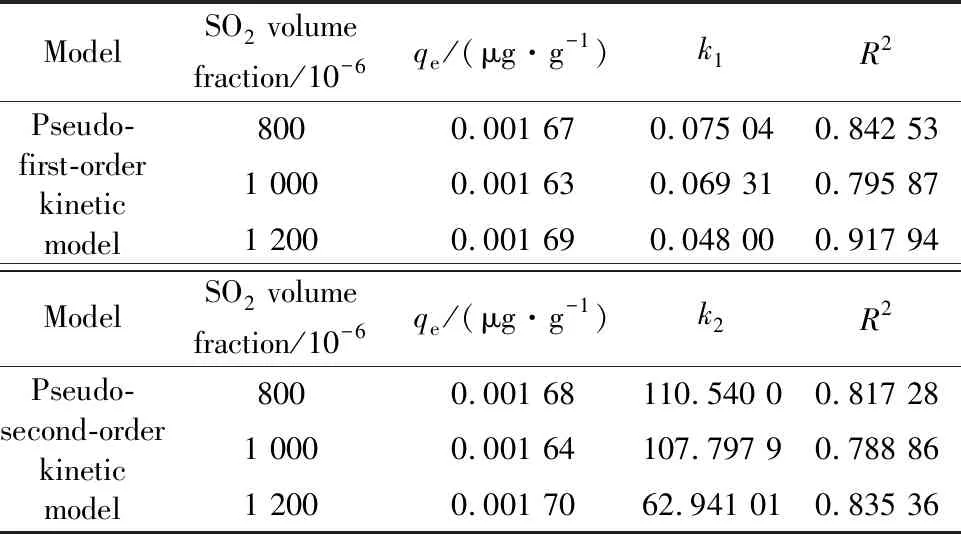
表6 SO2体积分数影响下的动力学参数
2.1.5 烟气组分NO的影响
最佳实验条件和纯N2气氛下不同NO体积分数对改性磁珠吸附剂Cu-MF吸附汞性能的影响见图7。由图7可看出,烟气中NO体积分数的变化对磁珠吸附剂脱除汞的性能影响不大。磁珠吸附剂的脱汞效率均保持在90%以上。这一结果表明,增加NO体积分数不能有效促进改性磁珠吸附剂脱汞效率的提高,这与之前的相关研究结果[20]是一致的。
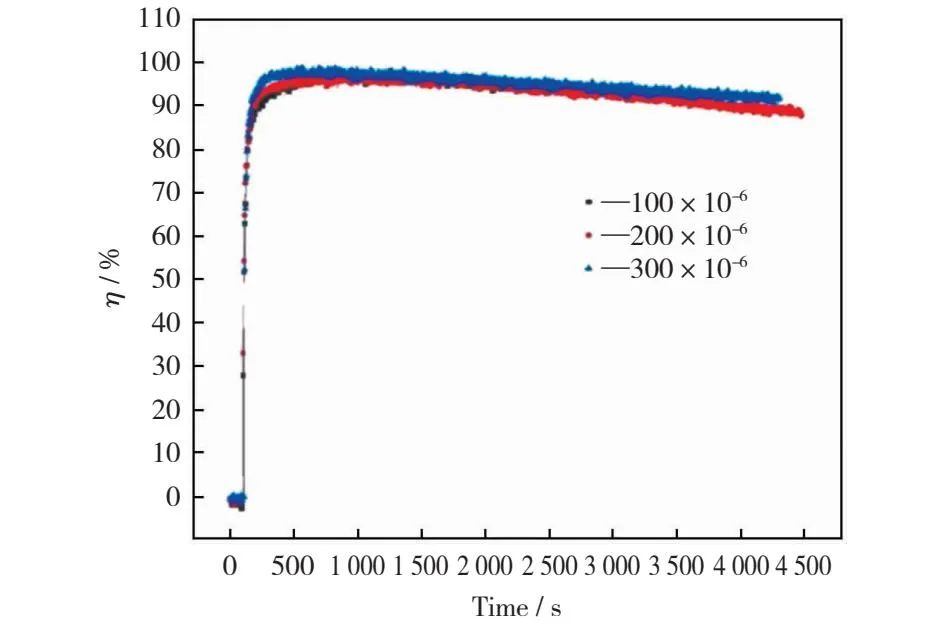
图7 NO体积分数对改性磁珠吸附剂吸附汞的影响
通过对不同体积分数NO条件下磁珠脱除汞性能的动力学拟合结果进行分析(见表7),可以看到吸附剂通过准二级动力学模型拟合得到的相关系数值高于通过准一级动力学模型拟合得到的相关系数值。因此,磁珠对汞的脱除过程符合准二级动力学模型,可以认为NO在可再生磁珠汞脱除的过程中可能发生了化学反应,烟气中的NO已被氧化为NO2,可将Hg0氧化为氧化态形式。相较于元素态汞,氧化态汞更易被吸附,进而影响汞的脱除行为。
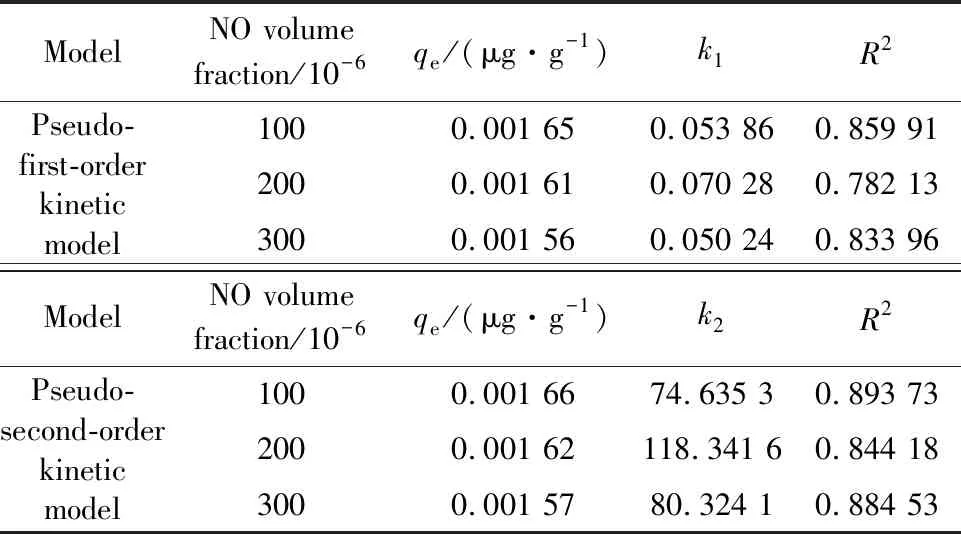
表7 NO体积分数影响下的动力学参数
2.2 可再生磁珠脱附汞再生动力学行为
2.2.1 升温速率对可再生磁珠脱附汞的影响
采用程序升温脱附的方法对不同升温速率下汞在可再生磁珠吸附剂脱附过程中的形态演变进行分析,结果见图8。由图8可以看出,汞在磁珠吸附剂加热时产生脱附行为,在受热脱附过程中主要以四种形态的汞(HgCl2,HgS,HgO和HgSO4)释放。在不同升温速率下,磁珠汞释放的形式类别无明显区别,释放强度存在差异,主要体现在在较低升温速率时,HgCl2等低温区段的汞化合物释放强度更高,在升温速率较高时其释放强度有所减弱,这主要是由于不同形态汞的释放温度区间跨度不同,升温速率较高会导致不同形态汞开始释放的时间接近,造成同一时间多种汞化合物同时释放。此外,不同升温速率下,汞存在的化合物形式可能发生转变,生成更稳定的HgS或HgO。
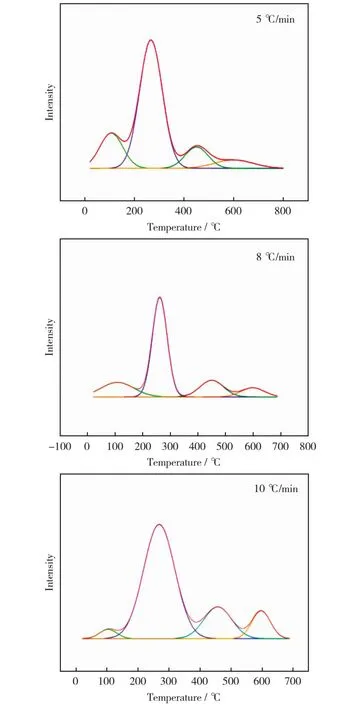
图8 可再生磁珠对汞的TPD结果
2.2.2 脱附再生温度区间
在实际过程中,磁珠吸附剂的汞脱附行为在瞬时加热方式下进行,即磁珠瞬间进入到高温环境进行汞脱附。高温瞬时汞释放机理与缓慢加热条件下的机理存在差异。因此,在瞬时加热温度区间(300 ℃~600 ℃)条件下,考察磁珠吸附剂在不同温度区间的脱附再生行为,结果见图9。由图9可以看到,在不同温度区间(升温速率为5 ℃/min)汞的释放行为存在差异,当加热温度为300 ℃时,磁珠内汞的释放曲线更平缓,在较长的时间内持续释放,释放质量浓度峰值也更低;在400 ℃~500 ℃区间内,磁珠内汞的释放更迅速,其中当加热温度为500 ℃时,磁珠内汞的释放主要集中在反应初始的200 s内,随后释放质量浓度较低;当加热温度进一步升高至600 ℃时,磁珠内部汞的释放周期无明显缩短,但释放强度有所提升。可以认为在温度高于500 ℃,加热时间超过200 s后,磁珠内部大部分汞可释放完成。
对不同温度下磁珠内部汞的释放动力学进行拟合研究可以发现,不同释放温度下磁珠汞的释放行为较好地符合准一级动力学模型和准二级动力学模型,但相比之下(见表8),磁珠汞脱附行为更符合准一级动力学模型(相关系数均高于0.96)。此外,由表8可以看出,随着温度的升高,k1的值也随之升高,这表明升高温度有利于汞的外扩散速率提高。因此,可以认为磁珠内部汞的脱附主要以物理脱附为主,同时在脱附过程中存在化学反应,这与此前不同升温速率下汞的化合物间存在反应的结论相一致。

表8 不同温度区间下的动力学参数
3 结 论
1) 改性磁珠吸附剂在120 ℃~150 ℃区间内具有较高的汞脱除能力,135 ℃为最佳反应温度,改性磁珠吸附剂汞吸附反应动力学较好地符合准一级和准二级吸附动力学模型。
2) 烟气流量对改性磁珠吸附剂的汞吸附性能影响较小,改性磁珠吸附剂的脱汞过程较好地符合准一级和准二级吸附动力学模型。
3) 改性磁珠吸附剂的脱汞效率随着吸附剂用量的增加而增加。当吸附剂用量大于0.5 g时,改性磁珠吸附剂可较好地符合准一级和准二级吸附动力学模型,其吸附行为受物理吸附及化学吸附行为双重因素控制。
4) 烟气中的SO2和NO对改性磁珠吸附剂的汞吸附性能影响不大,改性磁珠吸附剂在SO2和NO氛围的汞吸附过程则可以分别用准一级和准二级动力学模型来描述。
5) 磁珠汞脱附行为更符合准一级动力学模型,磁珠内部汞的脱附主要以物理脱附为主。
