肉桂醛调节AMPK/SREBP1c信号通路对非酒精性脂肪性肝炎小鼠肝损伤的影响
2024-01-22姚硕李源段超曾艳
姚硕, 李源, 段超, 曾艳
(1.华中科技大学同济医学院附属梨园医院中西医结合科,湖北武汉 430077;2.华中科技大学同济医学院附属梨园医院血液科,湖北武汉 430077)
非酒精性脂肪性肝炎(NASH)是非酒精性脂肪性肝病(NAFLD)最严重的形式,其特征是小叶炎症、肝细胞膨大和纤维化,是全球肝癌死亡增长最快的原因[1-2]。然而,NASH的发病机制尚未完全阐明,且缺少针对NASH 治疗的特效药物。NASH归属于中医学“肝癖”范畴,以痰湿瘀交阻于肝络,体内肥浊之气蓄积于肝脏为病机,化痰祛湿、健脾活血为基本治则[3]。肉桂为樟科植物肉桂Cinnamomum cassia Presl的干燥树皮,味辛、甘,归肝、肾、脾和心经,具有补元阳、温脾胃、通血脉的功效。肉桂醛是肉桂的活性成分之一,已被证明是肝脏脂肪变性治疗的潜在附加药物[4]。研究表明,肉桂醛可以调节肝脏的脂质代谢,减少脂质过度积累,以及调节葡萄糖代谢和改善高血糖[5-7],还具有降血脂、抗氧化和抗炎作用,可减轻高脂饮食诱导的动脉粥样硬化[8];但其对NASH的作用及机制尚不清楚。腺苷酸活化蛋白激酶(AMPK)被认为是肝脏脂质代谢进展的关键调节因子。胆固醇调节元件结合蛋白1(SREBP1)是脂肪生成主要调节因子的转录因子,可引起甘油三酯(TG)在肝脏中过度积累,导致NAFLD 的发展[9]。AMPK 通过负调控转录因子SREBP1 协调脂质代谢的长期适应[10]。激活AMPK 可通过抑制SREBP1 表达对NASH的肝脏发挥保护作用[11]。因此,本研究通过构建NASH 小鼠模型,基于AMPK/SREBP1 通路探讨肉桂醛对NASH小鼠肝损伤的治疗作用及机制,以期为其临床治疗NASH提供循证依据,现将研究结果报道如下。
1 材料与方法
1. 1 实验动物96 只SPF 级8 周龄雄性C57/BL6小鼠,体质量(20±2)g,购自成都药康生物科技有限公司,实验动物生产许可证号:SCXK(川)2020-034。将小鼠饲养于华中科技大学同济医学院附属同济医院实验室,动物使用许可证:SYXK(鄂)2019-0106,饲养条件:湿度(55 ± 5)%、光照12 h/黑暗12 h 循环,期间自由摄食和饮水。所有动物实验方案已获得华中科技大学同济医学院附属同济医院伦理委员会批准(审批号:20210805),并按照《中国实验动物护理使用指南》和实验动物管理方法进行。
1.2 药物、试剂与仪器肉桂醛(分子式:C9H8O,分子量:132.16,结构简式:C6H5CHCHCHO,纯度≥98%,美国Sigma 公司,批号:W228613)。Compound C[AMPK 抑制剂,纯度:99.91%,美国MedChemExpress(MCE)公司生产,批号:HY-13418A];丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、TG、总胆固醇(TC)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)等检测试剂盒(南京建成生物工程研究所);油红O染色试剂盒和Masson染色试剂盒(北京索莱宝科技有限公司);苏木素-伊红(HE)染色试剂盒(北京百奥曼科技有限公司);磷酸化AMPK(p-AMPK)、AMPK、磷酸化ACC(p-ACC)、乙酰辅酶A 羧化酶(ACC)、肉毒碱棕榈酰转移酶1(CPT1)、SREBP1c、硬脂酰辅酶A去饱和酶1(Scd1)等抗体,辣根过氧化物酶标记的山羊抗兔IgG二抗、FITC标记的山羊抗兔IgG 荧光二抗(英国Abcam 公司);Hiscript Ⅲ逆转录试剂盒(南京诺唯赞生物科技股份有限公司);SYBR Green 定量PCR 试剂盒(上海联迈生物工程有限公司)。3100 全自动生化分析仪(日本日立公司);Ts2R 荧光显微镜(日本尼康公司);iMark680 多功能酶标仪、蛋白转膜装置(美国Bio-Rad 公司);ABI 7500 定量PCR 仪(美国Applied Biosystems公司)。
1. 3 分组、建模与给药将小鼠适应性喂养7 d后,随机分为正常组和造模组,正常组给予普通饲料喂养,造模组给予高脂饲料(按质量分数配比:78%基础饲料、15%猪油、1%胆固醇和6%蔗糖,由江苏省协同生物工程有限责任公司提供)喂养8 周制备NASH 模型[12]。8 周后,随机从造模组取出6只小鼠,处死后取肝脏制作病理切片,验证造模成功与否。结果显示,肝细胞胞质内见大小不一的球形脂滴空泡,且大量肝细胞伴有不同程度的炎症细胞浸润,说明模型构建成功[12]。将剩余造模成功的小鼠随机分为模型组,肉桂醛低、中、高剂量组及肉桂醛高剂量+Compound C组,每组15 只。肉桂醛低、中、高剂量组分别给予灌胃肉桂醛混悬液(0.5%羧甲基纤维素钠为溶剂)10、20、40 mg/kg[6],肉桂醛高剂量+Compound C 组给予灌胃40 mg/kg的肉桂醛混悬液及腹腔注射5 μmol/L的Compound C[11],每日1 次,持续12 周。正常组和模型组同期给予等体积的0.5%羧甲基纤维素钠混悬液灌胃和生理盐水腹腔注射。
1.4 观察指标与方法
1.4.1 生化指标分析 采用断颈法处死小鼠,取眼球血液,离心后,收集血清。应用ELISA 法检测AST、ALT、TG、TC 含量,严格按照试剂盒说明操作。将肝脏组织裂解、匀浆,以1 000g离心10 min,取上清,应用试剂盒检测MDA、SOD 和GSH水平。
1.4.2 形态学检测和NAFLD 评分 HE 染色:收集肝脏组织,用4%多聚甲醛固定,石蜡包埋、切片,HE染色。
油红O 染色:将冰冻切片用甲醛-钙固定15 min,去离子清洗,浸入60%异丙醇水溶液中,将去离子和油红以2∶3 混合,室温下放置10 min。油红O染色10 min,60%异丙醇水溶液分化,去离子水冲洗,苏木素复染,甘油明胶封片,显微镜下观察拍照。
Masson 染色观察肝脏纤维化程度。取肝组织石蜡切片(厚5 μm),常规脱蜡至水后,进行Masson 染色,二甲苯透明处理,中性树胶封片,置于显微镜下进行病理学检查。
根据HE 染色结果,通过Image ProPlus 计数炎症病灶以及肝细胞的脂肪变性面积。采用Li等[13]的NAFLD 评分标准,通过计数4 个参数计算每组小鼠的NAFLD 评分,包括大泡脂肪变性、微管脂肪变性、肝细胞肥大和炎症细胞聚集,结果见表1。NAFLD 评分由2 位经验丰富的病理学家对切片进行盲评。其中,NAFLD 评分≥5 分,诊断为NASH,评分≤2分,诊断为“非NASH”。

表1 非酒精性脂肪性肝病(NAFLD)评分Table 1 NAFLD scores
1.4.3 Western Blot分析 从肝脏组织中提取总蛋白,并用二喹啉甲酸(BCA)试剂盒测定蛋白浓度。提取的蛋白进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),并转移到聚偏氟乙烯(PVDF)上,5%脱脂牛奶封闭,室温孵育1 h。加入一抗p-AMPK(1∶1 000)、AMPK(1∶1 000)、p-ACC(1∶1 000)、ACC(1∶1 000)、CPT1(1∶500)、SREBP1c(1∶500)、Scd1(1∶1 000),4 ℃过夜。HRP 偶联的二抗(1∶2 000)在室温下孵育1 h,ECL显影,并使用ImageJ 软件检测蛋白条带灰度值,计算目的蛋白的相对表达水平,以GAPDH 为内参。蛋白相对含量=目的蛋白条带灰度值/内参GAPDH条带灰度值。
1.4.4 免疫荧光检测 将肝脏切片脱蜡、水化后进行抗原修复。用3%过氧化氢孵育10 min 灭活内源性过氧化物酶,1%山羊血清封闭后,与兔源一抗SREBP1c(1∶200)4 ℃孵育过夜。PBS 洗涤后,加入FITC 荧光标记的山羊抗兔IgG 二抗室温孵育1 h,切片用DAPI 染色5 min,固定。PBS 冲洗,用抗荧光淬灭剂封固后,荧光显微镜下成像。
1.4.5 RT-PCR 分析 应用TRIzol 从肝组织提取总RNA,使用Hiscript Ⅲ试剂盒将RNA 反转录为cDNA,采用2×SYBR 进行荧光定量PCR,检测基因表达。反应系统(20 μL):10 μL SYBR®Premix Ex TaqTM(2×)、0.8 μL PCR正向引物(10 μmol·L-1)、0.8 μL PCR 反向引物(10 μmol·L-1)、2 μL cDNA(200 ng·μL-1)和6.4 μL 无菌水。PCR 反应条件如下:95 ℃、30 s(预变性);95 ℃、5 s(变性),55 ℃、10 s(退火),72 ℃、15 s(延伸),共计40个循环。采用2-ΔΔCT法检测目的基因相对表达。引物序列见表2。所有引物由广州锐博生物科技有限公司合成。

表2 PCR引物序列Table 2 PCR primers sequence
1.5 统计方法采用SPSS 22.0统计软件进行数据的统计分析,以均数±标准差(±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血清生化指标水平比较表3 结果显示:与正常组比较,模型组小鼠ALT、AST、TG、TC 水平显著增加(P<0.05);与模型组比较,肉桂醛低、中、高剂量组小鼠ALT、AST、TG、TC水平显著降低(P<0.05),且呈剂量依赖性;与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C组ALT、AST、TG、TC水平显著增加(P<0.05)。
表3 各组小鼠血清生化指标水平比较Table 3 Comparison of blood biochemical levels among each group of mice(±s)
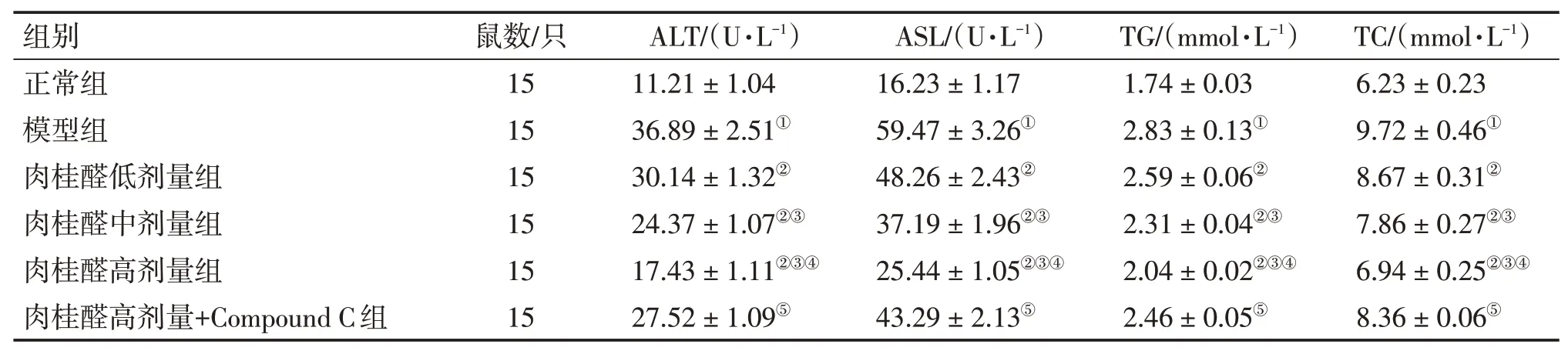
表3 各组小鼠血清生化指标水平比较Table 3 Comparison of blood biochemical levels among each group of mice(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与肉桂醛低剂量组比较;④P<0.05,与肉桂醛中剂量组比较;⑤P<0.05,与肉桂醛高剂量组比较
?
2.2 各组小鼠肝组织中氧化应激指标水平比较表4结果显示:与正常组比较,模型组小鼠肝组织MDA水平显著升高,SOD、GSH水平显著降低(P<0.05);与模型组比较,肉桂醛低、中、高剂量组MDA 水平显著降低(P<0.05),SOD、GSH 水平显著升高,且呈剂量依赖性;与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C 组MDA 水平显著升高,SOD、GSH水平显著降低(P<0.05)。
表4 各组小鼠肝组织MDA、SOD、GSH水平比较Table 4 Comparison of MDA,SOD and GSH levels in liver tissues among each group of mice(±s)

表4 各组小鼠肝组织MDA、SOD、GSH水平比较Table 4 Comparison of MDA,SOD and GSH levels in liver tissues among each group of mice(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与肉桂醛低剂量组比较;④P<0.05,与肉桂醛中剂量组比较;⑤P<0.05,与肉桂醛高剂量组比较
?
2.3 各组小鼠肝组织形态学检测和NAFLD 评分比较HE 染色和油红O 染色观察到,模型组小鼠肝脏脂肪变性,Masson 染色发现肝脏纤维化。与正常组比较,模型组小鼠肝脂沉积和纤维化显著增加;与模型组比较,肉桂醛低、中、高剂量组肝脂沉积和纤维化显著减少,且呈剂量依赖性;与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C组肝脂沉积和纤维化显著增加。见图1。
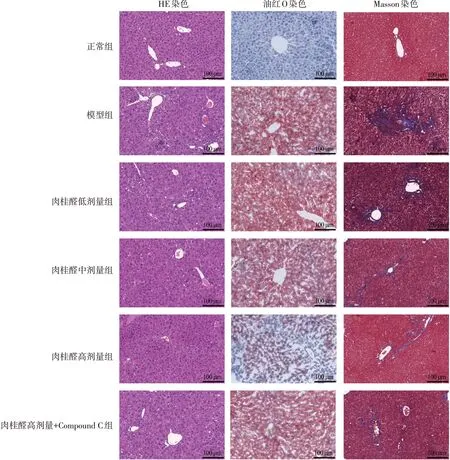
图1 各组小鼠肝脏组织病理表现(×200)Figure 1 Histopathological manifestations of liver tissues in each group of mice(×200)
NAFLD 评分结果显示:与正常组比较,模型组小鼠NAFLD评分显著增加(P<0.05);与模型组比较,肉桂醛低、中、高剂量组小鼠NAFLD 评分显著降低(P<0.05),且呈剂量依赖性;与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C 组NAFLD评分显著增加(P<0.05)。见表5。
表5 各组小鼠肝损伤评分比较Table 5 Comparison of liver injury scores among each group of mice(±s)

表5 各组小鼠肝损伤评分比较Table 5 Comparison of liver injury scores among each group of mice(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与肉桂醛低剂量组比较;④P<0.05,与肉桂醛中剂量组比较;⑤P<0.05,与肉桂醛高剂量组比较
?
2.4 各组小鼠肝组织p-AMPK、AMPK、p-ACC、ACC、 CPT1、 SREBP1c、 Scd1 蛋白表达比较Western Blot 结果显示:与正常组比较,模型组小鼠p-AMPK/AMPK、p-ACC/ACC、CPT1 表达水平显著降低,SREBP1c、Scd1 表达水平显著升高(P<0.05);与模型组比较,肉桂醛低、中、高剂量组小鼠p-AMPK/AMPK、p-ACC/ACC、CPT1 表达水平显著升高,SREBP1c、Scd1 表达水平显著降低(P<0.05);与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C 组p-AMPK/AMPK、p-ACC/ACC、CPT1 表达水平显著降低,SREBP1c、Scd1表达水平显著升高(P<0.05)。见图2和表6。
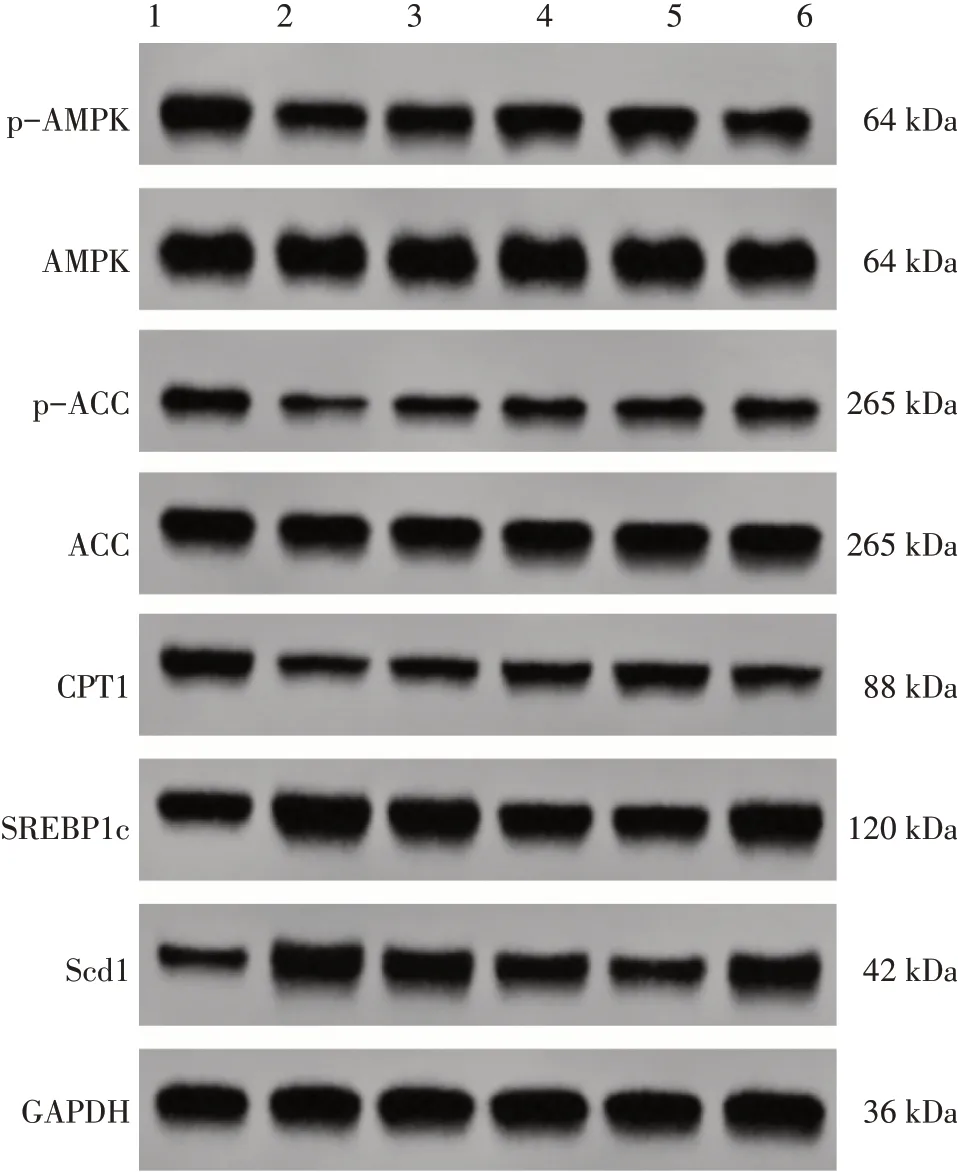
图2 各组小鼠肝组织p-AMPK、AMPK、p-ACC、ACC、CPT1、SREBP1c、Scd1蛋白的Western Blot条带Figure 2 Western Blot bands of p-AMPK,AMPK,p-ACC,ACC,CPT1,SREBP1c and Scd1 proteins in the liver tissues
表6 各组小鼠肝组织p-AMPK、AMPK、p-ACC、ACC、CPT1、SREBP1c、Scd1的蛋白相对表达量比较Table 6 Comparison of relative protein expressions of p-AMPK,AMPK,p-ACC,ACC,CPT1,SREBP1c,Scd1 in liver tissues among each group of rats(±s)
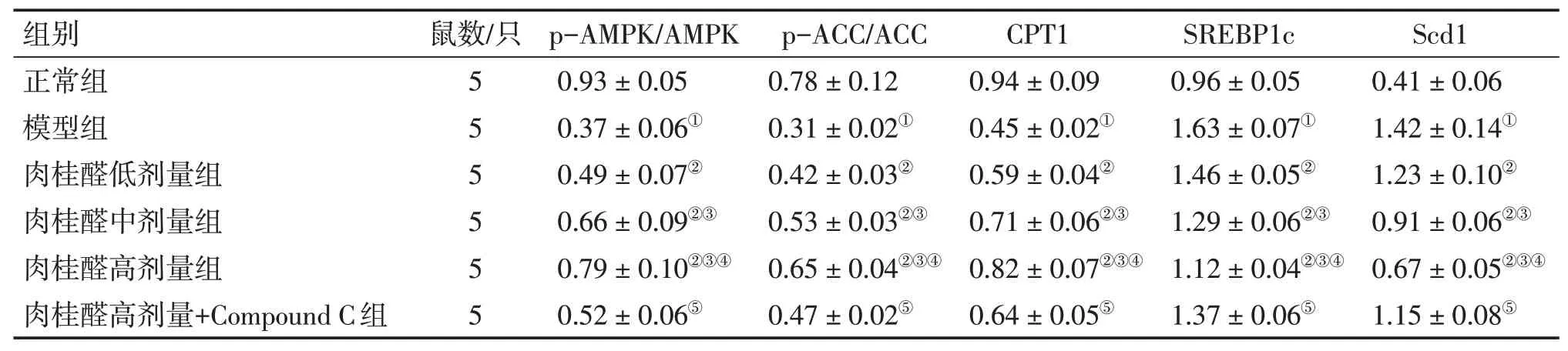
表6 各组小鼠肝组织p-AMPK、AMPK、p-ACC、ACC、CPT1、SREBP1c、Scd1的蛋白相对表达量比较Table 6 Comparison of relative protein expressions of p-AMPK,AMPK,p-ACC,ACC,CPT1,SREBP1c,Scd1 in liver tissues among each group of rats(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与肉桂醛低剂量组比较;④P<0.05,与肉桂醛中剂量组比较;⑤P<0.05,与肉桂醛高剂量组比较
?
免疫荧光染色结果显示:SREBP1c 阳性表达呈绿色。与正常组比较,模型组SREBP1c 阳性细胞显著增多;与模型组比较,肉桂醛低、中、高剂量组SREBP1c 阳性细胞显著减少;与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C 组SREBP1c阳性细胞显著增多。见图3。

图3 SREBP1c在各组小鼠肝脏组织中的表达(×200)Figure 3 Expression of SREBP1c in liver tissues of each group of mice(×200)
2.5 各组小鼠肝组织CPT1α、Lcad、ACC1、FAS的mRNA表达水平比较表7结果显示:与正常组比较,模型组小鼠肝组织CPT1α、Lcad 的mRNA表达水平显著降低,ACC1、FAS 的mRNA 表达水平显著增高(P<0.05);与模型组比较,肉桂醛低、中、高剂量组小鼠CPT1α、Lcad 的mRNA 表达水平显著升高,ACC1、FAS 的mRNA 表达水平显著降低(P<0.05),且呈剂量依赖性;与肉桂醛高剂量组比较,肉桂醛高剂量+Compound C 组CPT1α、Lcad的mRNA表达水平显著降低,ACC1、FAS的mRNA表达水平显著升高(P<0.05)。
表7 各组小鼠肝组织CPT1α、Lcad、ACC1、FAS的mRNA表达水平比较Table 7 Comparison of mRNA expression levels of CPT1α,Lcad,ACC1 and FAS in live tissues among each group of rats(±s)
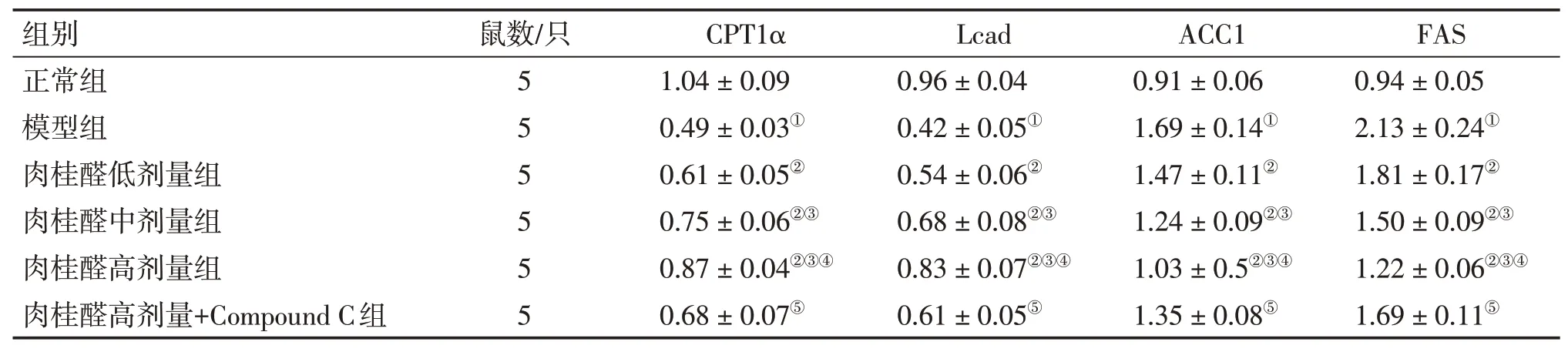
表7 各组小鼠肝组织CPT1α、Lcad、ACC1、FAS的mRNA表达水平比较Table 7 Comparison of mRNA expression levels of CPT1α,Lcad,ACC1 and FAS in live tissues among each group of rats(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与肉桂醛低剂量组比较;④P<0.05,与肉桂醛中剂量组比较;⑤P<0.05,与肉桂醛高剂量组比较
?
3 讨论
非酒精性脂肪性肝炎(NASH)的患病率随着肥胖和糖尿病的增加而上升[14]。脂质代谢失调是NASH 发生的主要原因之一,脂肪酸和TG 合成增加、代谢减少,导致TG 和TC 在肝脏中堆积过度[15]。相关研究表明,肝脏脂质沉积异常可产生毒性作用,易引起非酒精性脂肪性肝病(NAFLD)[16]。此外,NASH 中TG 和TC 含量过高,ALT 和AST 水平升高[17]。本研究中,高脂饲料喂养的小鼠肝脏TG和TC浓度及ALT和AST水平显著升高。肝脏组织病理性结果显示,NASH小鼠肝脏脂肪变性,肝脂沉积和纤维化显著增加,NAFLD 评分显著升高,表明模型构建成功。本研究中,肉桂醛治疗可改善NASH 模型小鼠肝脏脂质积累,降低TG 和TC 浓度及ALT 和AST 水平。提示肉桂醛可减轻肝脏脂肪变性,改善NASH小鼠肝损伤。此外,脂质异常积累引起的氧化应激被认为是NASH发生发展的一个重要起始因素;氧化应激增加能促进脂质过氧化过程,加重肝损伤[18]。本研究中,高脂饲养诱导的NASH 小鼠肝组织中脂质过氧化产物MDA水平升高,自由基清除剂SOD 活性和GSH 水平降低,表明NASH小鼠肝组织中氧化应激增强,而给予肉桂醛干预后,MDA 水平降低,SOD 活性和GSH水平升高,提示肉桂醛可降低NASH小鼠肝组织中氧化应激水平,发挥肝保护作用。
腺苷酸激活蛋白激酶(AMPK)是一种三聚体蛋白激酶,通过脂质代谢刺激大分子分解产生能量,是机体和细胞能量代谢的主要调节器。研究[19-20]表明,在肝脏组织中,AMPK 的激活可使乙酰辅酶A羧化酶(ACC)磷酸化,降低丙二酰CoA的表达,从而缓解肉毒碱棕榈酰转移酶1(CPT1)的抑制,促进脂肪酸氧化,降低血清游离脂肪酸含量,降低脂肪在组织的沉积,改善脂代谢。此外,胆固醇调节元件结合蛋白1(SREBP1)是AMPK下游的关键蛋白,是脂质代谢的关键调节因子,磷酸化的ACC 又可进一步抑制下游SREBP1 的表达,TG 的合成和代谢受SREBP1 的转录调控,SREBP1 与固醇反应元件(SRE)结合后,可激活下游与脂质合成有关的关键酶,如脂肪酸合成酶(FAS)、ACC1、硬脂酰辅酶A 去饱和酶1(Scd1)等,其中ACC 催化乙酰辅酶A 形成丙二酰辅酶A,合成长链脂肪酸前体,FAS催化乙酰辅酶A和丙二酰辅酶A,参与长链脂肪酸生成的内源性蛋白酶[21-22]。Scd1 介导肝脏脂质代谢,在NAFLD 患者和高脂饮食诱导的小鼠肝脏中的表达增加,促进肝脂肪变性[23]。激活AMPK减少SREBP1c及其下游的脂肪生成酶,从而改善脂质氧化,并减少胆固醇、TG合成和肝脏中的脂质积累[24]。本研究结果显示:高脂饲养喂养后,NASH小鼠肝脏中p-AMPK/AMPK、p-ACC/ACC、CPT1表达显著降低,SREBP1c及其下游Scd1 的表达显著增加;肉桂醛治疗后,NASH 小鼠肝脏中p-AMPK/AMPK、p-ACC/ACC、CPT1 表达增加,SREBP1c 和Scd1 表达显著降低,且肉桂醛能减少肝组织细胞核中SREBP1c 阳性表达,抑制核SREBP1c 激活。提示肉桂醛可能通过调控AMPK/SREBP1c通路,影响脂肪酸氧化。
此外,本研究还分析了与脂肪酸代谢密切相关的基因表达情况。ACC1是一种合成ACC合酶的基因,定位于细胞质中,生成的丙二酰CoA 用于脂肪酸合成;FAS 为一种合成脂肪酸的关键酶,ACC1 和FAS 用于评估脂肪酸的合成[25];CPT1α 和长链酯酰辅酶A脱氢酶(Lcad)是脂肪酸β氧化的关键酶[13]。本研究结果表明,肉桂醛可通过增加ACC1和FAS的mRNA表达,降低CPT1α和Lcad 的mRNA表达,影响脂肪酸代谢。
为明确AMPK/SREBP1c 通路是否参与肉桂醛对NASH小鼠肝组织中脂质积累的影响,本研究在肉桂醛干预的基础上,使用AMPK/SREBP1c 通路抑制剂Compound C 进行进一步验证。结果显示,Compound C 降低了AMPK 及其磷酸化表达,并增强了SREBP1c 及其靶基因的表达,减弱了肉桂醛对NASH 小鼠肝组织的保护作用,证实肉桂醛可能通过激活AMPK、抑制SREBP1c,减轻NASH肝损伤。
综上所述,肉桂醛可有效减轻NASH小鼠肝损伤,其机制可能与通过调控AMPK/SREBP1c 通路,抑制氧化应激,改善肝脏脂肪变性有关。
