益母草注射液水溶性总生物碱对产后子宫复旧中子宫收缩活动的影响*
2024-01-22武柳君代良萍谢晓芳
武柳君,代良萍,谢晓芳**,彭 成**
(1.成都中医药大学药学院西南特色中药资源国家重点实验室 成都 611137;2.西南医科大学附属医院 泸州 646000)
产后出血(Postpartum haemorrhage,PPH)是指经阴道分娩胎儿后24 h 内出血量超过500 mL 或者剖宫产胎儿娩出后24 h 内出血量超过1000 mL[1]。PPH 是产科常见危重并发症,也是全世界范围内导致孕产妇死亡的首位原因,占比高达27%[1-2];在我国,这一占比同样达到了25%[3]。子宫肌层收缩对大血管的机械性紧缩阻塞是防止子宫出血的主要机制[4]。故子宫收缩乏力是引发PPH 的四大原因之首,具有出血量大、发病急、预后差等特点[5]。在大型国际WOMAN’s 实验中,由子宫收缩乏力造成的PPH占到了63.7%[6]。宫缩药物是治疗PPH 的基石,能够有效降低PPH 的发生率,WHO 建议所有孕产妇在第三产程期间使用有效的宫缩药物以预防PPH[7]。在所有宫缩药物中,缩宫素是预防和治疗PPH 的首选药物,因其副作用最小且效益最高而在世界范围内受到广泛的认可和使用。缩宫素类似物卡贝缩宫素以及米索前列醇、麦角新碱等二线药物因具有更高的潜在风险,通常仅在无法使用缩宫素的情况下建议使用[8]。尽管是目前最为安全有效的宫缩药物,催产素的使用依然存在许多限制。催产素的血浆半衰期范围为3-20 min[9],需要连续小剂量静脉滴注才能达到持续的宫缩活性。此外,缩宫素还具有受体饱和现象[1],并可造成母体催产素受体的下调[10]。大剂量或快速推注催产素以及其余潜在因素可能引发诸多不良反应[11]。
益母草(Leonurus japonicusHoutt.)具有活血调经、利尿消肿、清热解毒功效,用于月经不调、经闭痛经、恶露不尽、水肿尿少、疮疡肿痛[12],《本草纲目》称之为“血家圣药”[13]。有关实验显示,益母草对子宫平滑肌(Uterine smooth muscle,USM)具有双向调节作用[14],其中的生物碱类成分能够显著促进子宫收缩[15],是一种良好的天然宫缩药物。益母草注射液(Yimucao Injection,YI)是益母草的单方制剂[16],是用于产后出血和产后子宫复旧的专家推荐用药。大量临床研究文献报道,YI 单独应用或与其他宫缩药物联合应用于PPH,可明显减少产后出血量,促进产后子宫复旧,缩宫效果持久,且药物安全性良好[17-22]。相关文献引用证实,YI 是目前妇产科临床常用的中药注射剂,但有关YI的有效物质及其促进子宫复旧的基础研究不足。水溶性生物碱是益母草发挥药效的主要物质基础。而YI由益母草单味药材经水煎、醇沉、活性炭脱色、精滤等加工制得,除水溶性生物碱外,还含有其他成分及辅料。前期研究表明,YI水溶性生物碱部位是兴奋子宫的活性部位,可明显增强正常大鼠离体子宫收缩活动[23-25],同时也是发挥止血作用的活性部位[26]。据此,为明确益母草注射液水溶性总生物碱(YITA)与缩宫功效的关系及其促进产后复旧的药效作用,并为团队后期对益母草药材的研究提供参考。故本研究团队在前期研究基础上,制备YITA 作为研究对象,采用豚鼠流产模型,观察YITA 对产后出血量、子宫重量、性激素水平和相关指标的影响;为进一步明确其对子宫收缩活动的影响,采用豚鼠离体和在体USM 模型,观察对子宫收缩活动力、收缩频率,收缩强度等的影响,从而系统探讨YITA 对产后子宫复旧中子宫收缩活动的影响,通过研究,为YI 的临床应用和二次开发提供依据。
1 材料
1.1 药物
益母草注射液(Yimucao Injection,YI),批号:Y140801,由成都第一制药有限公司提供。为排除非水溶性生物碱部位及辅料的干扰,采用阳离子交换树脂纯化法从益母草注射液中制备益母草注射液水溶性总生物碱,含水苏碱34.49%、葫芦巴碱0.14%。因研究对象为水溶性总生物碱部位,故采用去离子水配制相应浓度应用液。
1.2 动物
Hartley豚鼠,雌性,性成熟而未生育,体质量400-450 g;雄性16 只,性成熟,体质量400-450 g,SPF 级,均由北京维通利华实验动物技术有限公司提供,动物生产合格证号:SCXK(京)2012-0001。饲养于成都中医药大学药学院实验动物房,温度22-28℃,相对湿度50%,通风良好,进食、饮水自由。动物实验经成都中医药大学实验动物伦理委员会批准(TCM-2016-312)。
1.3 试剂
戊酸雌二醇片(DELPHARM Lille S.A.S,批号:151A);NaCl(成都市科龙化工试剂公司,批号:20130613);KC1(成都市科龙化工试剂公司,批号:20120427);CaCl2(成都市科龙化工试剂公司,批号:20130724);NaHCO3(成都市科龙化工试剂公司,批号:20130409);无水葡萄糖(成都市科龙化工试剂公司,批号:20110331),采用去离子水配置洛氏液(1000 mL含NaCl 9.2 g、KC1 0.42 g、CaCl20.24 g、NaHCO30.15 g、葡萄糖1.0 g);水合氯醛(成都市科龙化工试剂厂,批号:20111123 用生理盐水配成10%);氯化钠注射液(四川科伦药业股份有限公司,批号:T16090101-2)。米非司酮(华润紫竹药业有限公司,批号:43150510 临用前以蒸馏水溶解配置成悬液3.0 mg·mL-1),米索前列醇片(华润紫竹药业有限公司,产品批号:4315041临用前以蒸馏水溶解配置成悬液0.04 mg·mL-1),豚鼠内皮素1(ET-1)试剂盒(武汉伊莱瑞特有限公司,批号:AK0016JU26001);Ca 试剂盒(南京建成生物工程研究所,批号:C004-2);雌激素/雌二醇(E2)试剂盒(武汉伊莱瑞特有限公司,批号:AK0016AUG19001);孕激素/孕酮(P)试剂盒(武汉伊莱瑞特有限公司,批号:AK0016AUG26011);考马斯亮蛋白试剂盒(南京建成生物工程研究所,批号:A045-2);NO 试剂盒(南京建成生物工程研究所,批号:A012)。
1.4 仪器
电子分析天平(德国sartorius公司,型号:11D);高效液相色谱仪(Agilent 公司,型号:1260);十六通道生理记录系统(澳大利亚Powerlab 公司,型号:P13516);离体组织灌流系统(澳大利亚Powerlab 公司,型号:ML0186);生物机能系统(成都泰盟科技有限公司公司,型号:BL-420E);张力换能器(成都泰盟科技有限公司公司,型号:JH-2);全波长多功能读数仪(美国Thermo 公司,型号:VARIOSKAN FLASH 2.4.3);二氧化碳培养箱(美国Thermo公司,型号:3111)。
2 方法
2.1 豚鼠流产实验
取处于动情期的豚鼠于每日20∶00 时雌雄按2∶1比例合笼,次日晨观察阴道栓及进行阴道涂片检查,以发现阴道栓子或游动精子为受孕成功,记为妊娠第1 天。于第7 天分别按体质量灌胃(i.g.)米非司酮8.3 mg·kg-1(8∶00)和米索前列醇100 μg·kg-1(18∶00),引起不完全流产[27]。将造模成功后豚鼠随机分为模型对照组(n=8)和YITA 组(n=10)。造模成功后,次日(第8天)模型组分别i.g.10 mL·kg-1的蒸馏水,YITA 组(0.17 g·kg-1)均等体积i.g.给药,每天1 次,连续7 天。在给予米索前列醇的同时,于豚鼠阴道内置入定量棉球1个(棉球重85-90 mg),用塑料薄膜包裹半侧,以防血液漏出和尿液返流。次日分别于8∶00 和20∶00 将棉球取出,放入塑料袋中密闭冷藏保存,同时置换一个新棉球于阴道内,观察记录阴道出血情况,连续至第14 天,将收集的每鼠阴道棉球进行出血量测定[27]。采集豚鼠眼眶静脉血20 μL,加入4 mL 5% NaOH(V1)中,混匀备用。并将收集的每只豚鼠的子宫出血棉球置于烧杯中,根据出血量的情况加适量5% NaOH(V2),浸渍提取一段时间后浸泡挤压搓洗棉球血渍,至血液完全浸出,过滤即得子宫浸提液。以50 g·L-1NaOH 为空白对照,用紫外-可见分光光度计在546 nm波长下测定浸提液以及豚鼠静脉血的吸光度值(A2、A1)。最后,根据公式计算子宫出血量[28]。子宫出血量(mL)=静脉血量×(A2×V2)/(A1×V1),其中V1、V2分别为稀释静脉血及浸提子宫血所用NaOH的体积。
用药结束后(妊娠第15 天)每组取8 只,股动脉取血,收集血液,离心分离血清,按照ELISA 试剂盒说明书检测血清雌二醇(Estradiol, E2)、孕酮(Progesterone,P)水平。股动脉采血后,将豚鼠仰卧固定于手术台上,小心剖腹,观察子宫形态变化,用镊子夹住子宫角游离端时,剥离子宫周围脂肪等结缔组织。取出子宫称重并计算子宫比重系数。子宫比重(g/g)=子宫质量(g)/动物体质量(g)。取子宫样本适量,于冰浴条件下按质量(g)∶体积(ml)=1∶9的比例加入9倍体积的冰生理盐水,制成10%的匀浆液,将匀浆液在2500 r·min-1条件下,离心15 min,取上清液进行测定。分别采用微板法、ELISA 法、硝酸还原酶法检子宫匀浆组织Ca2+、ET-1、NO水平,严格按照试剂盒说明书操作。
2.2 豚鼠离体USM实验
取健康、成年雌性未孕豚鼠,在实验前2日灌胃戊酸雌二醇8 mg·kg-1,以造成动情期。于第3 天颈椎脱臼处死动物,迅速剖取子宫置于盛有洛氏液的玻璃皿中,轻轻剥离子宫上附有的结缔组织和脂肪组织。取子宫中间段2-3 cm,即为离体USM 肌条,一端固定于盛有洛氏液20 mL的浴槽,另一端连接张力换能器,浴槽中营养液保持(37.0±0.5)℃,并通以(95% O2+5%CO2)的混合气体,每秒1-2 个小气泡,前负荷1 g。用十六通道生理记录系统记录离体USM 肌条收缩曲线[29-30]。待曲线稳定后,依次加入YITA0.05 mg·mL-1、0.1 mg·mL-1、0.2 mg·mL-1(20 μL、40 μL、80 μL),去离子水20 μL、40 μL、80 μL 每次给药后,观察记录10 min内USM 收缩曲线,然后用洛氏液清洗USM3次,待USM 收缩稳定后,进行第2 次给药。比较给药前后USM 收缩活动力、频率和张力、幅度的变化。计算方法如下:活动力=平均收缩张力×收缩频率,幅度=收缩张力最大值-收缩张力最小值。上述指标均转化为给药前后变化百分率,再用归一化法对数据进行去量纲处理,使得每个指标均转化为0-1之间的“归一值”,如下:变化率(Δt)=(给药后—给药前)/给药前×100%,归一值(Msample)=(Δtsample-Δtmin)/( Δtmax-Δtmin)
2.3 豚鼠在体USM实验
取健康、成年雌性未孕豚鼠,实验前2日每日灌胃戊酸雌二醇片8 mg·kg-1造成动情期,以提高USM 对药物的敏感性。实验前一晚禁食12 h,次日,各组动物按照肌注10%水合氯醛0.4 mL·100 g-1麻醉,仰位固定于手术台,下腹部剪毛,作4-5 cm 长正中切口。打开腹腔,找出子宫,在其一侧子宫角选取长3 cm 的一段,将子宫角的阴道端和卵巢端分别缝合在特制的塑料T型支架底部的两端支点上。在已固定好的子宫两支点中点缝一棉线,从塑料管中引出,与肌张力传感器连接,然后将腹壁围绕塑料筒底部四周缝合,静止张力1 g[31-33]。待在体USM 收缩稳定后,经豚鼠左后肢腿部肌群肌内注射(im)给药。空白组im 生理盐水(0.5 mL·kg-1)、各给药组分别imYITA 低、中、高剂量(10、20、40 mg·kg-1),记录给药后0-90 min 豚鼠USM活动曲线,并计算给药后各组药物对在体USM 收缩活动力、频率和张力(最大值、最小值、平均值)的抑制率(Δt),计算方法如下:抑制率(Δt)=(给药前—给药后)/给药前×100%。
2.4 统计学分析
实验数据采用SPSS 19.0建立数据库后进行分析,实验结果以均值±标准差(±s)表示,以独立样本t检验、配对样本t检验和单因素方差分析进行多组间差异的比较,P<0.05认为具有统计学差异。
3 结果
3.1 对豚鼠流产的影响
3.1.1 对豚鼠流产子宫出血量和子宫湿重的影响
与模型组相比,YITA 组豚鼠子宫出血量降低,但差异不具有显著性(P>0.1);其子宫脏器比重系数显著降低(P<0.001),结果见表1。
表1 YITA对豚鼠流产子宫出血量和子宫比重的影响(±s,n=8)
注:与模型组比较,***P<0.001;子宫比重(g/g)=子宫质量(g)/动物体质量(g)。
子宫比重(g/g)0.039±0.0012 0.028±0.0004***组别模型YITA剂量(g·kg-1)-0.17子宫出血量(mL)0.024±0.010 0.020±0.008
3.1.2 对流产豚鼠血浆E2和P水平的影响
与模型组相比,YITA 组豚鼠血浆E2含量降低,但差异不具有显著性(P>0.1);其血浆P含量则显著降低(P<0.01)。结果见表2。
表2 YITA对豚鼠流产子宫血浆E2和P含量的影响(±s,n=8)

表2 YITA对豚鼠流产子宫血浆E2和P含量的影响(±s,n=8)
注:模型组比较,**P<0.01。
P(ng·mL-1)32.30±12.39 4.79±1.48**组别模型YITA剂量(g·kg-1)-0.17 E2(Pg·mL-1)157.39±54.94 114.69±46.72
3.1.3 对豚鼠流产子宫组织中NO、ET-1 和Ca2+含量的影响
与模型对照组相比,YITA 组豚鼠子宫组织匀浆Ca2+浓度有提高趋势(P>0.05);ET-1含量降低,但差异不具有显著性(P>0.1);NO 含量显著降低(P<0.01);ET/NO 比值显著提高(P<0.001),具体结果见表3与图1。
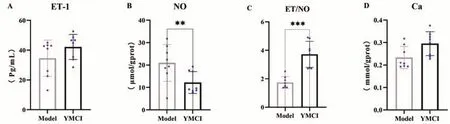
图1 YITA对豚鼠流产子宫组织钙、NO和ET-1含量的影响
表3 YITA对豚鼠流产子宫组织Ca2+、ET-1、NO含量和ET/NO比值的影响(±s,n=8)

表3 YITA对豚鼠流产子宫组织Ca2+、ET-1、NO含量和ET/NO比值的影响(±s,n=8)
注:与模型组比较,**P<0.01,***P<0.001。
ET/NO 1.74±0.41 3.72±0.91***组别模型YITA剂量(g·kg-1)-0.17钙(mmol·gprot-1)0.23±0.049 0.30±0.053 ET(Pg·mL-1)34.59±12.20 42.15±8.44 NO(μmol·gprot-1)20.96±8.22 12.21±4.89**
3.2 YITA对豚鼠离体USM活动的影响
经归一化处理后,各项指标“归一值”均在0-1 区间。给予去离子水20、40 μL 后,豚鼠USM 收缩活动力、平均值和最大值均表现为抑制,给予去离子水20、80 μL 后豚鼠USM 收缩频率表现为抑制。而经YITA给药后,除收缩平均值在终浓度200 mg·L-1处表现为抑制外,各浓度下豚鼠USM 收缩活动力、频率、平均值、最大值和幅度均表现为促进。其中,与对应空白组(给予等量去离子水)相比,50、100 mg·L-1的YITA能够显著提高豚鼠USM 收缩活动力(P<0.05);50 mg·L-1的YITA 对收缩频率、平均值和幅度有提高趋势(P分别为0.0895、0.0654、0.0863,<0.1);100 mg·L-1的YITA 对收缩平均值和最大值有提高趋势(P分别为0.0569、0.0734,<0.1);200 mg·L-1的YITA 对收缩频率有提高趋势(P=0.0745<0.1)。给予去离子水或YITA 后,豚鼠USM 收缩最小值均表现为抑制;与对应空白相比,200 mg·L-1的YITA 能够显著降低豚鼠USM 收缩最小值(P<0.05)。具体结果见图2。相关收缩曲线见图3。
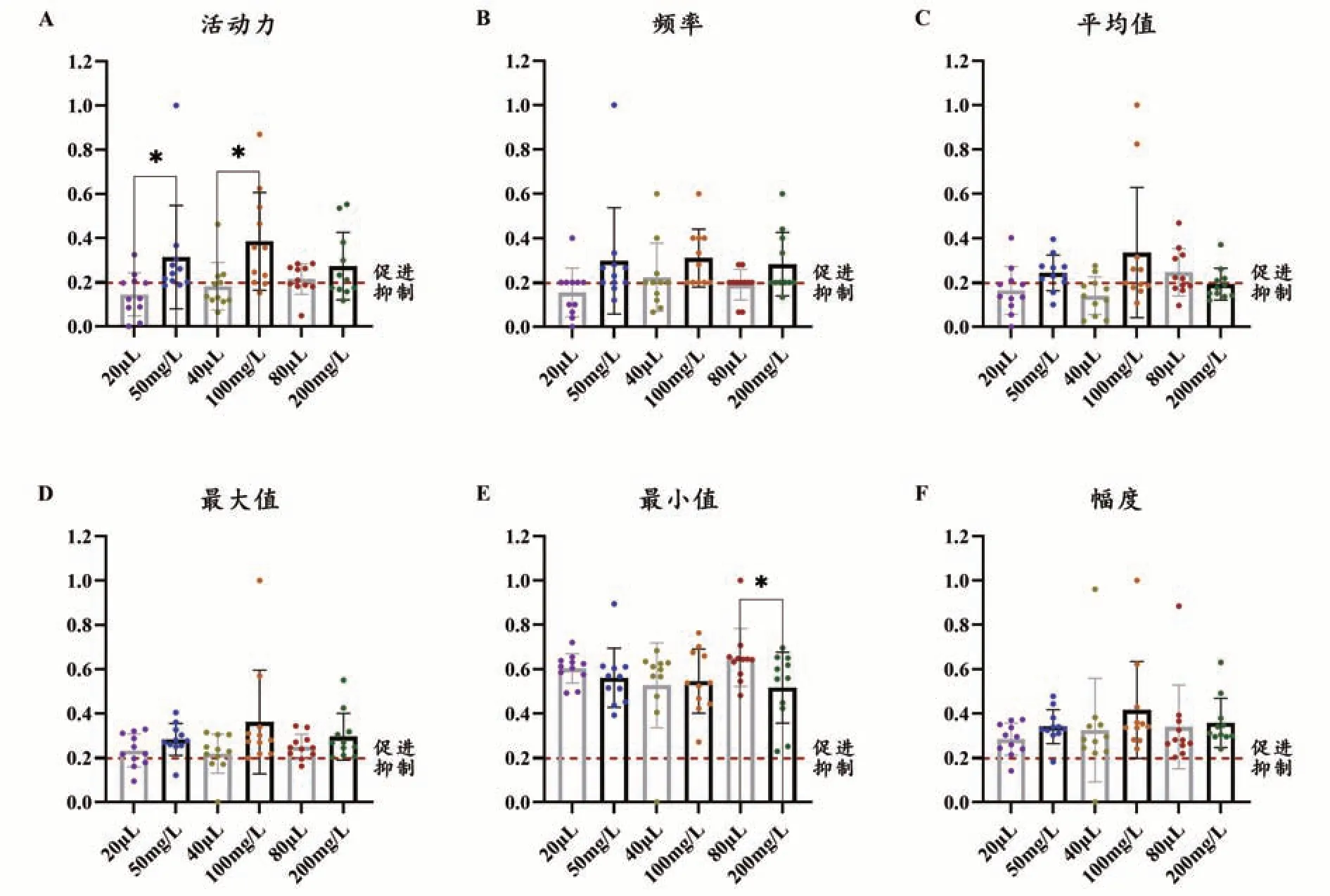
图2 YITA对豚鼠离体USM活动的影响(n=11)
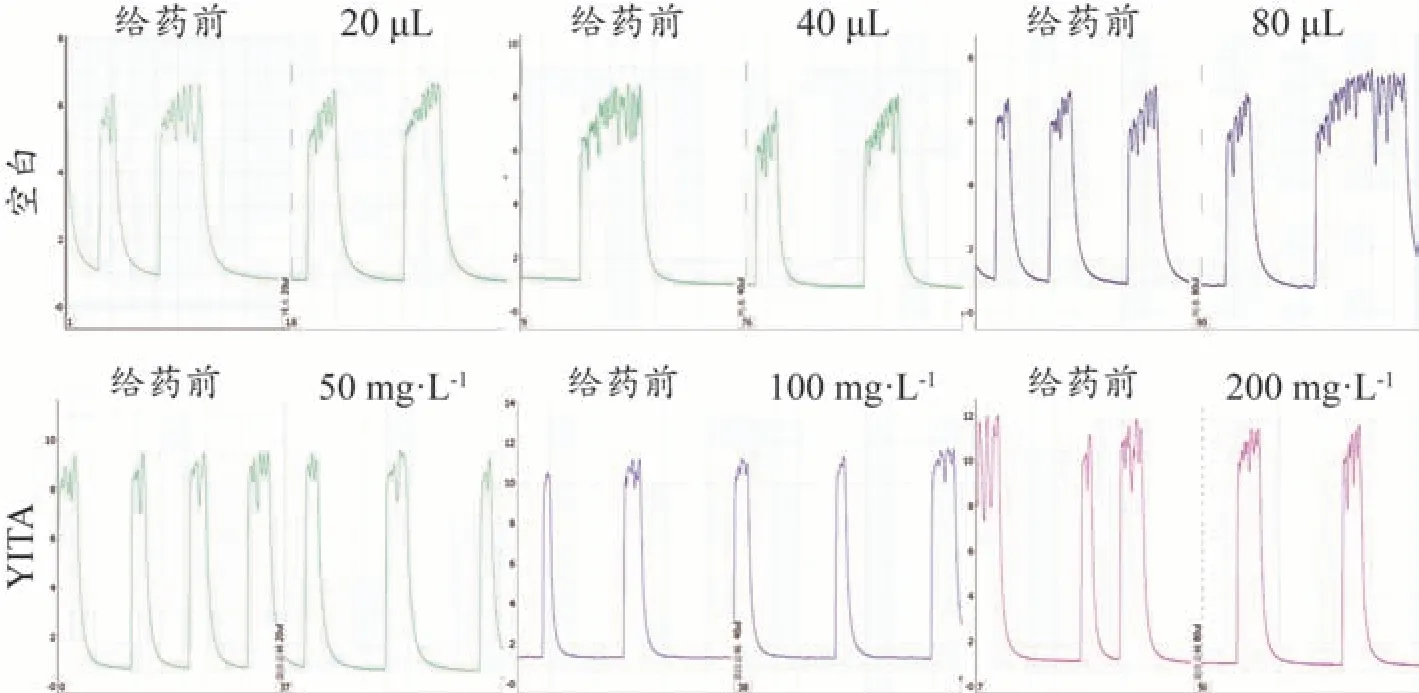
图3 YITA作用豚鼠离体USM的活动曲线图
3.3 YITA对豚鼠在体USM活动的影响
3.3.1 对收缩活动力的影响
与给药前相比空白组的豚鼠子宫收缩活动力在实验90 min 内总体表现为抑制;im YITA 后,豚鼠子宫收缩活动力总体表现为促进。与空白组相比,在20-40 min 时段40 mg·kg-1组豚鼠USM 收缩活动力有提高 趋 势(P分别为0.0635、0.0606,<0.1);在80-90 min 时段,40 mg·kg-1组活动力显著提高(P<0.05),10 mg/kg 组活动力有提高趋势(P=0.0569<0.1)。结果见图4A。
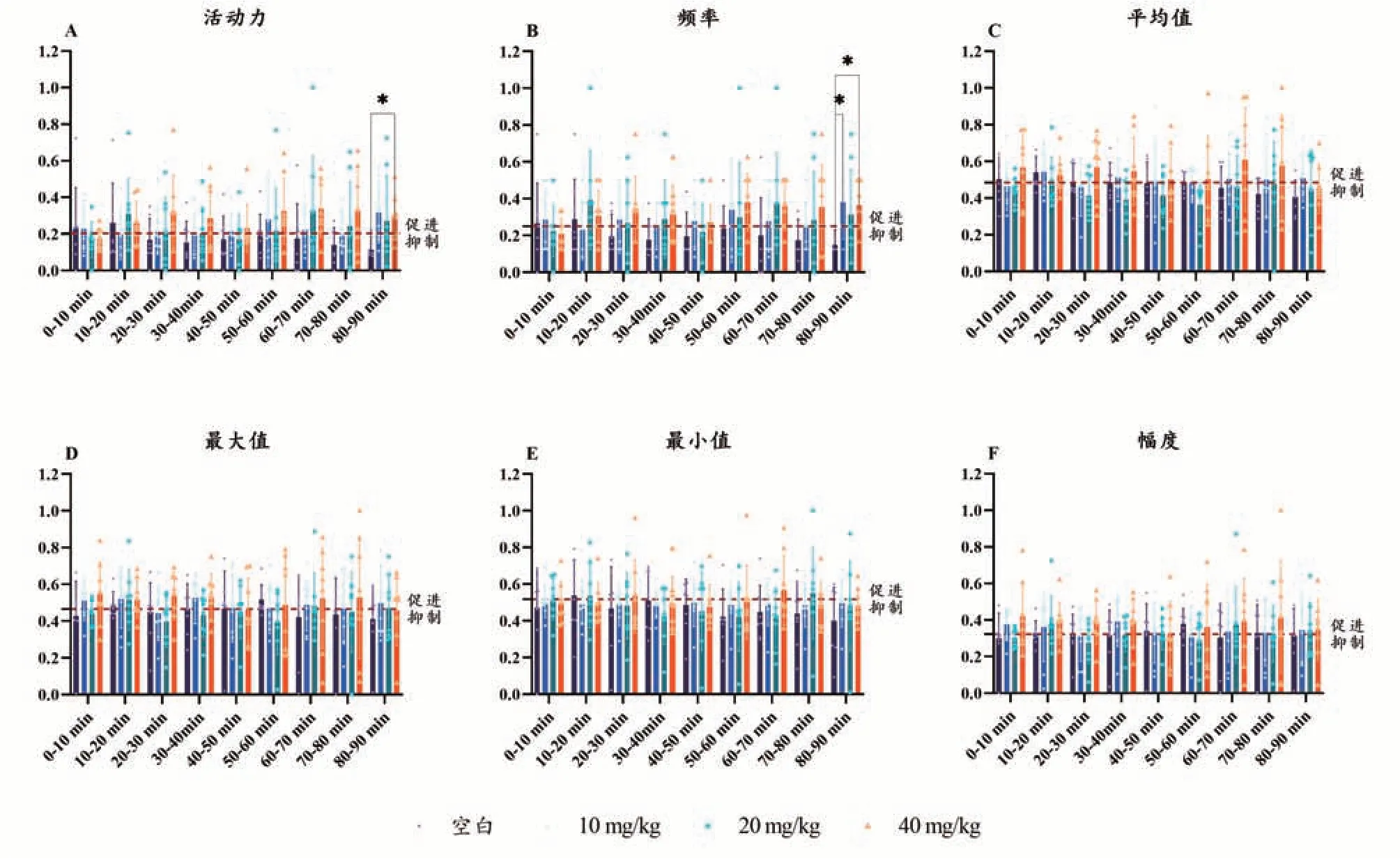
图4 YITA对豚鼠在体USM活动的影响
3.3.2 对收缩频率的影响
与给药前相比,空白组豚鼠子宫收缩频率在90 min 内总体表现为抑制;im YITA 后,豚鼠子宫收缩频率总体表现为促进。与空白组相比,在20-40 min、70-80 min 时段40 mg·kg-1组豚鼠USM 收缩频率有提高趋势(P分别为0.0933、0.0879、0.0775,<0.1);在60-70 min、80-90 min 时段20 mg·kg-1组频率有提高趋势(P分别为0.0898、0.0699,<0.1);在80-90 min 时段,10、40 mg·kg-1组频率显著提高(P<0.05)。结果见图4B。
3.3.3 对收缩张力的影响
与给药前相比,空白组豚鼠子宫收缩张力平均值在90 min 内总体表现为抑制;im YITA 后,20 mg·kg-1组豚鼠USM 收缩张力平均值总体表现为抑制;10、40 mg·kg-1组平均值总体表现为促进。各给药组豚鼠USM 收缩张力平均值与空白组相比,不具有显著性差异(P>0.1)。与给药前相比,空白组豚鼠子宫收缩张力平均值和最大值在90 min 内总体表现为抑制;im YITA 后,20 mg·kg-1组豚鼠USM 收缩张力平均值和最大值总体表现为抑制;10、40 mg·kg-1组平均值和最大值总体表现为促进。各给药组豚鼠USM 收缩张力平均值和最大值与空白组相比,不具有显著性差异(P>0.1)。与给药前相比,空白组与各给药组豚鼠子宫收缩张力最小值在90 min 内均表现为抑制;各给药组与空白组间不具有显著性差异(P>0.1)。对于豚鼠子宫收缩幅度,空白组与YITA 20 mg·kg-1组无明显作用趋向;10、40 mg·kg-1组对幅度的作用总体表现为促进,各给药组与空白组间不具有显著性差异(P>0.1)。结果见图4C、D、E、F。各组的豚鼠在体子宫收缩活动曲线见图5。
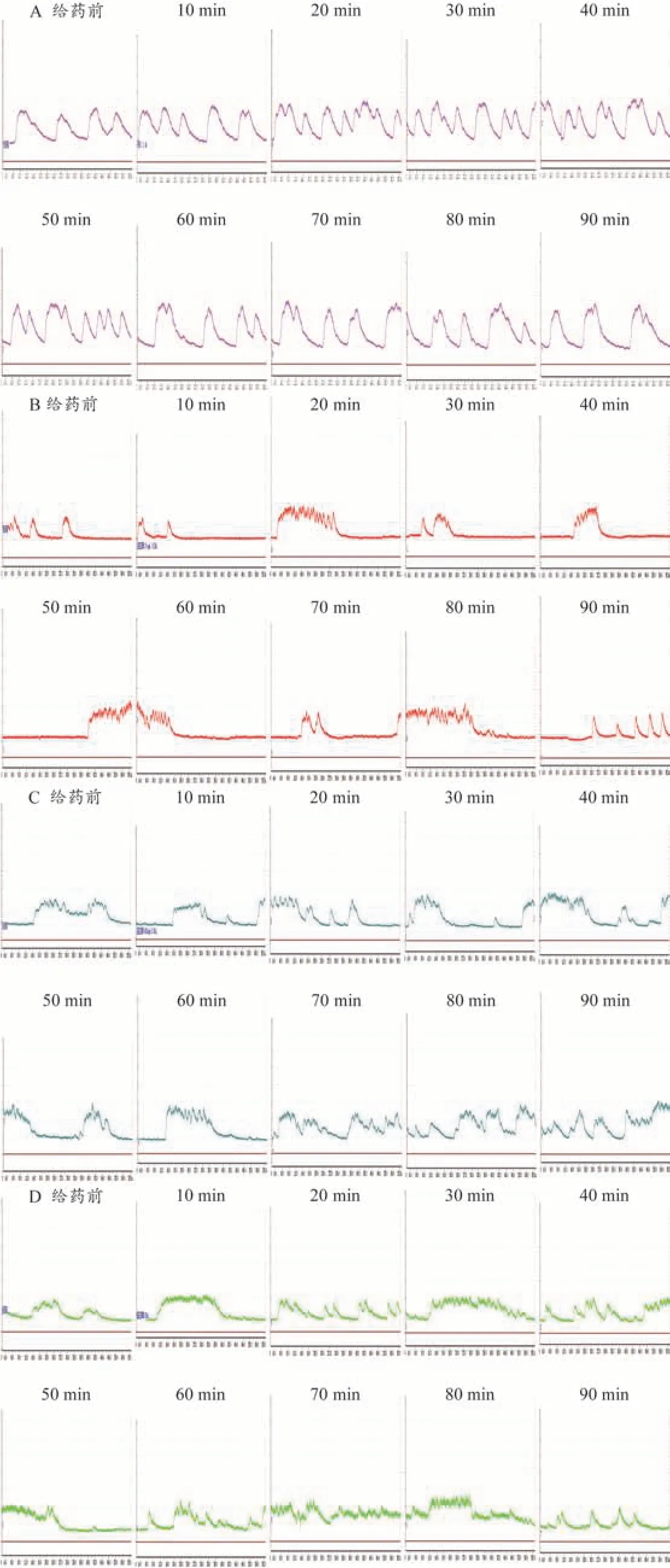
图5 YITA作用豚鼠在体USM活动曲线图
4 讨论
药物流产通过米非司酮使子宫蜕膜变性坏死、宫颈软化,联用米索前列醇兴奋收缩子宫从而促使胚胎排出,是临床广泛应用的人工流产方式,其模拟了自然流产的过程,是研究产后出血的理想模型[27]。药物流产模型下的产后出血与绒毛蜕膜残留、子宫内膜修复障碍、子宫收缩不良等因素有关[34]。本研究根据文献报道建立了豚鼠药物流产模型,研究显示,给予YITA 能够显著降低子宫脏器比重系数(P<0.001),提示YITA 可能具有促进残留绒毛蜕膜排出或子宫收缩从而减少产后出血。
米非司酮是P 的竞争性拮抗剂,同时也是E2受体的有效“非竞争性”抑制剂[35-36],因此在药流后,机体的E2和P 水平会出现明显的降低。E2通过促进子宫内膜和血管增生修复子宫内膜创面;并通过上调催产素相关基因与受体的表达,增强USM 对催产素的敏感性从而增强子宫收缩活动,在子宫复旧中起到重要作用[37]。P 在E2作用的基础上,使增生期的子宫内膜迅速转化为分泌期,促进子宫内膜的修复[38]。此外,P 通过与USM 细胞结合,增加细胞膜电位,提高兴奋阈值,同时降低子宫肌对催产素的敏感性,从而减弱子宫收缩活动,引起子宫出血时间延长[39]。在本研究中,给予YITA 后,E2含量的降低不具有显著性差异(P>0.1),而P 含量则显著降低(P<0.01),提示在子宫复旧的过程中,YITA 对于子宫内膜修复障碍疗效甚微,其缩宫止血的主要机制应该在于对宫缩乏力的改善。
ET/NO 平衡对于维持子宫正常收缩活动具有重要意义。NO是作用极强的子宫血管扩张剂[40],与USM活动密切相关,尤其对妊娠子宫。NO 通过旁分泌作用于邻近的平滑肌细胞,激活其细胞膜上鸟苷酸环化酶(GC),使胞浆中cGMP 水平增加,引起平滑肌舒张,使妊娠子宫处于静息状态,在维持子宫静息和妊娠状态中起重要作用[41]。内皮素(Endothelin,ET)是迄今为止已知最强的收缩血管物质[42],并且参与调控蜕膜细胞合成和释放前列腺素的过程[43],ET 的升高直接或间接地影响着子宫的收缩。本研究结果显示,给予YITA后,子宫组织的NO含量显著降低(P<0.01),ET含量无显著提高(P>0.1),ET/NO 比值显著提高(P<0.001),ET/NO 平衡偏向增强子宫收缩。提示YITA 缩宫止血作用机制可能与其较强的血管收缩和USM 收缩活性有关,改变ET/NO 平衡可能是其调节子宫收缩的关键。
Ca2+浓度在平滑肌收缩过程中起到了关键性的调控作用,在外界条件刺激下,USM 细胞内Ca2+浓度升高,Ca2+与钙调蛋白CaM 结合,激活肌球蛋白轻链激酶(MLCK)。之后在MLCK 的催化下,MLC20调控轻链的N-端19 位发生磷酸化[44],构象改变,提高ATP 酶的活性,增加供能,并促进肌动蛋白与肌球蛋白的相互作用,导致平滑肌收缩[45]。在本研究中,给予YITA 后,豚鼠流产子宫组织内Ca2+浓度有提高趋势(P<0.1),提示YITA USM 收缩的促进可能与对Ca2+的调节存在潜在关系,但其相关性有待进一步验证。
上述研究结果提示,YITA对流产豚鼠有缩宫止血作用,其主要机制是促进子宫平滑肌收缩和血管收缩,从而促进子宫复旧。为进一步明确其对子宫平滑肌活动的调节作用,建立了豚鼠离体和在体USM 模型,观察比较了在不同给药剂量下的YITA 活性。在豚鼠离体USM 模型中,正常状态下,随着时间推移,离体USM的收缩活动逐渐减弱,故给予去离子水后,收缩活动各项指标表现为抑制。与空白组相比,给予YITA后,豚鼠离体USM 的收缩活动增强,50、100 mg·L-1的YITA 能够显著提高豚鼠USM 收缩活动力(P<0.05)。在体USM模型较之离体USM模型整体性更强,在直观展示USM 收缩活动的同时,更好地还原了药物吸收分布代谢的过程。然而,受到开腹手术的影响,在体USM 模型中USM 的收缩活动依然会随着时间推移而减弱,同时还会在不同程度上受到呼吸心跳等其他正常生理活动的干扰;故空白组豚鼠在体USM 收缩活动总体表现为抑制。与空白组比较,给予YITA 后,抑制作用减弱,豚鼠在体USM 收缩活动总体表现为促进。40 mg·kg-1的YITA 能够显著提高豚鼠USM 收缩活动力和频率(P<0.05);10 mg·kg-1的YITA 能够显著提高豚鼠USM 收缩频率(P<0.05),对活动力有提高趋势(P=0.0569<0.1);20 mg·kg-1的YITA 对频率有提高趋势(P分别为0.0898、0.0699,<0.1)。提示YITA 可增强豚鼠的离体与在体子宫收缩活动。此外,YITA对子宫收缩活动的作用与剂量相关,但并非典型的剂量依赖关系,可能与益母草对USM的双向调节作用有关。
综上,YITA 能兴奋正常豚鼠离体子宫和在体子宫,具有缩宫作用,是YI 发挥缩宫作用的药效物质基础,其缩宫止血的作用机制可能与促进兴奋信号传递、促进子宫组织血管收缩、激活Ca2+-MLCK 信号通路有关。本研究为YI 临床用于治疗宫缩乏力所导致的产后出血提供了一定的药效学依据,初步探索了缩宫止血的作用机制,更深层次的机制还有待进一步研究。
