甜味觉受体在2型糖尿病发病及中医药作用研究进展*
2024-01-22孙铁锋战丽彬臧凝子杭天怡朱连连
孙铁锋,战丽彬,臧凝子,杭天怡,朱连连
(1.南京中医药大学中医学院·中西医结合学院 南京 210023;2.辽宁中医药大学中医药创新工程技术中心 沈阳 110847;3.辽宁中医药大学中医脏象理论及应用教育部重点实验室 沈阳 110847;4.辽宁中医药大学附属医院 沈阳 110032)
2 型糖尿病与日常饮食密切相关,随着患者数量的增加,2 型糖尿病已经成为一个全球性的健康问题。保持能量平衡是治疗糖尿病的基本要求,能量新陈代谢始于进食。研究表明,消化过程中的氨基酸、脂肪酸和葡萄糖等营养物质作用于胃肠道的神经内分泌细胞,从而在能量平衡中发挥重要作用[1]。因此,胃肠道现在被认为是营养信号的传感器系统。已有研究表明,味觉受体在肠道中起甜味感受器的作用,并通过分泌胰岛素在感受糖和维持血糖动态平衡方面起着关键作用[2-3]。这些主要包括味觉受体1 型(Taste receptor type 1,T1R)家 族的G 蛋 白 偶 联 受 体(G protein-coupled receptors,GPCRs)的异二聚体,用于感知甜味(T1R2-T1R3)和鲜味(T1R1-T1R3)刺激,T2R家族用于感知苦味刺激。近年来,有研究揭示了胃肠道存在额外的营养感知机制[4-5],葡萄糖传感是通过肠道内分泌细胞(主要是肠道L 细胞)上的甜味(T1R2-T1R3)异源二聚体实现的,其在触发胰岛素激素的分泌以改善血糖和血脂控制方面发挥作用。胃肠感觉机制通过释放作用于迷走神经和肠道传入的胃肠激素来调节对营养的生理反应,特别是饱腹感和能量平衡,从而将神经信号传递到大脑。使用特定的食物、膳食补充剂或药物化合物调节可能对治疗T2DM 具有重要意义。
1 甜味觉受体的生物学特征
甜味,与如苦、咸、酸等口感一样,是人类的一种感知,使人类非常愉悦,是大多数哺乳动物的首选。蔗糖、葡萄糖和果糖等糖是典型的甜味化合物,人类认为各种各样的天然和合成化合物也具有甜味[6]。天然甜味剂来自包括糖、糖醇(如甘露醇、木糖醇)、蛋白质(如他马汀、单胞素)和氨基酸等化学物质。合成甜味剂种类多样:常见的甜味剂包括磺酸盐(如磺素钠)、二肽(如阿斯巴甜、新甜)、卤代糖(如三氯蔗糖)和磺酰胺(如糖精钠、乙酰胺钾)[7]。
自从在舌头上发现甜味觉受体(T1R2/T1R3)以来(其中1999 年发现T1R2[8],随后发现T1R3[9]),已经证明T1R2/T1R3和味觉信号转导分子不仅在口腔[10]中表达,还在胃肠道[11]、胰腺[12]、膀胱[13]、脂肪组织[12]和大脑[14]等多种非味觉器官中表达。尽管甜味觉受体在多种组织中的重要生理作用仍未确定,但已证实甜味觉受体在胰腺和胃肠道组织中表达与葡萄糖感知、葡萄糖转运蛋白的表达以及维持葡萄糖稳态有关[11-12]。甜味觉受体是一类7 次跨膜的GPCRs,表达于味蕾上的味觉受体细胞(Taste receptor cell,TRC),包含1个大的细胞外氨基末端或“N”末端结构域、富含半胱氨酸的结构域和7个螺旋穿膜部位3个结构域[15]。
2 甜味觉受体的信号传导机制
在口腔中,甜味化合物激活味蕾中的甜味感受器[16],诱导细胞内转导级联,导致味觉感受器细胞去极化(图1),在味蕾中,活化的T1R2/T1R3 与α-Gustducin[17]、Gβ3和Gγ13的异三聚体G蛋白相互作用。G蛋白亚基解离后,Gβ3、Gγ13 与磷脂酶C-β2(PLC-β2)相互作用,PLC- β2 进 而 将 磷 脂 酰 肌 醇4, 5 二 磷 酸(phosphatidylinositol(4,5)bisphosphate,PIP2)分裂成肌醇1,4,5-三磷酸(inositol 1,4,5-trispoosphate,IP3),IP3通过IP3 受体(IP3-R)激活刺激Ca2+从内质网释放。细胞内Ca2+升高激活TRPM5 通道,导致膜去极化,使ATP通道Pannexin-1(PX1)打开并释放ATP,刺激传出神经纤维。在肠道中,葡萄糖刺激甜味觉受体,触发胰高血糖素样肽-1(Glucagon-like peptide 1,GLP-1)和促胰岛素释放肽(Glucose-dependent insulinotropic polypeptide,GIP)的分泌,并增加钠-葡萄糖共转运体-1(sodium-glucose cotransporter 1,SGLT-1)的 表 达。在β 细胞中,葡萄糖通过葡萄糖转运体-2(Glucose transporter-2,GLUT-2)运输,ATP 增加,使KATP 通道关闭,从而去极化[18-21]。这种去极化反过来激活电压依赖的钙通道,导致Ca2+在细胞质中积累和胰岛素分泌。甜味觉受体被认为与胰岛素分泌的调节有关。
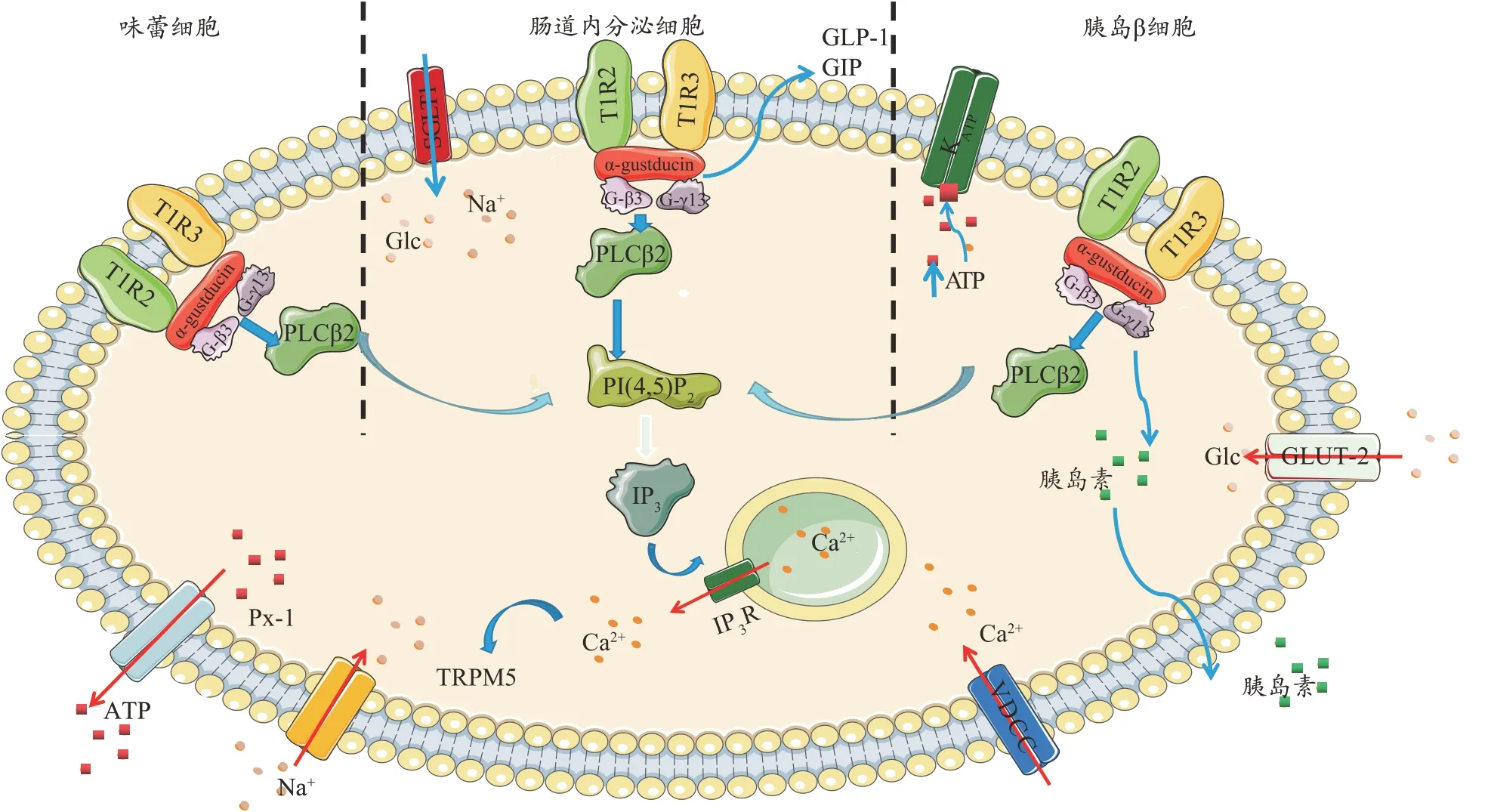
图1 甜味觉受体的信号传导机制
3 甜味觉受体与T2DM
目前,全球约有1/11 的成年人患有糖尿病,其中90%为T2DM,且每年人数呈上升趋势[22-23]。据预测,2030年全球糖尿病患者人数将上升至5.78亿;2045年将上升至7 亿[24]。T2DM 患者经常表现出对“营养”胃肠道异常反应。据报道,肠道甜味受体T1R2 和T1R3在人类近端肠道的不同上皮细胞中表达,并且转录水平随着T2DM 患者的血糖水平而变化[25]。在啮齿动物中,在急性暴露于葡萄糖或人工甜味剂的情况下,肠道甜味觉受体转录和蛋白水平会迅速下调[26]。在健康人群中,根据血糖状态,肠道T1R2 的表达受到管腔葡萄糖的相互调节,但在T2DM 患者中,在急性高血糖时,T1R2 的表达是紊乱的[27]。这一缺陷可能会增强T2DM 患者的葡萄糖吸收,并加剧餐后高血糖。最近,有令人信服的证据表明,T1R3 参与了糖脂代谢的调控,并控制了胰岛素和胰岛素的产生,以T1R3 基因敲除小鼠为研究对象,以亲本C57BL/6J 株为对照,研究了T1R3对胰岛形态特征的影响[28]。在T1R3基因敲除的动物中,胰岛的大小和密度在胰腺组织中都有所减少。所获得的数据表明,编码甜味觉受体蛋白的功能基因的缺失导致胰岛组织营养不良,并与人类T2DM和肥胖症所特有的胰腺病变的发生有关。同时T1R2基因敲除实验证实,这些效应是通过调节GLUT2转运体转运到肠上皮细胞的顶膜而特异性地介导的。GLUT2 易位和葡萄糖转运依赖于胰高血糖素样肽2(Glucagon-like peptide 2,GLP-2)的分泌和随后的肠神经元激活。最后,野生型小鼠喂食高蔗糖后,肠道中甜味觉受体的表达迅速下调,导致葡萄糖吸收减少。Campbell 等[29]的研究表明甜味觉受体通过调节葡萄糖的转运来调节葡萄糖的吸收,并防止由于摄入高糖而加剧高血糖的发展。
3.1 甜味觉受体与胃肠激素
作为机体最大的内分泌系统,胃肠道分泌的激素在维持代谢稳态、调节胃肠道内外组织功能中发挥重要作用。最近在胃肠道中发现味觉受体及其下游信号蛋白,而且食物的摄入可以通过与特定味觉受体结合的化合物产生的胃肠刺激来调节。这些受体在肠道营养的功能检测中发挥作用,这可能反过来启动激素或神经级联通路[30]。胰岛素肽,主要是GLP-1 和GIP,调节胰岛激素分泌、葡萄糖浓度、脂代谢、肠道动力、食欲和体重以及免疫功能。GLP-1 和GIP 受体的激活还通过直接作用于表达胰岛素受体的组织,以及通过神经和内分泌途径介导的间接机制,在多种组织中导致非血糖效应[29]。
3.1.1 胆囊收缩素
胆囊收缩素(Cholecystokinin,CCK),多肽激素,由33 个氨基酸组成。全部生物活性存在于C 端的八肽片段,CCK 是一种由肠内分泌细胞释放的肠道激素[31]。Yoshida 等[32]重点研究了CCK 在味觉刺激初始反应中的作用,CCK 与Ⅱ型味觉细胞标志物如α-gustducin、PLCβ2 和TRPM5 共表达;此外,小部分表达CCK 的味觉细胞(Ⅱ型味觉细胞))在味蕾中表达甜味/鲜味味觉受体成分,因为Ⅱ型味细胞是甜味、鲜味或苦味细胞,所以大多数表达CCK 的味细胞可能是苦味细胞。总的来说,CCK 通过作用于迷走神经传入神经和下丘脑表达的胆囊收缩素受体,以及瘦素之间的协同相互作用,起到控制饮食。
3.1.2 胰高血糖素样肽-1
在健康人中,胰高血糖素样肽-1(Glucagon-like peptide 1,GLP-1)是在进食后分泌的,通过增加胰岛素分泌和抑制胰升糖素释放来降低葡萄糖浓度。GLP-1的其他作用包括延缓胃排空、抑制食欲,并可能抑制β细胞的凋亡。天然的GLP-1 在循环中约2-3 min 内被降解;因此,各种GLP-1 受体激动剂已被开发出来,以提供更久的体内作用[33]。黄精花多糖[34]通过甜味觉受体介导的cAMP 信号促进肠内分泌L 细胞的GLP-1 分泌。干预实验表明,黄精花多糖刺激的GLP-1 分泌不仅受到抗体、siRNA 和T1R2/T1R3抑制剂的显著抑制,而且还受到腺苷酸环化酶抑制剂的抑制。这些结果提示黄精花多糖可能通过激活T1R2/T1R3 介导的cAMP信号通路刺激肠内分泌细胞分泌GLP-1。
3.1.3 YY肽
YY 肽(Peptide tyrosine tyrosine,PYY)是小肠细胞分泌的一种激素,这种激素与进食直接相关,饭后释放到血液中,与大脑中的受体结合,使人感到饱足;PYY也在消化道发挥作用,有助于控制消化过程的速度,哺乳动物味蕾细胞表达多种肽的受体,这些肽在调节新陈代谢、营养同化和饱腹感方面与身体其他部位有关[35]。PYY存在于唾液和味觉细胞亚群中,可以影响行为味觉反应,减少食物摄入和体重。采用基质胶诱导NCIH716细胞建立小肠内分泌模型[36],结果表明海藻糖、赤藓糖醇、山梨糖醇可通过激活T1R2、T1R3、α-Gustducin、PLCβ2、TRPM5等基因,增加胞内Ca2+浓度,以激活甜味觉受体信号通路促进GLP-1、PYY分泌。
3.1.4 血清素
血清素(Serotonin,5-HT),广泛分布于人体,尤其是大脑皮层和突触。大脑中的5-HT 控制着人类的饮食行为、认知功能和情绪调节[37-38]。共有27 名健康男性受试者接受了甜味觉受体抑制剂-2-(4-甲氧基苯氧基)-丙酸钠干预实验。在120 min 内测定了CCK、胃饥饿素(Ghrelin)、5-HT 的餐后血浆浓度以及体温的变化。本研究表明,甜味觉受体抑制剂能增加能量摄入,降低血浆5-HT浓度[39]。
3.2 甜味觉受体与肠道菌群
脾为后天之本,肠道在中医学藏象理论体系中隶属于脾胃之范畴,而肠道菌群居于肠中,其作为庞大而复杂的生态系统,对宿主能量代谢、营养吸收、免疫功能等方面起到重要作用[40],与中医对脾主运化、气血生化之源等认识高度契合。研究表明,除环境和遗传因素外,胃肠道微生物群在T2DM 和肥胖的发生发展中起着重要的作用。目前,相关研究主要关注的是远端肠道菌群,而忽略了同样重要的近端肠道菌群,如十二指肠中的菌群。有研究定性分析了十二指肠菌群的结构,并与相关临床指标做了关联分析,双歧杆菌属细菌可能是T2DM 和肥胖发生发展的生物标志物[41]。甜味觉受体在口腔和胃肠道都有表达,参与食欲、葡萄糖稳态和肠道运动的调节。因此,甜味觉受体可能与胃肠道微生物群相互作用,这种相互作用可能解释T2DM、肥胖和代谢结果之间的关系。
舌上皮和肠上皮所共有的化学感觉成分在食物消耗和肠道功能调节中起着至关重要的作用。除营养信号外,包括微生物在内的其他管腔内容物在整个胃肠黏膜的信号传递和启动消化功能的改变方面也很重要。肠道微生物区系在影响食物摄入量、能量平衡和体重增加方面的潜在作用已被提出[42-44]。然而,肠道微生物区系是否调节营养反应受体和转运蛋白的表达,从而导致食物消费的改变,尚不清楚。Swartz等[45]用偏好实验比较了无菌(GF,C57BL/6J)小鼠与常规(CV,C57BL/6J)对照组小鼠对营养性(蔗糖)和非营养性(糖精)甜味剂的偏好。定量了T1R3、α-Gustducin 和SGLT-1 在CV 和GF 小鼠肠上皮中的基因和蛋白表达,还包括舌上皮中T1R2、T1R3 和α-Gustducin 的基因表达。结果发现,尽管两组小鼠对蔗糖的偏好相似,但GF小鼠比CV小鼠摄入更多高浓度(8%)的蔗糖溶液,糖精的摄入量和偏好均无差异。与对照组相比,GF 组小鼠肠上皮细胞T1R3 和SGLT-1mRNA 和蛋白的表达明显增加,而舌味觉受体mRNA 的表达差异无统计学意义。因此肠道微生物区系的缺失改变了近端小肠甜味觉受体的表达和过量供应,这与营养甜味剂的摄入量增加有关。有研究者使用豚鼠模型来研究糊精(SS)在微生物群-肠道-下丘脑轴中的生理作用[46]。饮水中添加1.5 mmol·L-1SS 可提高血清葡萄糖水平,糖精钠处理激活了回肠的甜味觉受体信号。在SS 和对照(CN)组的下丘脑中,RNA-seq 鉴定了1370 个不同表达的基因(796 个上调,574 个下调),富集到味觉信号转导和神经活性配体-受体相互作用中,SS处理显著增强了回肠微生物群发酵的功能。总之,SS 激活了肠道中的甜味觉受体信号以及肠道菌群。
3.3 甜味觉受体与胃肠免疫
甜味觉受体最近被证实参与越来越多的免疫过程,在胃肠道免疫方面,有学者发现摄入脂多糖后,蔗糖敏感性降低,同时T1R2 和T1R3 转录物的舌侧表达降低,被翻译成形成甜味觉受体的T1R2+T1R3 亚单位[47]。在LPS 被消耗后,T1R2 和T1R3 mRNA 表达水平和对蔗糖的神经反应得以恢复。缺乏脂多糖Toll样受体(Toll-likereceptor,TLR)的小鼠对脂多糖摄入后的神经生理变化有抵抗力。这些发现表明,在单一时期摄入脂多糖会特异性地暂时抑制对蔗糖的神经反应。综上,LPS 会启动依赖TLR4 的激素信号,下调味蕾中的甜味觉受体基因。甜味信号延迟抑制可能会影响食物选择以及胃肠道细菌和肥胖之间复杂的相互作用。胃肠道上皮中表达的先天性免疫受体可感知入侵的病原体,先天性免疫受体信号通路的失调与炎症疾病相关。Kayisoglu等[48]通过构建人与小鼠的胃肠道不同部位的类器官,并利用全基因组RNA 测序,发现胃肠道上皮的先天性免疫应答信号主要受到位置(而非菌群)的影响。另外,对Toll 样受体4(TLR4)在胃肠道上皮中的表达与功能进行分析发现,免疫相关基因在胃肠道中的表达及功能在发育期间已被决定,且不受环境影响。
4 甜味觉受体与“脾在味为甘”
战丽彬教授多年来从事脾藏象及从脾论治代谢性疾病的相关研究[49],认为“脾虚痰湿”为肥胖T2DM之中医关键病机,治则当以“健脾化湿”。《内经》曰“五味所入……甘入脾”,“脾在味为甘”是中医脾藏象的重要理论内容,是脾脏生理、病理、治法要点的理论基础。①生理上,脾主运化,主气太阴湿土,而甘味属土,与脾相配,在运化之水谷精微之中,脾最喜甘味;②病理上,甘味最易伤脾,而致中满,日久化热,伤及脾阴,而致消渴;③治疗上,甘味药多能补养脾胃中气,喻嘉言云“脾胃者土也,土虽喜燥,然太燥则草木枯槁,土虽喜润,然太湿则草木湿烂,以补滋润之剂,使燥湿相宜”,即补脾胃者,当使润燥相济,以甘味为主,其中甘不仅指药食甜之口味,更指其和缓、补养、润燥之功效特点。
李杰[50]研究黄芩-黄连药对高糖高脂诱导的糖尿病前期大鼠以及3-脱氧葡萄糖醛酮(3DG)损伤的INS-1 细胞胰岛素分泌的改善作用,结果发现与对照组相比,模型组糖尿病前期大鼠胰腺组织中T1R2、T1R3、PLCβ2 以及TRPM5 蛋白表达显著降低;经黄芩-黄连药对干预后,与模型组相比,黄芩-黄连组大鼠胰腺组织中T1R2、T1R3、PLCβ2以及TRPM5蛋白表达显著增加。杨海梅[51]研究半夏-黄连对糖尿病前期大鼠模型GLP-1 水平与STC-1 细胞GLP-1 分泌受损的改善作用,并揭示半夏-黄连对甜味受体信号通路的调控作用。同时对半夏-黄连改善GLP-1 分泌的一些潜在机制进行探究。半夏-黄连处理后T1R3、PLCβ2、TRPM5 蛋白表达增加;另外,糖尿病前期大鼠T1R3、PLCβ2、TRPM5 蛋白的表达下降,半夏-黄连干预后蛋白表达量增加。刘佳[52]的实验表明,健脾法可影响肠道甜味觉受体及关键信号分子表达并干预TlRsα-Gustducin/PLCβ2 味觉通路的转导。陈龙辉[53]的研究发现脾虚与甜味觉受体密切相关,实验结果证实干预甜味觉受体可以恢复脾的功能。因此从甜味觉受体研究脾,有助于揭示“脾在味为甘”的理论内涵,也将有助于阐明中医从脾论治T2DM 有着现实的研究指导意义。
5 讨论
T2DM 的患病率持续增加,找到有效策略来调节血糖水平是至关重要的。尽管空腹血糖水平已被用作血糖管理的指标,但控制餐后血糖,即降低血糖峰值和波动,是血糖管理的关键。维持血糖在一个特定范围内被称为葡萄糖稳态。除限制碳水化合物外,改变直链淀粉与支链淀粉的比例或增加膳食脂肪和纤维含量的比例,这些方法可以降低碳水化合物的消化率,改变肠道平衡(包括胃肠激素、肠道菌群、胃肠免疫),促进葡萄糖从血液中转运刺激GLP-1 的分泌(见图2)。寻求优化餐后葡萄糖稳态的一个新兴研究领域涉及甜味刺激,这种策略的前提是,口腔中或者肠道中的甜味觉受体已被证明触发生理反应,为即将摄入的碳水化合物准备身体并调节葡萄糖稳态。在除口腔组织中,T1R2/T1R3 已被证明参与调节代谢过程,如糖感应、葡萄糖稳态和饱足激素释放。T1R2/T1R3 在肠道和胰腺中的功能代表了利用甜味觉受体作为潜在治疗靶点可能。越来越多的证据表明,甜味感受器在全身无处不在,包括胃肠道和下丘脑[54]。这些甜味觉受体在很大程度上参与营养感知,监测能量储存的变化,并触发代谢和行为反应,以维持能量平衡。这些途径受到外部和内部因素的调控,其中一个或多个通路的功能障碍可能引起肥胖和T2DM。
T2DM 和肥胖是一个全球性的公共卫生问题[55]。目前的治疗集中在减肥和整体饮食质量控制上。然而,对于饮食的最佳常量营养成分,特别是对于T2DM患者长期管理还需要建立规范[56]。通过对口腔组织、肠道组织等中甜味觉受体的观察,可以设计出具有特异性和高效的新化合物,甜味觉受体及甜味剂等已经在控制体重和葡萄糖稳态方面发挥重要作用。因此,对甜味觉受体生物学的了解的进展可能有助于设计新的具有良好效果的甜味觉受体激动剂。
