基于ROS-ASK1-JNK/NF-κB通路探讨三才连梅颗粒调控2型糖尿病合并非酒精性脂肪肝肝细胞凋亡水平的研究*
2024-01-22王胜菊郭银雪陈一丁韩栩珂詹继红
王胜菊,秦 帅,郭银雪,谢 恂,陈一丁,韩栩珂,高 阳,詹继红**,陈 秋**
(1.贵州中医药大学第一附属医院 贵阳 550001;2.成都中医药大学附属医院 成都 610072;3.陕西中医药大学针灸推拿学院 咸阳 712046)
糖尿病在全球范围内迅速增长,其相关的并发症及全因死亡风险也随之增加[1-2],并且伴随代谢功能持续恶化,其中与代谢功能障碍密切相关的非酒精性脂肪肝(Non-alcoholic fatty liver disease,NAFLD)已成为二十一世纪全球第一大慢性肝病[3]。NAFLD 是脂肪变性向脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)、肝硬化、甚至肝癌的触发因素[4]。NAFLD 作为常见肝病常与2 型糖尿病(Type 2 diabetes mellitus,T2DM)相伴发病。T2DM 合并NAFLD 进一步加大糖尿病控制难度及并发症发病风险较单纯T2DM 更高,易发生肝病不良进展,增加死亡风险[5]。
T2DM 高血糖状态下使ROS(Reactive oxygen species)自由基产生过多,可代偿性的增加糖及脂质代谢,从而使血糖进一步增高,加重胰岛素抵抗及氧化应激反应[6-7]。脾虚是糖尿病胰岛素抵抗的主要病机,脾虚可致痰湿、瘀血堆积体内,减弱胰岛素在机体内的正常功能,促使糖脂代谢紊乱终致肝脏脂肪变性。脾气虚弱,脾运化功能失职、土壅木塞,肝失疏泄,能导致肝脏内血脂升高,发展为脂肪肝。因此,T2DM 合并NAFLD 基本机制为脾气亏虚。三才连梅颗粒(人参、天冬、生地、黄连、肉桂、乌梅)是由《温病条辨》三才汤和长期临床实践衍化而来,具有益气健脾、清胃热、调中焦气机、生津润燥、滋阴降火的功效。尽管全方可针对T2DM 合并NAFLD 的基本病机而发挥治疗作用,课题组前期临床试验也证实三才连梅颗粒可有效控制血糖和调节血脂,降低炎症因子(TNF-α、IL-6等)水平[2,8-10]、还可有效调节氧化应激因子(MDA、SOD)水平[11-12]。但其具体作用机制尚不清楚。
研究显示ROS 可通过多种途径介导细胞凋亡的发生[13]。其中,ROS 介导的ASK1-JNK/NF-κB 途径是诱导肝细胞凋亡一个重要途径[14-15]。因此,本研究在前期研究的基础上,通过建立T2DM 合并NAFLD 的动物模型,用三才连梅颗粒进行干预,从动物层面探索三才连梅颗粒通过影响ASK1、JNK、NF-κB 等靶点来治疗T2DM合并NAFLD的主要效应机制。
1 材料
1.1 药物
三才连梅颗粒(质量控制由成都中医药大学附属医院药剂科监督完成[16],每克颗粒含1.475 g 生药)。盐酸二甲双胍(阳性对照组用药,成都恒瑞制药有限公司,批号:国药准字H20030952,商品名:倍顺)。
1.2 实验动物
SD 成年雄性大鼠50只,体质量(200±20)g,在21-25℃及40%-70%湿度环境下饲养,每天光照12 h,普通饲料适应性喂养1 周后,大鼠随机分组(正常组n=10,造模组n=40)。
1.3 主要试剂
ELISA Kit、TP 测定试剂盒、T-SOD 测试盒、MDA测 定 试 剂 盒、RNA TRIzol Reagent、Bax、Bcl-2、caspase3、β-actin 抗 体;引 物 序 列:β-actin:上 游GAAGATCAAGATCATTGCTCC、下游TACTCCTGCTT GCTGATCCA;ASK1:上游GCTGTTGATAGACCACCGC TTCC、下游TGCCCTGTTCCTCTGCCTTCC;JNK:上游CCACCACCAAAGATCCCTGACAAGCA、下游ACGCCA TTATTAGTTCGCTCCTCCAA;NF-kB:上游TGGCTAC ACGGGACCAGGAACAGT、下游GGCTTGCTCCAGGT CTCGCTTCTT。
1.4 主要仪器
Western blot及IP细胞裂解液、BCA 蛋白浓度测定试剂盒、酶标仪、实时荧光定量(RT-PCR)仪、透射电子显微镜、垂直电泳槽JY-SCZ4+、电泳仪JY200C。
2 实验方法
2.1 糖尿病合并NAFLD大鼠模型制备
本次实验在成都中医药大学附属医院伦理委员会监督下进行。造模组经8周的高脂高糖饲料喂养后按体质量一次性腹腔注射40 mg·kg-1的1% STZ 溶液,3 天后,测量尾静脉血糖>16.9 mmol·L-1则糖尿病合并NAFLD模型大鼠造模成功[17-18]。
2.2 动物分组及给药
造模成功的大鼠随机分为模型组、三才连梅颗粒组、阳性药物组(n=10)。正常组:在同等条件下,正常普通喂养,不处置;模型组:同等条件下,给予等量蒸馏水灌胃;三才连梅颗粒组:同等条件下,予以三才连梅颗粒(每天4 g·kg-1,此剂量参考前期药理学实验得出[19-20])进行干预,每天1 次,连续干预8 周;阳性药物组:同等条件下,予以二甲双胍(200 mg·kg-1)进行干预,每天1 次,连续干预8 周。实验期间各模型组大鼠仍高脂高糖喂养。
2.3 标本的留取和血清指标的测定
各组大鼠干预8 周后,禁食不禁水过夜10 h,次日清晨,尾静脉测0 min血糖。后以大鼠体质量2.0 g·kg-1予以腹腔注射50%葡萄糖后测15、30、60、120 min血糖。
实验结束后,大鼠禁食8 h,腹主动脉采血,离心后将血清储存于-20℃,并迅速分离出肝脏;采用Rat INS ELISA KIT测定大鼠INS浓度(实验步骤按照试剂盒说明书进行操作)。ELISA 测定血清GHb(糖化血清蛋白)、血脂四项,ELISA 测定肝脏匀浆丙二醛(MDA)、超氧化物歧化酶(SOD)、白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等指标(实验步骤按试剂说明书进行操作),计算胰岛素抵抗指数(HOMA-IR=FBG(空腹血糖,mmol·L-1)×FINS(空腹胰岛素,pmol·L-1)/22.5)。取肝脏组织进行肝脏病理观察。
2.4 Real-time PCR 检测
肝组织总RNA 提取、逆转录、PCR 引物扩增。将得到的每个PCR 反应的Ct 值,用2-△△Ct值计算各组大鼠ASK1、JNK、NF-κB的相对表达量。
2.5 肝脏组织Western blot检测
肝组织蛋白经过上样、电泳、转膜、孵育(一抗浓度:Bax 1∶5000;Bcl-2 1∶1000;caspase3 1∶2000;β-actin 1∶100000,4℃孵育过夜;二抗稀释浓度:1∶5000,室温孵育2-3 h)、显影,进行图像分析。
2.6 肝细胞TUNEL检测
课题组采用TUNEL 法检测肝脏组织切片中肝细胞凋亡情况,在显微镜下计数凋亡细胞个数,然后计算出每高倍镜下平均凋亡细胞数并进行统计分析。
3 统计分析
通过SPSS 20.0 统计软件进行数据均值±标准差(±s)分析,主要采用One-Way ANOVA 检验,多组比较事后分析采用SNK-q 检验,P<0.05 认为差异有显著性;肝脏病理观察结果采用描述性分析。
4 结果
4.1 给药后各组大鼠体质量、GHb、INS 及HOMA-IR的变化
因在喂养过程中大鼠有死亡及获取标本过程中获取失败、标本污染等情况,最终选取各组大鼠合格标本各7 例(n=7)进行数据分析。如表1 所示:三才组与二甲双胍组大鼠体质量、GHb、INS、HOMA-IR 值较模型组大鼠下降。
表1 给药后各组大鼠体质量GHb、INS及HOMA-IR的变化(±s,n=7)
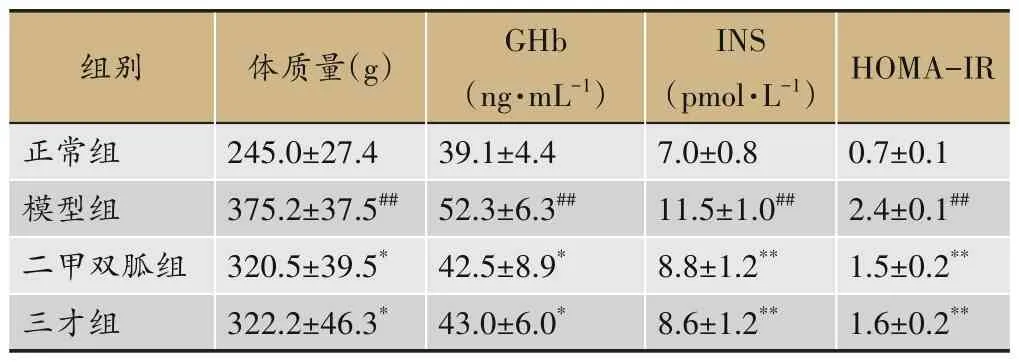
表1 给药后各组大鼠体质量GHb、INS及HOMA-IR的变化(±s,n=7)
注:HOMA-IR 取其对数Ln(HOMA-IR)进行比较;与正常组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
组别正常组模型组二甲双胍组三才组体质量(g)245.0±27.4 375.2±37.5##320.5±39.5*322.2±46.3*GHb(ng·mL-1)39.1±4.4 52.3±6.3##42.5±8.9*43.0±6.0*INS(pmol·L-1)7.0±0.8 11.5±1.0##8.8±1.2**8.6±1.2**HOMA-IR 0.7±0.1 2.4±0.1##1.5±0.2**1.6±0.2**
4.2 各组大鼠腹腔葡萄糖耐量实验(IPGTT)后血糖变化
如图1 所示,模型组大鼠各时间点血糖高于正常组,说明模型大鼠存在葡萄糖耐量受损;三才连梅组与二甲双胍组大鼠血糖波动曲线同正常对照组相似,各时间点血糖水平低于模型组(P<0.01),说明三才连梅颗粒可改善T2DM合并NAFLD模型大鼠糖耐量。
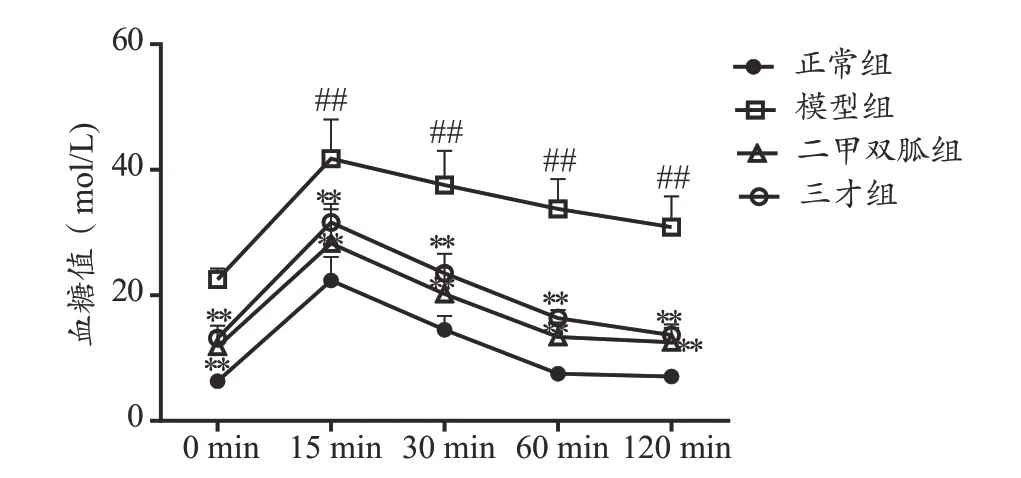
图1 各组大鼠IPGTT后血糖变化情况
4.3 各组大鼠血脂变化情况
如表2 所示,模型组大鼠甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平高于正常组(P<0.01),高密度脂蛋白胆固醇(HDL-C)水平低于正常组(P<0.01);与模型组对比,三才组与二甲双胍组大鼠TG、TC、LDL-C 水平下降,HDL-C 升高,其中三才连梅组大鼠血脂改善情况较二甲双胍组更显著。
表2 给药后各组大鼠血脂情况(±s,n=7)

表2 给药后各组大鼠血脂情况(±s,n=7)
注:与正常组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
组别正常组模型组二甲双胍组三才组血脂(mmol·L-1)HDL-C 1.2±0.3 0.6±0.1##0.9±0.3*1.0±0.2**TG 0.6±0.3 2.3±0.9##1.2±0.3**1.1±0.2**TC 1.5±0.4 2.5±0.7##1.6±0.4**1.3±0.2**LDL-C 0.4±0.1 1.1±0.4##0.9±0.3 0.7±0.3*
4.4 各组大鼠肝酶的变化情况
如表3 所示,模型组大鼠肝酶丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)水平较正常组明显升高(P<0.01);药物干预后,三才组与二甲双胍组大鼠肝酶水平明显下降(P<0.01)。
表3 给药后各组大鼠肝酶变化情况(±s,n=7)

表3 给药后各组大鼠肝酶变化情况(±s,n=7)
注:与正常组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
AST(U·L-1)91.5±11.8 195.5±23.7##114.4±35.1**105.4±15.2**组别正常组模型组二甲双胍组三才组ALT(U·L-1)55.6±12.1 116.5±13.7##87.0±7.8**73.4±12.6**
4.5 各组大鼠肝脏炎症指标变化情况
如表4所示:模型组肝脏组织IL-1β、IL-6、TNF-α浓度高于正常组(P<0.01),说明模型大鼠肝脏组织存在明显炎症反应;经过药物干预后,二甲双胍组和三才连梅颗粒组大鼠肝脏组织IL-1β、IL-6、TNF-α 浓度与模型组比明显降低(P<0.01)。
表4 给药后各组大鼠肝脏炎症指标情况(±s,n=7)

表4 给药后各组大鼠肝脏炎症指标情况(±s,n=7)
注:与正常组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
组别正常组模型组二甲双胍组三才组IL-1β(pg·mL-1)5.8±0.4 7.6±0.7##6.4±0.8**6.0±0.4**IL-6(pg·mL-1)21.6±0.8 26.7±1.9##22.7±1.5**22.1±1.7**TNF-α(pg·mL-1)51.1±4.0 65.8±5.0##54.8±3.4**52.6±2.5**
4.6 各组大鼠肝脏氧化应激产物指标变化情况
如图2 所示:模型组大鼠SOD 浓度低于正常组,MDA 高于正常组(P<0.01);药物治疗组(三才组、二甲双胍组)大鼠SOD 浓度较模型组升高,MDA 浓度下降(P<0.05)。
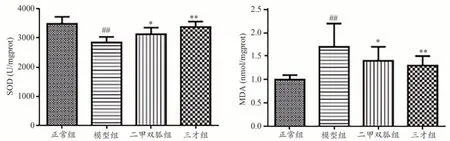
图2 各组大鼠肝脏SOD、MDA指标变化情况
4.7 各组大鼠肝脏组织病理观察结果
如图3所示:正常组肝脏组织完整正常,模型组可见肝细胞空泡变性或脂肪变性及脂滴;与模型组对比,三才组可见少许脂滴及细胞空泡变性,二甲双胍组可见些许脂滴。

图3 大鼠肝脏组织病理变化(HE染色,×100)
4.8 各组大鼠肝组织中ASK1、JNK、NF-κB mRNA 表达情况
如图4 所示,模型组大鼠肝脏组织ASK1、JNK、NF-κB mRNA 表达较正常组明显升高(P<0.05),三才连梅颗粒组大鼠肝脏组织ASK1、JNK、NF-κB mRNA表达明显下降(P<0.05)。
4.9 各组大鼠肝脏组织中凋亡蛋白表达情况
如表5 所示,模型组大鼠肝脏组织中Bax、caspase-3表达升高,Bcl-2表达下降;三才连梅组Bax、caspase-3表达下降,Bcl-2表达升高,见图5。
表5 各组大鼠肝脏组织中凋亡蛋白Bax、Bcl-2、caspase3的表达(±s,n=7)
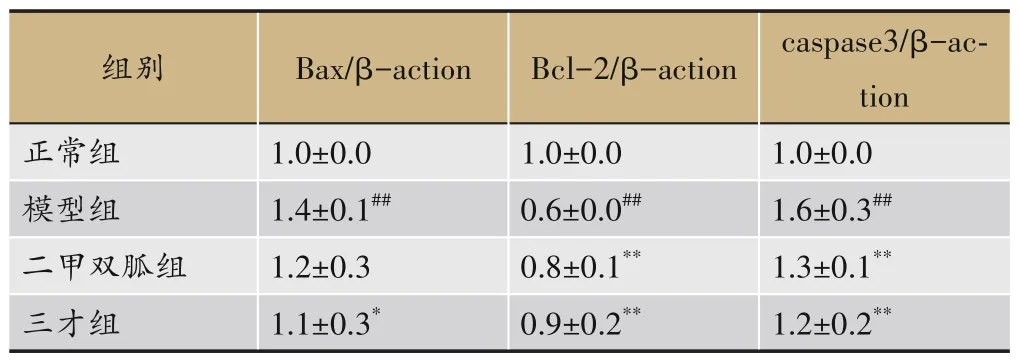
表5 各组大鼠肝脏组织中凋亡蛋白Bax、Bcl-2、caspase3的表达(±s,n=7)
注:与正常组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
组别正常组模型组二甲双胍组三才组Bax/β-action 1.0±0.0 1.4±0.1##1.2±0.3 1.1±0.3*caspase3/β-action 1.0±0.0 1.6±0.3##1.3±0.1**1.2±0.2**Bcl-2/β-action 1.0±0.0 0.6±0.0##0.8±0.1**0.9±0.2**
4.10 三才连梅颗粒对肝细胞凋亡的影响
如图6所示,模型大鼠存在显著肝细胞凋亡情况。经过三才连梅干预后,模型大鼠肝细胞凋亡情况显著改善。

图6 各组大鼠肝脏组织各凋亡蛋白表达
5 讨论
本实验结果提示经过高脂喂养后模型组大鼠体质量明显高于正常组,检测模型组大鼠血脂也是高于正常组,肝脏组织病理学观察提示模型组大鼠肝脏存在明显脂肪变性及炎症改变。检测模型大鼠糖耐量结果提示模型大鼠存在明显糖耐量异常,与血清胰岛素水平升高情况相符,提示模型组大鼠存在胰岛素抵抗。同时,模型组大鼠肝酶明显高于正常组,提示模型大鼠存在肝损伤。以上结果说明,高脂饮食喂养加小剂量STZ 腹腔注射,T2DM 合并NAFLD 大鼠模型建立成功。本研究通过此研究进一步证实三才连梅颗粒可有效改善模型大鼠糖脂代谢紊乱,改善胰岛素抵抗,此结果与课题组前期研究结果一致[9,11-12]。
在糖尿病机体各种组织中,氧化反应增强,产生过量的ROS[21]。在此过程中,机体促氧化因子MDA 增加,抗氧化因子SOD 消耗。该研究通过检测肝脏匀浆MDA和SOD浓度来反应肝脏组织氧化应激情况,间接反应ROS 的生成情况。研究结果显示,模型组大鼠肝脏组织SOD 浓度与模型组对比显著下降、而MDA 浓度明显升高,说明模型大鼠肝脏氧化应激反应明显增强,提示ROS 生成增多;药物干预后,三才组大鼠肝脏组织SOD 浓度与模型组对比明显上升,而MDA 水平明显下降,说明三才连梅颗粒可有效改善模型大鼠肝脏氧化应激。
ROS 通过激活多种信号通路介导炎症反应及细胞凋亡。其中,凋亡信号调节激酶1(ASK1)级联通路主要以ROS 依赖的方式被激活,进一步激活其下游信号通路MAPK 的磷酸化,从而启动JNK 信号通路[22],致使JNK持续激活,参与NAFLD的发生发展。有研究表明机体在各种应激状态下ASK1-JNK的持续激活可介导线粒体依赖途径的细胞凋亡[23]。机体应激状态下损害NF-κB 通路的相关调节机制,促进炎症因子(IL-6、IL-1β、TNF-α 等)的释放,使机体发生持续低度炎症,参与肝脏炎症、脂肪变性及纤维化[24-25]。动物实验发现NF-κB 的过度激活在肝脏持续的炎症反应、肝脏胰岛素抵抗及肝脏脂肪变性等病理过程中发挥着重要作用[26-27]。本研究结果也证实,模型组大鼠体肝脏组织内ASK1、JNK、NF-κB 表达均显著上调,相关炎症因子水平升高,出现非酒精性脂肪性肝炎表现(ALT、AST 升高);正常组大鼠无此变化。提示机体在氧化应激增强情况下,ASK1-JNK/NF-κB通路被激活,促使肝脏炎症反应增强。在此过程中,肝脏细胞自我调节机制受损,促使肝细胞凋亡增加。而药物干预后,ASK1-JNK/NFκB通路可被抑制,从而减轻肝脏炎症反应。
细胞凋亡作为机体的一种自我调节机制之一[28-29],受到多种相关基因的调控,其中Bcl-2、Bax、caspase-3 是调节细胞凋亡最重要的基因[30]。本研究通过检测肝细胞Bcl-2、Bax、caspase-3 基因的表达来反应肝细胞凋亡情况。本研究Western blot结果显示,模型组大鼠促凋亡蛋白Bax、caspase-3 的表达是上调的,而抗凋亡蛋白Bcl-2的表达是下调的。说明T2DM合并NAFLD 大鼠机体内肝细胞凋亡增加。经过药物干预后,治疗组大鼠Bax、caspase-3 蛋白明显下降,而Bcl-2 蛋白表达明显升高,TUNEL 结果进一步证实药物干预后肝细胞凋亡减轻。说明三才连梅颗粒可调节模型大鼠肝细胞凋亡蛋白的表达,抑制肝细胞凋亡。因此,课题组推测三才连梅颗粒可通过抑制ROS-ASK1-JNK/NF-κB 通路来调节细胞凋亡而防止或逆转NAFLD病程进展。
中医药多成分、多靶点和副作用低等特点,是近年来临床和科学研究的热点。三才连梅颗粒是由《温病条辨》经典方剂“三才汤”和长期临床实践衍化而来。由人参、天冬、生地、黄连、肉桂、乌梅组成。方中人参,补益脾气,鼓动津液输布运行,滋养机体。天冬,甘苦,养阴益胃生津、滋肾降火。生地黄,养阴生津,本品又补肾水真阴,伍与人参金水相生。黄连,清热燥湿解毒,其燥湿,利于脾气健运,化痰除湿;解毒,利于瘀毒、浊毒等的排出;泻火,清心火以解渴除烦。乌梅伍与人参,取其酸甘化阴之效,増强养阴益气、生津止渴之效。方中黄连量大味苦,与乌梅之酸,苦酸相配,可增收敛气阴之效。肉桂为佐使之用,温经通脉,使气机调畅,补而不滞,滋阴又兼升阳。全方肉桂之用,亦能制约天冬、黄连、生地黄的苦寒之性,温补肾阳,寓意“阳中求阴”。黄连配肉桂,可得水火既济之效。因久病伤津耗气损阳。因此,全方针对T2DM合并NAFLD“脾气亏虚”的基本病机,以“健脾益气、兼养阴清热、化痰除湿”为主要治法,辅以温通,调和阴阳,兼顾五脏而发挥治疗作用。
本研究通过肝脏研究三才连梅颗粒在改善T2DM合并NAFLD 胰岛素抵抗及氧化应激中的相关机制靶点。课题组通过高脂高糖饮食+STZ 诱导T2DM 合并NAFLD 大鼠模型。T2DM 合并NAFLD 大鼠模型诱导成功后,大鼠分为四组,分别予不同的干预方式。干预8周后,比较T2DM合并NAFLD各相关指标的变化。结果发现:三才连梅颗粒可减轻T2DM 合并NAFLD 模型大鼠体质量;改善模型大鼠葡萄糖耐量受损、胰岛素抵抗、血脂代谢紊乱及脂肪性肝炎,同时改善模型大鼠肝脏氧化应激,从而保护肝脏功能,改善肝脏脂肪变性。本研究还发现三才连梅颗粒可通过下调ASK1、JNK、NF-κB mRNA 表 达,调 节T2DM 合 并NAFLD模型大鼠肝细胞凋亡水平,保护肝脏功能。
综上,课题组初步证实,三才连梅颗粒通过干预ROS-ASK1-JNK/NF-κB 信号轴调节肝细胞凋亡而发挥改善T2DM 合并NAFLD 大鼠脂肪肝性肝炎及氧化应激反应,逆转或减轻NAFLD进展。
