基于水自由基阳离子快速检测甲醇和乙醇
2024-01-20段敏敏张小平胡平花袁艳春张兴磊陈焕文
段敏敏,张小平,胡平花,袁艳春,张兴磊,陈焕文,2
(1.东华理工大学,江西省质谱科学与仪器重点实验室,江西 南昌 330013;2.江西中医药大学药学院,江西 南昌 330004)
酒精饮料中含有乙醇,过量饮用会使肝脏代谢负荷加重,增加患病风险,严重时可直接致死。另外,一些酒精饮料的质量不达标,由向可食用酒精中掺入甲醇或直接用工业酒精兑水制备而成。一般由水果发酵得到的酒精或酒精饮料,由于果胶降解使其存在一定含量的甲醇[1],发酵过程中操作不当或设施落后等会导致甲醇含量超标。甲醇中毒会导致不可逆的组织损伤,对视网膜和视觉神经有极强的伤害,严重时甚至会导致死亡[2]。2018年,伊朗甲醇中毒事件造成76人死亡、460人住院、768人生病;2020年,关于饮酒可能对预防或治疗新型冠状病毒感染有积极作用的误导性信息,导致近300人死于甲醇中毒[3]。因此,开发一种简便、快捷的检测酒精饮料中甲醇和乙醇含量的方法对保护人们身体健康具有重要意义。
目前,用于检测甲醇含量的常规技术主要有高效液相色谱(HPLC)[4]、气相色谱(GC)[5]、气相色谱-质谱(GC-MS)等[6],这些方法的灵敏度高,可获得准确的检测结果,并能够进行多组分的分离检测[7],但样品前处理较复杂、分析成本高。此外,拉曼光谱法[8]也可用于甲醇的定量分析,操作简单、成本较低,但易受外部环境影响[9]。对乙醇的检测,最经典的方法是密度瓶法[10],具有设备简单、普及程度高的优点,但操作复杂。此外,还有分光光度法[11]、气相色谱法[12]和激光拉曼光谱法[13]等,但它们在测定甲醇和乙醇时,难以同时满足实际样品分析中简便、灵敏、快速和准确的需求。

本文拟采用常压电晕放电电离质谱技术,开发一种快速检测甲醇和乙醇含量的方法,以实现不同种类酒精饮料中甲醇和乙醇的直接快速定性与定量分析,旨为酒精饮料食品卫生安全问题的检测提供技术支持。
1 实验部分
1.1 主要仪器与装置
LTQ-XL-Orbitrap质谱仪:美国赛默飞科技有限公司产品,配有Xcalibur数据处理系统;LZB-3WB气体流量控制器:江苏省兴化市祥锦流量仪表厂产品;双通道型低能量电晕放电电离装置:本实验室自行研制;Ar气(纯度>99.999%):江西国腾气体有限公司产品。
1.2 主要材料与试剂
甲醇、乙醇:色谱纯,美国天地有限公司产品;D2O:剑桥同位素实验室有限公司产品;实验用水:浙江娃哈哈宏振饮用水有限公司产品;酒精饮料(啤酒A、白酒B和白酒C):购自当地超市。
1.3 实验条件
电晕放电电离源,正离子检测模式;质量扫描范围m/z15~200;毛细管温度150 ℃;毛细管电压27 V,透镜电压90 V,电离电压+2.5 kV;采用高纯氦气作为碰撞气,碰撞能量约20%~40%;其他参数由质谱仪系统自动优化得到。
1.4 实验方法
(H2O)2+·试剂离子与甲醇、乙醇的常压电晕放电电离质谱实时分析原理图示于图1。分别称取0.1、1.0 g液态的甲醇和乙醇,加入去离子水,制备成100、1 000 g/L溶液;再分别以上述溶液为母液,稀释成不同浓度(0.1、1.0、10.0、50.0、100、500、1 000 mg/L)溶液;将甲醇-乙醇水溶液进行质谱检测,以[甲醇-乙醇+水自由基阳离子]复合物信号强度与样品浓度之间的关系绘制标准曲线。将酒精饮料稀释100倍进行检测分析,根据标准曲线计算酒精饮料中甲醇、乙醇的含量。

图1 (H2O)2+·试剂离子与甲醇和乙醇的常压电晕放电电离质谱实时分析原理图Fig.1 Schematic diagram of real-time analysis of ambient corona discharge ionization mass spectrometry of reagent ions (H2O)2+· with methanol and ethanol
2 结果与讨论
2.1 水自由基阳离子与甲醇和乙醇的复合反应
利用自制的电离装置制备大量的水自由基阳离子(H2O)2+·,其质谱图示于图2a,可以观察到离子峰m/z36、37,分别对应(H2O)2+·和(H2O)2H+,其中,m/z36为基峰。利用氩气将甲醇引入装置,可以观察到水自由基阳离子的丰度明显下降,生成新的离子峰m/z50、51,初步推测m/z50为甲醇与水自由基阳离子相互作用生成的复合物[CH3OH+H2O]+·,示于图2b。将乙醇引入装置,m/z64、65的离子强度明显升高,推测为乙醇与水自由基相互作用生成的复合物[CH3CH2OH+H2O]+·,示于图2c。对甲醇-乙醇水溶液进行质谱分析,进样前、后水自由基阳离子及目标离子变化图示于图2d,可以观察到进样后水(H2O)2+·(m/z36)信号降低,目标峰[CH3CH2OH+H2O]+·(m/z64)信号迅速升高。

注:a.水自由基阳离子;b.甲醇与(H2O)2+·相互作用;c.乙醇与(H2O)2+·相互作用;d.进样前后(H2O)2+·及目标离子变化图图2 水自由基阳离子与甲醇和乙醇相互作用的质谱图Fig.2 Mass spectra of the interaction between water radical cation and methanol or ethanol
水自由基与甲醇、乙醇反应生成复合物的碰撞诱导解离质谱(CID-MS)图分别示于图3a、3b。由图3a可见,m/z50经碰撞活化产生碎片离子m/z33,其为[CH3OH+H2O]+·(m/z50)丢失OH(17 u)所得。由图3b可见,[CH3CH2OH+H2O]+·(m/z64)经碰撞活化得到碎片离子m/z46、47,分别是其丢失H2O(18 u)、OH(17 u)所得。为进一步验证(H2O)2+·与甲醇和乙醇的相互反应,用D2O代替H2O,结果示于图3c、3d,可以明显地观察到m/z52、66离子峰。[CH3OH+D2O]+·和[CH3CH2OH+D2O]+·的二级质谱图分别示于图3e、3f。由图3e可见,m/z52碰撞活化后丢失碎片OD(18 u)产生m/z34离子峰,与[CH3OH+H2O]+·(m/z50)裂解情况相同。由图3f可见,[CH3CH2OH+D2O]+·(m/z66)经碰撞解离产生m/z46、48,其中m/z46为乙醇的分子离子峰,是由[CH3CH2OH+D2O]+·(m/z66)丢失D2O(20 u)得到,m/z48是其丢失碎片·OD(18 u)得到,与[CH3CH2OH+H2O]+·(m/z64)裂解情况相同。因此,本实验验证了水自由基阳离子与甲醇和乙醇相互作用生成[甲醇-乙醇+水自由基阳离子]复合物。

注:a.[CH3OH+H2O]+·的二级质谱图;b.[CH3CH2OH+H2O]+·的二级质谱图;c.甲醇与(D2O)2+·相互作用的质谱图;d.乙醇与(D2O)2+·相互作用的质谱图;e.[CH3OH+D2O]+·的二级质谱图;f.[CH3CH2OH+D2O]+·的二级质谱图图3 甲醇-乙醇水自由基阳离子复合物的质谱图Fig.3 Mass spectra of complexes of methanol-ethanol water radical cation
2.2 水自由基阳离子与甲醇相互作用的条件优化
以甲醇为实验样品,对毛细管温度、两通道出口端之间的角度、电晕放电电离电压、针尖到质谱入口的距离等条件进行优化。毛细管温度的优化结果示于图4a。当温度低于160 ℃时,m/z50峰的信号强度逐渐增强;当温度高于160 ℃时,目标离子信号强度随温度升高呈下降趋势。因此,设置毛细管最佳温度为160 ℃。放电电压的优化结果示于图4b。在放电电压为2~2.5 kV时,随着电压升高,m/z50离子信号强度升高较显著;2.5 kV后变化不明显。因此,后续实验将放电电压设置为2.5 kV。样品通道与电离通道的角度会影响(H2O)2+·与样品反应的效率,因此,探究了不同角度对目标信号强度的影响,结果示于图4c,两通道之间角度保持50°时,(H2O)2+·与样品相互反应的效果最佳。针尖到质谱入口距离的优化结果示于图4d,最佳距离为8 mm。
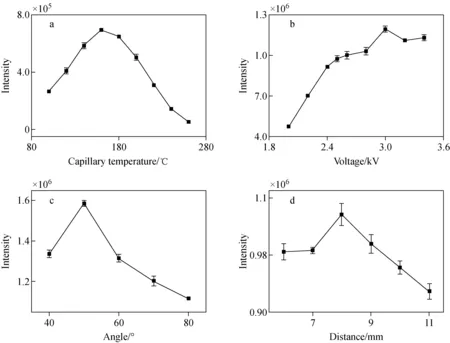
注:a.毛细管温度;b.放电电压;c.电离通道与样品通道的夹角;d.放电针尖与质谱入口的距离图4 实验条件优化Fig.4 Optimization of experimental conditions
2.3 不同浓度甲醇及乙醇的定量检测
以不同浓度的甲醇及乙醇溶液作为分析对象,绘制标准曲线,计算得到的检出限(LOD)分别为0.011、0.004 mg/L,定量限(LOQ)分别为0.038、0.014 mg/L。不同浓度的甲醇(0.1~1 000 mg/L)与(H2O)2+·相互作用得到的目标离子强度标准曲线示于图5a,相关系数为0.990 4,线性关系良好。基于m/z64绘制的标准曲线示于图5b,结果表明,在0.1~2 000 mg/L范围内,乙醇与(H2O)2+·相互作用生成复合物[CH3CH2OH+H2O]+·(m/z64)的信号强度与乙醇浓度具有较好的线性关系,相关系数为0.991 1。
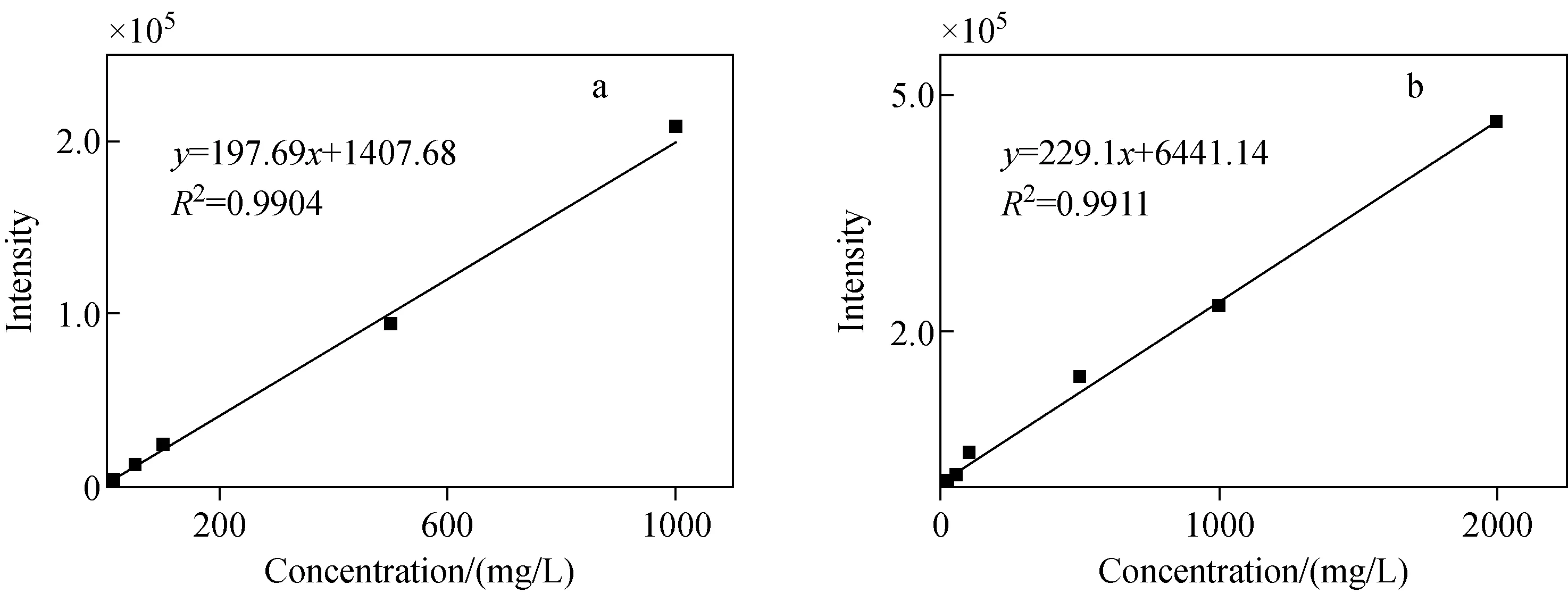
图5 甲醇(a)和乙醇(b)的标准曲线Fig.5 Standard curves of methanol (a) and ethanol (b)
2.4 实际酒类产品中甲醇及乙醇的检测
将本方法用于定量检测不同酒类(1种啤酒和2种白酒)中甲醇和乙醇的含量,未检出酒类产品中含有甲醇,因此以乙醇作为分析对象验证方法的可行性。啤酒A、白酒B和白酒C的指纹图谱示于图6,3种不同酒类样品中均可检测到目标离子峰m/z64、65,与乙醇标准品的目标峰一致,表明酒类产品中的乙醇可以与水自由基阳离子相互作用生成[CH3CH2OH+H2O]+·(m/z64)。3种酒精饮料中的乙醇含量分别为0.086 4、0.315 2和0.441 4 g/mL。其中,啤酒A中乙醇含量显著低于白酒,白酒B中乙醇含量低于白酒C。

注:a.啤酒A;b.白酒B;c.白酒C图6 不同酒类产品的质谱图Fig.6 Mass spectra of different wine products
根据白酒实际度数,可计算出白酒B(度数为40°)、白酒C(度数为56°)中理论乙醇含量分别为0.315 6、0.441 8 g/mL。结果表明,采用基于水自由基阳离子方法检测酒中乙醇含量与理论酒精度数高度吻合,准确度高达99.5%以上。
采用本方法对啤酒和白酒实际样品中的乙醇进行加标回收实验,结果列于表1。啤酒A与白酒B的回收率分别为116.06%、116.01%,表明采用常压质谱法检测实际样品中乙醇含量的结果较准确。

表1 实际样品检测结果Table 1 Results of actual samples
3 结论
本文基于常压电晕放电电离质谱技术,开发了一种快速检测甲醇和乙醇含量的方法。通过电晕放电电离空气中的水蒸气制备大量的水自由基阳离子,并使其与甲醇和乙醇发生复合反应,实现了甲醇和乙醇的直接快速定性与定量分析。采用该方法快速筛查3种酒类产品中的甲醇、乙醇含量,结果表明,在样品中未检测出甲醇,乙醇的检测结果与产品所标酒精度数高度吻合。该方法操作简单、经济环保、无需样品前处理,对含水复杂体系中甲醇和乙醇的定量检测具有指导意义。该方法同样适用于其他醇类化合物的检测,有望为食品领域等复杂体系中醇类化合物的快速分析检测提供技术支持。
