吡非尼酮浸泡生物羊膜对兔青光眼模型滤过术后瘢痕形成的作用
2024-01-20姚贻华郑扬菁朱益华
张 帅,姚贻华,郑扬菁,吴 平,朱益华
0引言
青光眼滤过术是目前治疗青光眼的主要方式之一,尽管近年来青光眼滤过术有了很大进步与改良,但术后过度纤维增殖、瘢痕形成引起滤过通道堵塞而导致的手术失败仍屡见不鲜。术中应用抗增殖药物是防止青光眼滤过术后滤过通道纤维瘢痕化的重要手段[1]。临床常用的术中抗增殖药物主要有丝裂霉素C(mitomycin C,MMC)和5-氟尿嘧啶(5-Fu)[2-3],但这些药物的抗增殖作用持续时间较短,且局部应用所引起的术后并发症不容忽视,术后低眼压、滤过泡漏、术后感染甚至眼内炎导致失明等严重并发症时有发生[4-6]。因此,寻求一种安全有效又毒副反应小的药物或更优给药方式以延长抗增殖作用的持续时间,从而达到更高的手术成功率仍是临床上期待解决的问题。吡非尼酮(Pirfenidone,PFD)是一种新型的广谱抗纤维化药物,能够有效防止和控制瘢痕的形成[7]。作为一种新型小分子抗代谢药物,其具有广谱的抗炎抗纤维化作用,能抑制胶原合成,下调多种细胞因子的产生,以及阻止成纤维细胞增殖,从而达到抗瘢痕的效果[8]。Kasar等[9]研究发现PFD可作为青光眼滤过术中抗增殖药物MMC的有效替代药物,而Westermeyer等[10]研究则表明0.5%PFD可以有效对抗青光眼滤过术后结膜的纤维化,且副作用很小,可以长期应用。羊膜作为眼科常用的生物材料,在多种角结膜眼病的治疗中应用广泛[11]。近年来,羊膜在青光眼滤过术中的应用愈发成熟[12],而羊膜移植联合小梁切除术是其在青光眼滤过术中最常见的应用[13],且安全性与有效性均得到很好验证[6]。然而,目前对于羊膜在青光眼滤过术中的应用研究多集中在促进上皮生长、抗炎、抗纤维化、抗菌及低免疫源性等生物学方面,而对于其机械结构相关的应用则鲜有报道,其5层海绵状的微观结构,使其可以像海绵一样吸附容纳一定的药物,成为优良的释药系统[14]。目前,关于PFD浸泡生物羊膜在青光眼滤过术中的抗瘢痕作用尚不明确,本研究拟将PFD浸泡生物羊膜用于兔青光眼模型滤过术中,评价其在滤过术后的抗瘢痕效果及安全性,探讨青光眼滤过区瘢痕化治疗给药的新途径。
1材料和方法
1.1材料
1.1.1实验动物和分组72只清洁级成年同种系新西兰白兔,雌雄不限,体质量2.5-3.0 kg,8-12周龄,裂隙灯显微镜检查眼前节排除眼部疾病,由福建医科大学实验动物中心提供,在相同环境下适应性饲养1 wk,动物饲养房和清洁级环境均达标准条件(湿度40%,温度18-25 ℃,光照与黑暗时间分别是12 h)。以右眼为实验眼,72只实验兔全麻下右眼(72眼)前房注入0.3%卡波姆溶液0.1 mL诱导青光眼模型,造模成功后随机分为0.5%PFD+生物羊膜组、单纯生物羊膜组、MMC组和空白对照组,每组实验兔18只18眼。实验遵循国家科学技术委员会发布的《实验动物管理条例》,遵从《善待实验动物的指导性意见》的相关伦理学规定,经福建医科大学附属第一医院医学伦理委员会医学研究与临床技术应用分会审核批准{批文号:闽医大附一伦理医研[2019]060号}。
1.1.2主要试剂和仪器主要试剂:PFD粉末(美国Sigma公司);生物羊膜(江西瑞济生物工程技术有限公司);卡波姆940(山东正大福瑞达药业集团);戊巴比妥钠粉末(德国Merck公司),用生理盐水制成3%戊巴比妥钠溶液备用;MMC粉末(日本协和发酵工业株式会社),配成0.2 mg/mL备用;转化生长因子(TGF)-β1亲和纯化兔抗体(sc-146,美国Santa Cruz公司)。主要仪器:回弹式眼压计(SW500,天津索维电子科技有限公司);光学显微镜(日本Olympus 公司);裂隙灯显微镜(苏州六六视觉股份有限公司);石蜡组织包埋机与切片机(德国Leica公司)。
1.2方法
1.2.1兔青光眼模型的制备采用前房注射复方卡波姆溶液的方法建立兔青光眼模型[15]。将150 mg卡波姆940粉末与12.5 mg地塞米松磷酸钠粉末溶于50 mL生理盐水中,制成含0.3%卡波姆和0.025%地塞米松的复方卡波姆溶液。采用3%戊巴比妥钠注射液4-5 mL肌肉注射全麻成功后,以右眼为实验眼,于颞上方位角膜缘处用1 mL注射器针头进针,抽取0.1 mL房水然后在前房瞳孔区注入等量的0.3%复方卡波姆溶液,术毕氧氟沙星眼膏点眼。操作均由同一位医生完成。造模成功的标准[15]:眼压稳定升高(>22 mmHg),持续时间>1 wk视为造模成功,期间眼压下降者可重复注射0.3%复方卡波姆溶液1次。
1.2.2兔青光眼模型滤过术的实施青光眼滤过术前取10 mg PFD粉末溶于2 mL超纯水中,制成浓度为5 mg/mL(0.5%)PFD溶液,将干燥生物羊膜(4 mm×5 mm)于无菌操作下浸泡于2 mL PFD溶液中5-10 min。所有实验兔均在造模成功后进行小梁切除术。麻醉方法同青光眼模型的制备,无菌生理盐水冲洗后常规消毒铺巾,开睑器开睑,上直肌缝线固定,制作以穹窿部为基底的结膜瓣及3 mm×4 mm 1/2厚度的巩膜瓣,分离至角膜透明区内1 mm,穿刺进入前房,缓慢放出房水,剪除约1 mm×2 mm相当于小梁的深层巩膜组织,并行虹膜根部切除,0.5%PFD+生物羊膜组在巩膜瓣下放置上皮层朝上4 mm×5 mm大小的PFD溶液浸泡的生物羊膜,单纯生物羊膜组在巩膜瓣下放置上皮层朝上4 mm×5 mm大小的生理盐水浸泡的复水生物羊膜,羊膜前端距小梁切口后缘1 mm,10-0尼龙线将羊膜在巩膜瓣两角各缝合1针,MMC组在巩膜瓣下放置浸有0.2 mg/mL MMC的棉片3 min后立即采用生理盐水冲洗,空白对照组制作巩膜瓣后,不放入任何植入物,后续依次缝合巩膜瓣与结膜瓣完成手术,术后氧氟沙星眼膏涂眼。手术均由同一位医生完成。
1.2.3临床观察指标
1.2.3.1眼压情况分别于造模前、造模后1、3、7、10 d,滤过术后1、3、7、14、21、28 d于清醒状态下采用回弹式眼压计测量术眼眼压,测量3次取平均值。
1.2.3.2滤过泡情况根据Kronfeld滤过泡形态和功能分型法[16],将滤过泡分为4型:Ⅰ型(微小囊泡型):薄壁、无血管、多呈微囊状;Ⅱ型(扁平弥散型):扁平、弥散、苍白状、相对壁厚;Ⅲ型(瘢痕型):无滤过泡,结膜充血微隆起,结膜下广泛黏连,在巩膜表面多血管外观;Ⅳ型(包裹型):局部圆顶状隆起,呈囊状增生,成为致密的球筋膜空腔。Ⅰ、Ⅱ型为功能性滤过泡,Ⅲ、Ⅳ型无功能滤过泡,记录功能性滤过泡的生存时间。
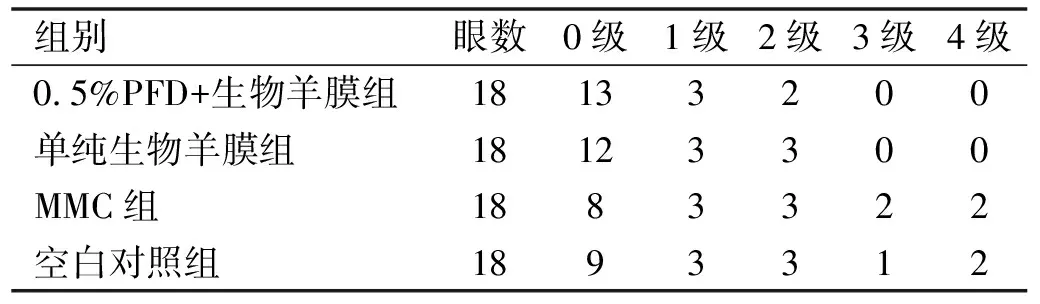
1.2.3.3毒副作用和并发症情况滤过术后1、3、7、14、28 d采用裂隙灯显微镜检查术眼情况,观察有无结膜漏、角膜溃疡、浅前房、低眼压等并发症。为便于准确观察,将前房内炎症反应予以分级,分级标准:0级为无细胞或光斑;1级为轻度,轻度到中度细胞或光斑;2级为中度,大量细胞和光斑,但无纤维素渗出;3级为显著,纤维素渗出较多;4级为重度,纤维素渗出非常多。浅前房定义为术后1 d未形成前房或前房形成数天后又消失。前房深度分级标准[17]:浅Ⅰ级,全周前房极浅,周边前房呈裂隙状小于1/5角膜厚度;浅Ⅱ级:可分a、b两型,Ⅱa级:仅虹膜小环以内有极浅前房,Ⅱb级:仅瞳孔区内有极浅前房;浅Ⅲ级:虹膜、晶状体全部与角膜相贴,前房完全消失。
1.2.4病理学检查
1.2.4.1组织标本的制备滤过术后28 d,各组随机选取6只实验兔于耳缘静脉注射过量戊巴比妥钠溶液实施安乐死,立即摘除右眼眼球放入福尔马林液中固定48 h,剪取滤过区组织(结膜、巩膜)4 mm×2 mm后依次浸入70%、80%、95%、95%、100%、100%乙醇各40 min进行梯度脱水,并垂直角膜缘方向石蜡包埋后以4 μm厚连续切片,制成石蜡切片,4 ℃保存备用。
1.2.4.2HE染色取石蜡切片按照福建医科大学附属第一医院病理科标准操作流程在不同浓度二甲苯及无水乙醇中固定脱蜡后进行苏木精-伊红(HE)染色,并脱水透明树胶封片,在100倍光学显微镜下观察滤过区增生情况,炎症细胞为球形,成纤维细胞为长条状,细胞核蓝色深染,每张切片随机选择5个视野,记数成纤维细胞和炎症细胞数量,取平均值,拍照并记录数据。
1.2.4.3Masson染色取石蜡切片同HE染色步骤脱蜡后进行苏木精、丽春红及苯胺蓝染色,脱水透明树胶封片,在100倍光学显微镜下观察胶原纤维增生情况,蓝色为胶原纤维,细胞质、肌纤维和红细胞呈红色,细胞核呈蓝褐色,拍照采集图像。
1.2.4.4免疫组织化学染色取石蜡切片同HE染色步骤脱蜡后进行磷酸盐缓冲液(PBS)冲洗、抗原修复、血清封闭、滴入稀释后的兔抗兔TGF-β1多克隆抗体(工作浓度1∶100),室温孵育后滴加DAB显色剂显色,并脱水透明树胶封片。每张切片随机选取5个视野,在400倍光学显微镜下观察TGF-β1抗原表达情况,以细胞浆显深棕色为强阳性反应,淡黄色为弱阳性反应,呈细颗粒状或弥漫性分布,拍照并采集图像,采用Image J图像分析系统获取TGF-β1阳性细胞光密度值,取平均值。
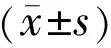
2结果
2.1眼压情况造模前,4组实验兔右眼眼压基本一致,差异无统计学意义(F=0.417,P=0.741)。造模后1 d,4组实验兔右眼眼压即开始升高,于造模后2、4 d分别有5、3只实验兔右眼眼压较前降低,且前房白色絮状混浊反应消失,故分别给予重复注射0.3%复方卡波姆溶液1次,继续监测所有实验兔右眼眼压,造模后10 d眼压皆可达26-31 mmHg,且4组实验兔右眼眼压基本一致,差异无统计学意义(F=0.107,P=0.956,表1),表明造模成功。
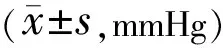
表1 各组造模前后眼压比较
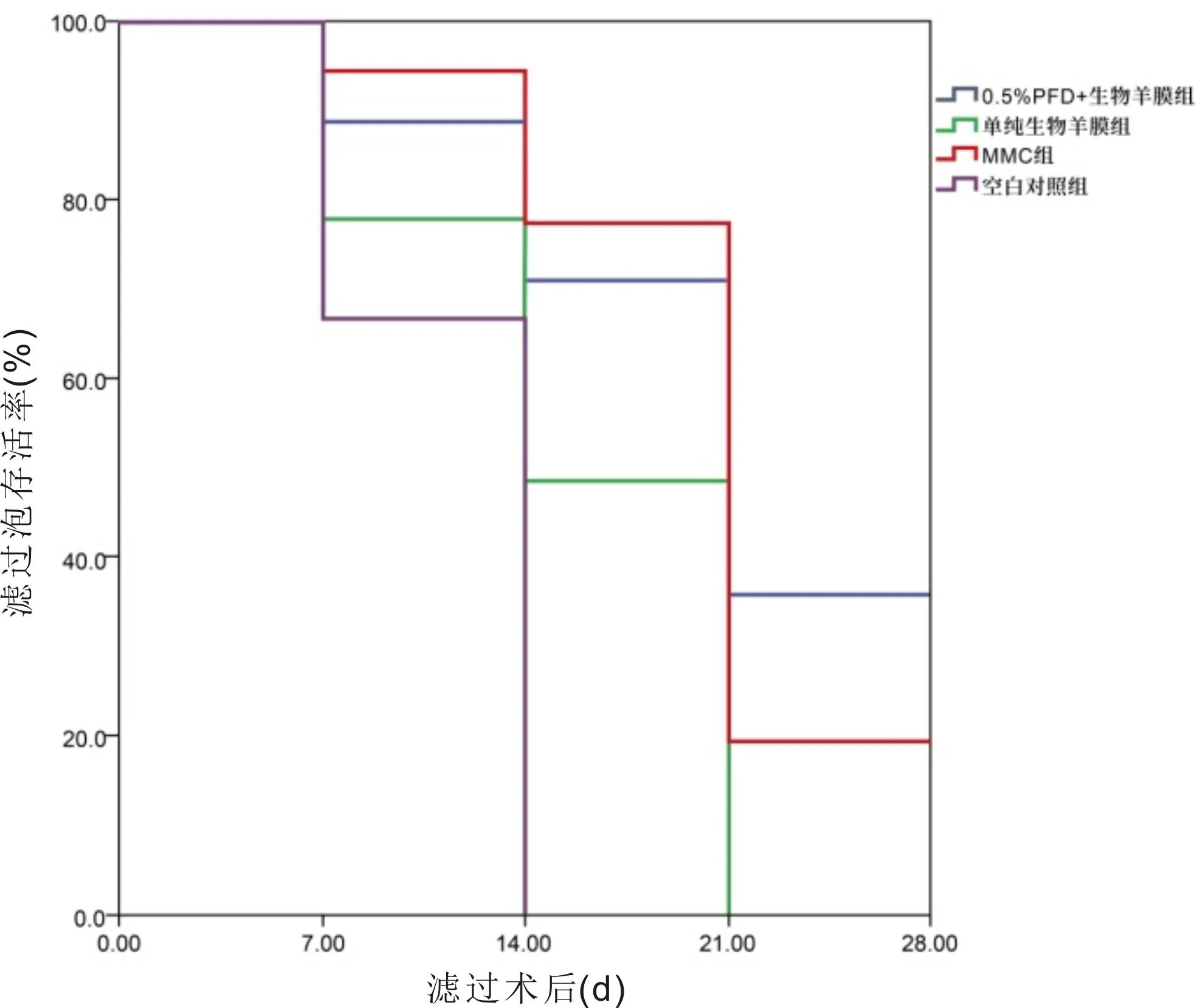
滤过术后1、3、7、14、21、28 d,4组实验兔右眼眼压比较,具有时间差异性、组间差异性及交互效应(F时间=405.145,F组间=417.86,F时间×组间=9.405,均P<0.001,表2)。滤过术后1、3、7 d,4组实验兔右眼眼压比较,MMC组<0.5%PFD+生物羊膜组<单纯生物羊膜组<空白对照组,差异均有统计学意义(P<0.01);滤过术后14、21、28 d,4组实验兔右眼眼压比较,0.5%PFD+生物羊膜组 表2 各组滤过术后眼压比较 2.2滤过泡情况滤过术后1 d,4组实验兔右眼滤过泡均呈现扁平弥散外观,而随着观察时间的延长,各组实验兔右眼滤过泡出现不同变化。0.5%PFD+生物羊膜组与MMC组于滤过术后28 d时仍可见功能性滤过泡,且0.5%PFD+生物羊膜组较MMC组隆起更明显,新生血管更少,而空白对照组与单纯生物羊膜组分别于滤过术后14、21 d变为无功能滤过泡。Kaplan-Meier生存分析曲线显示,4组实验兔右眼滤过术后滤过泡存活率具有明显统计学差异(log rank=16.803,P=0.01,图1)。 图1 各组滤过术后滤过泡的Kaplan-Meier生存分析曲线。 2.3毒副作用和并发症情况滤过术后28 d内,4组实验兔右眼结膜均可见不同程度的充血及角膜混浊与水肿,但均未出现明显的结膜漏、角膜溃疡及浅前房等并发症,前房存在不同程度的炎症反应,各组间炎症反应情况差异无统计学意义(H=2.250,P=0.522,表3)。 表3 滤过术后28 d内各组前房炎症反应情况比较 眼 2.4病理学检查情况HE染色结果显示,滤过术后28 d,4组实验兔右眼滤过区炎症细胞和成纤维细胞数量差异均有统计学意义(P<0.001,图2,表4),其中0.5%PFD+生物羊膜组实验兔右眼滤过区成纤维细胞和炎症细胞数量均较单纯生物羊膜组、MMC组与空白对照组更少,差异均有统计学意义(P<0.05);单纯生物羊膜组与MMC组、空白对照组比较,差异均有统计学意义(P<0.05);MMC组与空白对照组比较,差异有统计学意义(P<0.001)。 图2 各组滤过术后28 d滤过区病理变化 黑箭头示炎症细胞,黄箭头示成纤维细胞,红箭头示TGF-β1阳性细胞。 Masson染色结果显示,滤过术后28 d,0.5%PFD+生物羊膜组实验兔右眼滤过区可见中等量的胶原纤维增生,颜色浅,胶原之间排列整齐;单纯生物羊膜组可见大量胶原纤维组织增生,颜色深,胶原之间排列密集;MMC组可见较多量胶原纤维增生,颜色略深,胶原之间排列仍规则,稍紧密;空白对照组可见大量胶原纤维增生,颜色深,胶原纤维紊乱排列,并形成密集瘢痕(图2)。 免疫组织化学染色结果显示,滤过术后28 d,0.5%PFD+生物羊膜组实验兔右眼滤过区着染TGF-β1细胞浆面积小,颜色浅;单纯生物羊膜组可见较多量细胞浆着染TGF-β1,颜色深;MMC组可见细胞浆中等量着染TGF-β1,颜色较深;空白对照组可见细胞浆大量着染TGF-β1,颜色深。4组实验兔右眼滤过区TGF-β1阳性细胞光密度值差异有统计学意义(P<0.001,图2,表4),其中0.5%PFD+生物羊膜组实验兔右眼滤过区TGF-β1阳性细胞光密度值较单纯生物羊膜组、MMC组与空白对照组更小,差异均有统计学意义(P<0.05);单纯生物羊膜组与MMC组、空白对照组比较,差异均有统计学意义(P<0.05);MMC组与空白对照组比较差异有统计学意义(P<0.001)。 研究表明,青光眼滤过术后滤过通道堵塞的主要原因是滤过区成纤维细胞持续增殖,以葡萄糖胺聚糖和胶原为主的细胞外基质的形成与沉积,导致结膜下组织纤维发生瘢痕化,最终引起滤过术所建立的外引流通道变得狭窄甚至完全关闭[18]。而TGF-β、血小板衍化生长因子(PDGF)和血管内皮生长因子(VEGF)等细胞因子的过度表达在青光眼滤过术后瘢痕形成过程中扮演关键作用,这些细胞因子可以诱导成纤维细胞的活化与增殖,并向受损组织迁移,导致纤维化的产生[19]。Zhu等[20]研究通过分离青光眼滤过术后结膜囊成纤维细胞进行培养,证实TGF-β可促进成纤维细胞过度活化,导致细胞增殖、迁移和细胞外基质合成,瘢痕出现,而通过对TGF-β进行调控则可抑制其对成纤维细胞的激活作用。Millá等[21]发现青光眼滤过术后滤过区增殖明显的患者结膜囊成纤维细胞培养液中VEGF与TGF-β浓度比正常人明显升高。而Sun等[22]发现在青光眼滤过术后结膜下注射抗VEGF药物康柏西普可提高滤过泡存活率。因此,通过抑制TGF-β、PDGF及VEGF等细胞因子进而抑制成纤维细胞增殖和向受损组织迁移将减少纤维化及瘢痕的形成,达到抗青光眼滤过术后滤过区瘢痕化的效果。临床实践与研究发现,建立青光眼滤过术的实验模型有助于了解术后切口愈合过程,进而揭示瘢痕形成的原因,而兔是青光眼滤过术实验模型最常用的动物,因其角膜平均水平径与人眼非常接近,可以在兔眼上进行与人眼一样的青光眼滤过术[23],且在滤过术中或术后应用抗增殖药物、滤过术中在结膜瓣与巩膜瓣下植入生物材料机械隔离滤过区结膜与巩膜及对给药方式进行改良让抗增殖药物在滤过区存留时间尽可能延长是对抗青光眼滤过术后滤过区瘢痕形成的有效措施[19]。故本实验对兔进行青光眼造模后施行经典的小梁切除术,观察青光眼滤过术后眼压、滤过泡、毒副作用及并发症等指标,并对滤过区组织进行病理检查[24]。 PFD作为有效的细胞因子抑制剂,其可通过下调肝、肾、肺等多种器官纤维化过程中成纤维细胞生长因子(bFGF)、TGF-β、结缔组织生长因子(CTGF)、PDGF等多种细胞因子的活化与表达,从而降低成纤维细胞的生物学活性,引起基质胶原合成被抑制与细胞增殖的减少,进而发挥抗瘢痕作用[25-31],并可通过抑制白介素(IL)-6等炎性介质及肿瘤坏死因子(TNF)-α的分泌发挥抗炎效果[32]。PFD还可通过抑制Ⅰ型与Ⅲ型胶原蛋白的表达达到抗纤维化的作用[33]。特发性肺纤维化是其目前主要临床适应证,研究亦证实PFD对心脏、肾脏及肝脏的纤维化和多发性硬化症等纤维化疾病有较好的疗效[29]。在眼科领域,PFD也被证实可通过上述途径发挥其优良的抗纤维化作用[34]。陈旭等[35]进行的体外实验结果显示,通过下调TGF-β/Smad通路中TGF-β3的表达,PFD可以抑制兔Tenons囊成纤维细胞增殖。Jung等[36]将PFD应用于Ahmed青光眼引流阀植入术后的兔眼,通过对滤过泡组织进行HE染色、Masson染色及免疫组织化学染色发现PFD可以抑制TGF-β及CTGF的活化,减少胶原沉积,并提出PFD可作为青光眼术后抗增殖的有效手段。Sun等[37]对兔眼局部使用PFD后发现0.5%的PFD是一个比较安全有效的浓度。Zhong等[38]发现在兔青光眼模型滤过术后滴用0.5%的PFD滴眼液可提高小梁切除术后滤过泡的存活率,进一步证明PFD可能成为青光眼滤过术中有效且安全的抗瘢痕药物。 羊膜存在于胎盘的最内层,薄且透明,不含神经、血管和淋巴组织,不产生明显免疫源性,无同种异体排斥反应,组织相容性高,故具有良好的安全性[39]。得益于冷冻与干燥技术的发展,羊膜的获取变得更加容易,价格也更加低廉,且在保证其生物、物理和组织学特性的条件下,羊膜还可以进行长时间保存[40]。羊膜的多层细胞结构与富含的多种细胞因子使其具有抗炎、抗瘢痕、抗菌及促进组织再生修复等优良特性[41-42]。因此,将羊膜应用于青光眼小梁切除术中,达到了良好的抗瘢痕效果。本研究结果显示,与空白对照组相比,单纯生物羊膜组滤过泡存活率提高,可维持更低的术后眼压,减轻炎症细胞与成纤维细胞增生,抑制TGF-β1表达,减少青光眼滤过术后滤过区胶原纤维的沉积,且对组织刺激性小,毒副作用轻,无明显并发症,安全性高。Yadava等[43]在原发性青光眼患者小梁切除术中植入羊膜并进行为期1 a的随访观察,发现羊膜组在维持更低的眼压、提高滤过泡存活率方面有明显优势,且无明显并发症。 在电子显微镜下可见羊膜由上皮细胞层、基底膜、致密层、成纤维细胞层和海绵层构成,而网状纤维和胶原纤维布满基底膜,这些纤维之间相互缠绕形成网状结构,网孔之间直径大小约为0.5-15 μm[6],类似海绵结构,故可以像海绵一样吸附定量的药液,容纳定量的药物,成为一种“药库”,任何直径小于羊膜网孔的微粒物质均能储存其中。由于杰出的组织支架作用,生物羊膜在口腔和牙周手术、眼科、心脏等领域已经得到广泛应用[14]。Zou等[44]曾将PFD与5-500 nm的纳米颗粒脂质体相结合制成平均粒径为346.6±62.21 nm的PFD脂质体,故将生物羊膜浸泡于0.5%的PFD溶液中,羊膜将会包含一定量的PFD。Ling等[45]研究描述了生物羊膜在PBS中降解的过程,从第1 wk到第4 wk,生物羊膜重量逐渐减少至8%,且胶原纤维不断变薄,密度不断降低,最后微绒毛丢失,失去结构的完整性,呈现出空心与多孔的外观,表明随着时间推移,其微观结构可逐渐降解,故储存于纤维支架内的药物颗粒可以被逐渐释放,是一个持续而缓慢的动态过程。研究发现,青光眼术后约14 d,羊膜将于巩膜组织内溶解,对羊膜进行交联,则可延长羊膜的溶解时间[46],而青光眼滤过术后滤过区瘢痕形成通常在术后14 d[47]。本研究中,单纯生物羊膜组、MMC组与空白对照组三组眼压在滤过术后14 d后升高幅度较大,这与切口的瘢痕愈合机制有关,切口在滤过术后约14 d愈合,瘢痕形成,其后滤过通道不断被堵塞,故随着时间延长眼压出现明显升高,而0.5%PFD±生物羊膜组在术后各观察时间点眼压变化较平稳,波动较小,能在更长时间保持更低的眼压,提示储存于羊膜组织中的PFD可随着羊膜胶原纤维的逐渐降解而被缓慢地释放出来,在术后瘢痕形成期内不断维持局部有效的药物浓度,效果优于一次性给药。Zhang等[48]通过2 a时间随访观察5-Fu浸泡生物羊膜联合小梁切除术在原发性开角型青光眼患者中的疗效发现,5-Fu浸泡生物羊膜可以长时间维持滤通道的通畅、降低术后眼压、减轻相关并发症,从而提高小梁切除术的成功率,这与本研究方法大致相同,不同之处在于生物羊膜负载药物不同,但研究结果基本相似。 此外,本研究进行组织病理检查结果证明,0.5%PFD浸泡生物羊膜组可以在兔青光眼模型滤过术后一定时间内抑制滤过区胶原纤维的沉积,维持滤过通道的开放,具有明显且持久的抗瘢痕作用。Fayzullin等[49]在动物实验中将聚乳酸和PFD结合制成药物输送系统并通过HE染色与免疫组织化学染色等方法观察到持续的抗纤维化作用,本研究也用类似方法得出相同结论。本研究还发现0.5%PFD浸泡生物羊膜对兔眼组织刺激性小,毒副作用少,无明显并发症,安全性高,这与Zhong等[38]关于PFD对兔眼的毒性反应研究结果相一致。 综上,本研究发现PFD浸泡生物羊膜在兔青光眼模型滤过术后的抗瘢痕效果是多重的,其既可以利用羊膜的物理学特性机械隔离滤过区结膜与巩膜起到机械屏障的抗纤维化作用,又能够通过羊膜自带的多种细胞因子而发挥抗炎、抗瘢痕的生物学特性,还可以利用羊膜的组织学特性成为一种优良的缓释系统,以增加抗瘢痕药物在局部的存留时间,达到持久的抗瘢痕效果。这种将抗瘢痕药物与缓释系统相结合的方法有望成为青光眼滤过术后抗瘢痕治疗的新方向与新希望。然而,该方法的长期疗效和安全性及更优的给药组合还需要更多的实验与研究证实,如通过交联的方式延长羊膜的降解时间,通过纳米技术将PFD制成更稳定安全的脂质体,并进行多中心、大样本的临床试验进一步确定其在临床实践中的作用。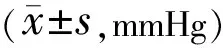

3讨论
