可生物降解PBAT 微塑料对土壤理化性质及上海青生理指标的影响
2024-01-20李成涛吴婉晴陈晨张勇张凯
李成涛,吴婉晴,陈晨,张勇,2,张凯
1. 陕西科技大学环境科学与工程学院,陕西 西安,710021;2. 西南大学资源与环境学院,重庆 400715;3. 澳门科技大学澳门环境研究院,澳门
塑料因其成本低、延展性好、经久耐用等优点,被广泛应用于工农业生产和日常生活中(侯军华等,2020),已和钢铁、木材、水泥并列成为当今世界四大支柱材料,常见种类有聚乙烯、聚丙烯、聚苯乙烯、聚酰胺等。然而,大量的废弃塑料在环境中长期残留,难以回收且大多难降解,造成严重的“白色污染”(Liu et al.,2014)。由于石油资源的日益稀缺,加上传统塑料引发的“白色污染”问题愈发严重,可生物降解塑料应运而生,成为国内外学者的研究热点(刁晓倩等,2020)。其中聚对苯二甲酸-己二酸丁二醇酯(butyleneadipate-coterephthalate,PBAT)作为一种热稳定性、力学性能、生物降解性优良的材料,在对抗“白色污染”问题中具有重要的使用价值(林源,2019)。
微塑料(Microplastics,MPs)指粒径小于5 mm的塑料纤维、颗粒和碎等(Thompson et al.,2004;Xu et al.,2020),在水、土、气、沉积物等环境介质中被广泛检出,有研究指出,全球每年农用土壤中微塑料的输入量远超过海洋,陆地生态系统中可能含有比海洋更大的(微)塑料储层(邵媛媛等,2020)。当土壤中的微塑料达到一定量时,会对土壤理化性质、功能、微生物多样性及植物生长等产生影响,从而诱发生态风险(Rillig et al.,2020),甚至威胁人类健康。可生物降塑料虽然能够降解,但其在自然环境中降解周期会持续3—36 个月,降解过程更加复杂,可能会对土壤理化性质(潘雄等,2021)、土壤植物(刘晓红等,2022)产生更强的毒性效应。
目前,关于可降解微塑料对土壤生态系统、农作物生长的影响研究仍处于起步阶段。先前关于不可降解微塑料对土壤理化性质的研究表明,聚乙烯微塑料能增加土壤团聚体稳定性和团聚体总有机碳,但会降低团聚体活性有机碳含量(胡旭凯等,2021)。有研究推测微塑料对土壤生态系统的影响与其引起的土壤物理性质变化密切相关,且淀粉基可生物降解微塑料可以改变根际土壤细菌群落和挥发性物质的排放(Qi et al.,2020)。土壤中的微塑料容易附着在种子表皮或根系细胞壁,堵塞种子囊及细胞壁的孔隙,影响种子、根系正常吸收或运输水分和营养,最后造成植物生长迟缓(廖苑辰等,2019)。研究将未使用的可生物降解塑料覆盖物的化合物释放到水溶液中,发现会抑制生菜和番茄根的生长,改变地上部分发育的形态(Serrano-Ruíz et al.,2020);类似地,当在含有聚乳酸微塑料的土壤中生长时,玉米地上部分生物量及叶绿素含量会降低(Meng et al.,2021)。目前关于可生物降解微塑料对土壤理化性质、农作物生长及其交互作用的影响研究仍不充分,需要进一步研究。
本文选取典型的农作物蔬菜上海青(Brassica chinensisL.)作为供试植物,以传统不可降解微塑料聚丙烯(PP)为对照探究不同粒径、不同浓度的可生物降解PBAT 微塑料对土壤理化性质及农作物生长的影响,通过测定微塑料对土壤总氮、总磷、水稳性团聚体及植物不同生长阶段发芽率、超氧化物歧化酶活性、过氧化物酶活性、丙二醛含量的影响,并对微塑料填埋前后表面形态进行观察,以及各指标的相关性分析推测微塑料对上海青的影响机制,研究结果对于综合评价可生物降解微塑料对土壤—植物系统的影响及其生态毒性具有重要意义。
1 材料和方法
1.1 微塑料的制备
将洗净并干燥后的PBAT、PP 塑料母粒(广东亮颖塑化有限公司)经球磨机机械破碎后,通过筛分得到粒径分别为<0.1 mm、0.1—0.2 mm、0.2—1.0 mm 的MPs 颗粒。
1.2 土壤的采集
试验所用土壤采自陕西科技大学(中国西安)的土地,取自地下10—20 cm 左右深度,去除土壤中石头及其他大块杂物后,使用5 目(4 mm)筛网对土壤进行筛分后风干。土壤的主要性质如下:pH 7.9,土壤容重1.28 g·cm-3,土壤孔隙率49.4%,总氮 (160±5.35) mg·kg-1,总磷 (382±21.1) mg·kg-1。
1.3 发芽试验与盆栽试验
上海青种子购自于上海市闵行区种子公司,试验前用质量分数为10%的次氯酸钠溶液进行消毒,并用去离子水进行冲洗。在盆钵中装入100 g自然土壤,并将2 种不同粒径的PBAT-MPs、PP-MPs 分别按照质量分数0.022%、0.22%、2.2%添加到土壤中(Wang et al.,2020),每盆放入20 粒种子,并设置1 个不添加MPs 的空白对照组(CK),每组3 个平行。将播种好的盆钵放入人工气候培养箱中,培养条件为:恒温25 ℃、相对湿度75%、12 h 光照/12 h 黑暗周期培养。种子发芽试验周期为10 d,在7 d 时进行取样计算种子发芽率;盆栽试验周期为30 d,分别在15、30 d 时进行取样。
1.4 对MPs 填埋前后表面形态的观察
采用密度浮选法对土壤中质量分数为2.2%的MPs 进行分离提取(Li et al.,2020),洗净干燥后将样品在溅射镀膜机(SBC-12,中国)上进行金的溅射镀膜,然后再利用高分辨场发射扫描电镜对样品进行SEM 分析,原始MPs(0 d)作为空白对照组,样品在10 kV 的高真空下成像,观察其表面形态的变化。
1.5 土壤理化性质的测定
土壤中总氮测定采用凯氏法,总磷的测定采用碱熔-钼锑抗分光光度法,水稳性团聚体的测定采用湿筛法。
1.6 上海青生长参数的测定
1.6.1 发芽率、根长以及茎长的测定
将种子放在光照培养箱中进行培养,记录在规定的天数内每天发芽的种子数,计算出占供试种子的百分率,即为发芽率。将幼苗从盆钵中取出后,用去离子水将幼苗根部土壤去除,擦干水分,将幼苗排列整齐,拍取照片,利用Image J 软件对幼苗根长、茎长进行测量。
1.6.2 根系活力的测定
根系活力的测定采用氯化三苯基四氮唑(TTC)法(Lian et al.,2020)。
1.6.3 丙二醛(MDA)含量的测定
丙二醛(MDA)含量的测定采用硫代巴比妥酸法(Zhu et al.,2020),在酸性和高温条件下,MDA 能够和硫代巴比妥酸(TBA)反应生成红棕色的三甲川(3, 5, 5-三甲基恶唑-2, 4-二酮),其最大吸收波长在532 nm。
1.6.4 超氧化物歧化酶(SOD)的测定
超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑法(Saleh et al.,2017)。
1.6.5 过氧化物酶的测定
过氧化物酶(POD)活性的测定采用联苯胺法(Yu et al.,2021)。
1.7 数据方法
每组数据重复测定 3 次取平均值,利用Microsoft 2010 Excel 软件计算均值和标准差,采用Origin 8.0 软件绘图,采用SPSS 17.0 软件进行单因素方差分析,显著性水平设为0.01<P<0.05,极显著水平设为P<0.01。
2 结果与讨论
2.1 不同MPs 在不同填埋时间下的表面形态观察
不同粒径的PP-MPs 在不同填埋时间的表面形态变化如图1所示。通过与初始形态对比可以看出,无论是15 d还是30 d的SEM图像都显示了PP-MPs表面并没有什么变化,均较为光滑且没有裂痕、空洞的出现,说明PP-MPs 在填埋期间并没有发生降解过程,与其本身的不可降解的性质一致。

图1 PP-MPs 表面特征扫描电镜图Figure 1 Scanning electron microscopy of PP-MPs
不同粒径的PBAT-MPs 在不同填埋时间的表面形态变化如图2 所示。可以明显的看到随着填埋时间的增加,15 d 和30 d 时的PBAT-MPs 表面形态出现了不同程度的降解痕迹。15 d 时,<0.1 mm和0.1—0.2 mm 的PBAT-MPs 表面出现细小的孔洞与轻微的裂痕,但是0.2—1 mm 的PBAT-MPs 表面并没有什么明显的变化,这可能是因为粒径越小的MPs 其比表面积越大,在单位面积内附着的微生物越多,受到的侵蚀程度越大;30 d 时,<0.1 mm 和0.1—0.2 mm 的PBAT-MPs 出现的孔洞与15 d 相比已经变大且致密,而0.2—1 mm 的PBAT-MPs 也出现了不规则的深坑。

图2 PBAT-MPs 表面特征扫描电镜图Figure 2 Scanning electron microscopy of PBAT-MPs
上述结果表明可生物降解微塑料PBAT 可能在土壤中微生物的作用下已经发生降解过程,而不可降解微塑料PP 由于性质稳定,在短时间内并未发生明显降解,其表面形态的微小变化可能是由土壤的扰动等物理作用引起。
2.2 不同MPs 的添加对土壤理化性质的影响
2.2.1 对土壤总氮的影响
图 3 为不同粒径、不同浓度的 PP-MPs、PBAT-MPs 在不同填埋时间下对土壤总氮(TN)的影响。整个填埋期间内,PP-MPs 的添加会使得土壤TN 的含量先升高后降低,可能由于PP-MPs 在其内表面创造了一个额外的厌氧环境,可以促进反硝化细菌的生长和反硝化活动(Li et al.,2020)。15 d 时,与CK 和PP-MPs 组相比,PBAT-MPs 的添加未对土壤TN 产生显著性影响,但一定程度上增加了土壤TN 含量,与对照组相比最高增加了13.15%;30 d 时,PBAT-MPs 的添加均显著增加了土壤TN 含量,这可能是由于PBAT-MPs 的存在增加了土壤固氮菌的存在(Wang et al.,2020)。
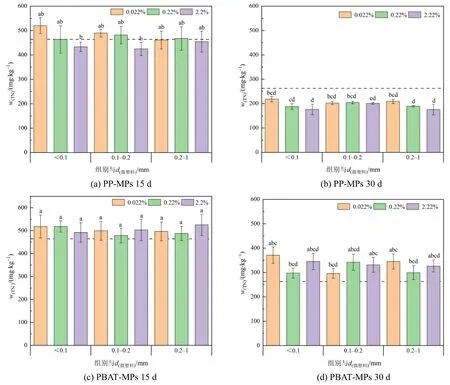
图3 不同粒径不同添加浓度的两种MPs 对土壤总氮影响Figure 3 Effects of two kinds of MPs with different particle size and concentration on TN in soil
2.2.2 对土壤总磷的影响
图 4 为不同粒径、不同浓度的 PP-MPs、PBAT-MPs 在不同填埋时间下对土壤总磷(TP)的影响。15 d 时,粒径<0.1 mm 的PP-MPs 会使土壤TP 含量随着填埋浓度的升高而增加,而2.2%的0.1—0.2 mm 和0.2—1 mm 的PP-MPs 会降低土壤TP 含量;<0.1 mm 的PBAT-MPs 会降低土壤TP 含量,而 0.1—0.2 mm 和 0.2—1 mm 的PBAT-MPs 会增加TP 含量。30 d 时,PP-MPs 的添加会促进土壤TP 含量,PBAT-MPs 的添加对土壤TP 含量的影响不显著。

图4 不同粒径不同添加浓度的两种MPs 对土壤总磷影响Figure 4 Effects of two kinds of MPs with different particle size and concentration on TP in soil
PP-MPs 在前期会降低TP 含量,这与前人研究一致(Dong et al.,2021),在研究中还发现在磷含量下降的同时酸性磷酸酶(ACP)也在下降,这表明土壤中磷的下降可能是由于ACP 酶活性下降引起的。PBAT-MPs 降低土壤TP 的含量可能是由于MPs 对磷的物理吸附作用,先前研究表明,高分子聚合物会通过物理作用吸收磷,减少土壤对其的吸收,MPs 对土壤中磷的吸附和解吸可能会增加磷的浸出损失(吾兰·恩特马克,2021),并且不同种类的微塑料对磷的吸附也存在较大差异(Li et al.,2021)。
综上,土壤中MPs 的积累可能会影响土壤生态系统中的氮磷循环过程,并且MPs 的种类、粒径、浓度及填埋时间不同会对土壤TN、TP 含量产生不同影响,产生变化的原因可能是MPs 本身的性质影响土壤孔隙度等理化性质,改变土壤中微生物群落结构(Miao et al.,2019)、氮、磷循环酶等相关酶的活性(Awet et al.,2018)以及相关功能基因的表达(Qian et al.,2018),同时塑料添加剂的释放也会影响土壤生态环境的平衡(Lü et al.,2022),可生物降解微塑料的降解产生的纳米塑料也会对土壤中微生物细胞的自由基产生破坏,进而影响土壤生态系统中氮、磷的循环。
2.2.3 对土壤水稳性团聚体的影响
图 5 为不同粒径、不同浓度的 PP-MPs、PBAT-MPs 在不同填埋时间下对土壤中水稳性团聚体的影响。15 d 时,粒径<0.1 mm 的PP-MPs、PBAT-MPs 均会增加土壤水稳性团聚体的含量,大于0.1 mm 时团聚体的含量随PBAT-MPs 浓度的增加而增加;30 d 时,PP-MPs 整体提高了土壤水稳性团聚体含量,粒径<0.2 mm 的PBAT-MPs 变化规律与15 d 一致,而对于0.2—1 mm 的PBAT-MPs,土壤团聚体含量随着浓度的升高而降低。通过对两种MPs 的横向对比,发现PP-MPs 对土壤水稳性团聚体的增加主要是集中<0.25 mm 的团聚体,而PBAT-MPs 集中在0.25—1 mm 团聚体。
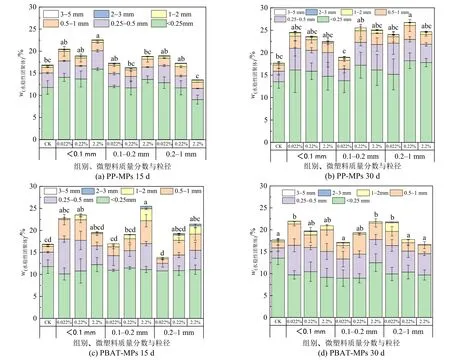
图5 不同粒径不同填埋时间下的MPs 对土壤水稳性团聚体的影响Figure 5 Effects of MPs with different particle sizes and landfill time on soil water-stable macroaggregates
先前已有研究报道MPs 的添加会改变团聚体的分布(Boots et al.,2019),这与我们试验结果一致,两种MPs 的添加会对团聚体粒径范围的分布影响不同可能是因为添加的MPs 与土壤聚集体结合,改变颗粒内的结合机制并干扰宏观团聚体的形成。现有研究表明,土壤中有机碳是形成水稳性团聚体的重要粘合剂,对填埋MPs 土壤的有机碳参数的测量研究发现,MPs 的添加使土壤有机碳比空白对照增加了40%以上(Kim et al.,2021),表明MPs 本身可能是土壤中碳的一个重要来源,本研究中MPs 的外源添加使得水稳性团聚体的增加可能与该原因有关。而土壤团聚体的降低可能是因为土壤中MPs 的疏水性、表面电荷、表面功能和颗粒大小都会对土壤中水分存在的状态产生影响,同时MPs 在土壤中还会发生降解,随着填埋时间的延长,它与土壤颗粒的粘结作用会加强,但同时MPs 也有可能会进入到土壤团聚体中影响土壤的孔隙状态,进而影响水稳性团聚体的含量。
2.3 不同MPs 的添加对上海青生理指标的影响
2.3.1 对发芽率、根长、茎长的影响
植物的发芽率是植物良好生长的一个重要因素。图6 为不同粒径、不同浓度的PP-MPs、PBAT-MPs 对上海青种子发芽率的影响。与对照组相比,0.1—0.2 mm 和0.2—1 mm 的PP-MPs 对发芽率有显著的抑制作用;<0.1 mm 的PBAT-MPs 对植物的发芽的抑制作用最明显,随着添加浓度的升高发芽率分别降低了18.75%、21.9%、37.5%,0.1—0.2、0.2—1 mm 的PBAT-MPs 对种子发芽率的影响不显著。已有研究表明传统石油基微塑料PP 能够降低园林水芹种子的发芽率(Spa et al.,2020),这与本研究结果一致。PBAT 对发芽率的影响可能是由于小粒径的PBAT 微塑料会降低土壤的孔隙率,进而抑制了种子发芽率。
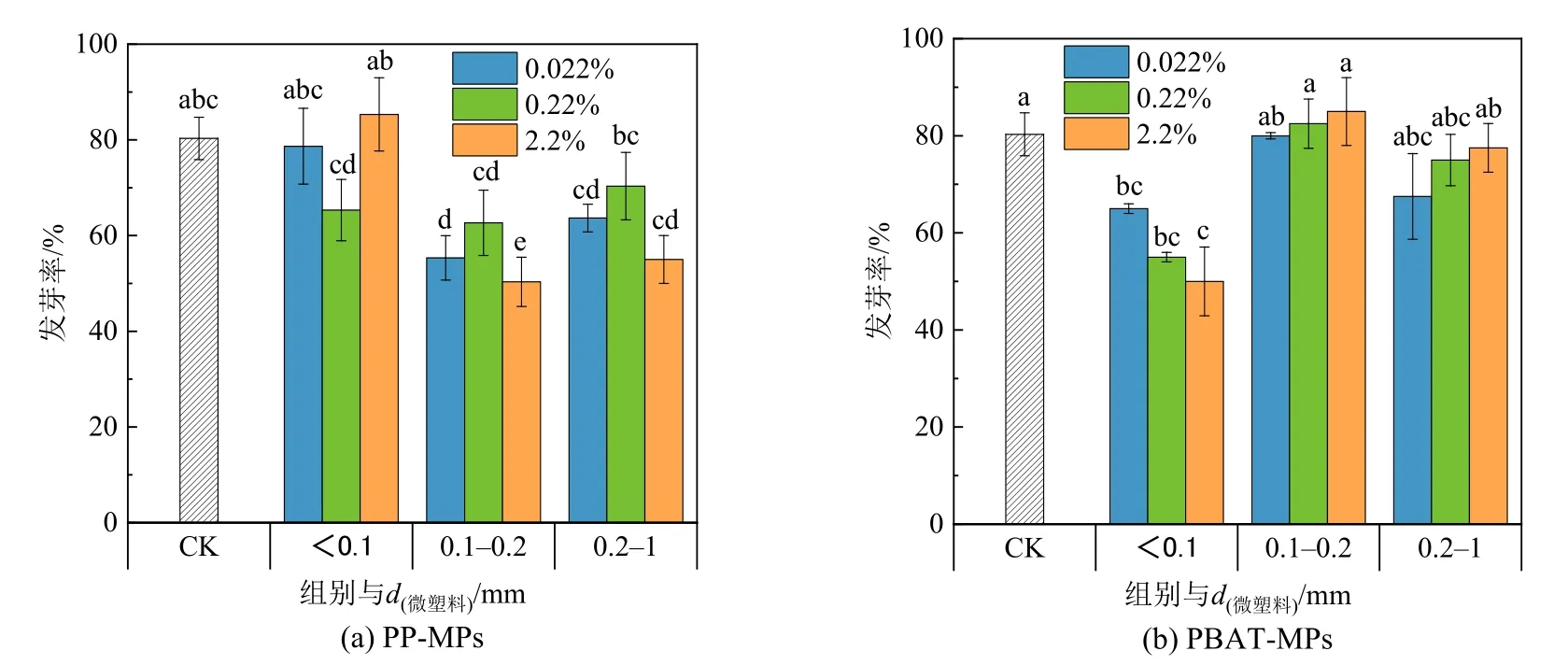
图6 不同MPs 的添加对上海青种子发芽率的影响Figure 6 Effects of different MPs on germination rate of Brassica Chinensis L.seeds
图 7 为不同粒径、不同浓度的 PP-MPs、PBAT-MPs 对上海青生长过程中根长的影响。15 d时,与对照组相比,0.2—1 mm 的PP-MPs 对根长具有显著抑制作用,而到30 d 时抑制作用逐渐消失。PBAT-MPs 在15 d 时显著抑制根长,30 d 时抑制作用减弱,且<0.1 mm、0.1—0.2 mm 两个粒径组的根长会随着填埋浓度的增加而降低,呈现出剂量—毒性效应。MPs 在前期对植物根系生长产生抑制作用可能是由于MPs 的添加会增加土壤容重,从而改变土壤的结构,增加了植物根系的穿透阻力,影响根的伸长,有研究表明塑料在土壤中的降解会产生聚乙烯醇,会抑制植物根系的生长(林涛等,2019),而PBAT 在降解过程中会释放出己二酸和对苯二甲酸,它们被证明了会限制植物的生长(Serrano-Ruíz et al.,2018)。小粒径PBAT 微塑料对根长的剂量效应表明可生物降解材料虽被证明是安全的,但是在超过一定阈值可能会抑制植物生长(Wang et al.,2015)。
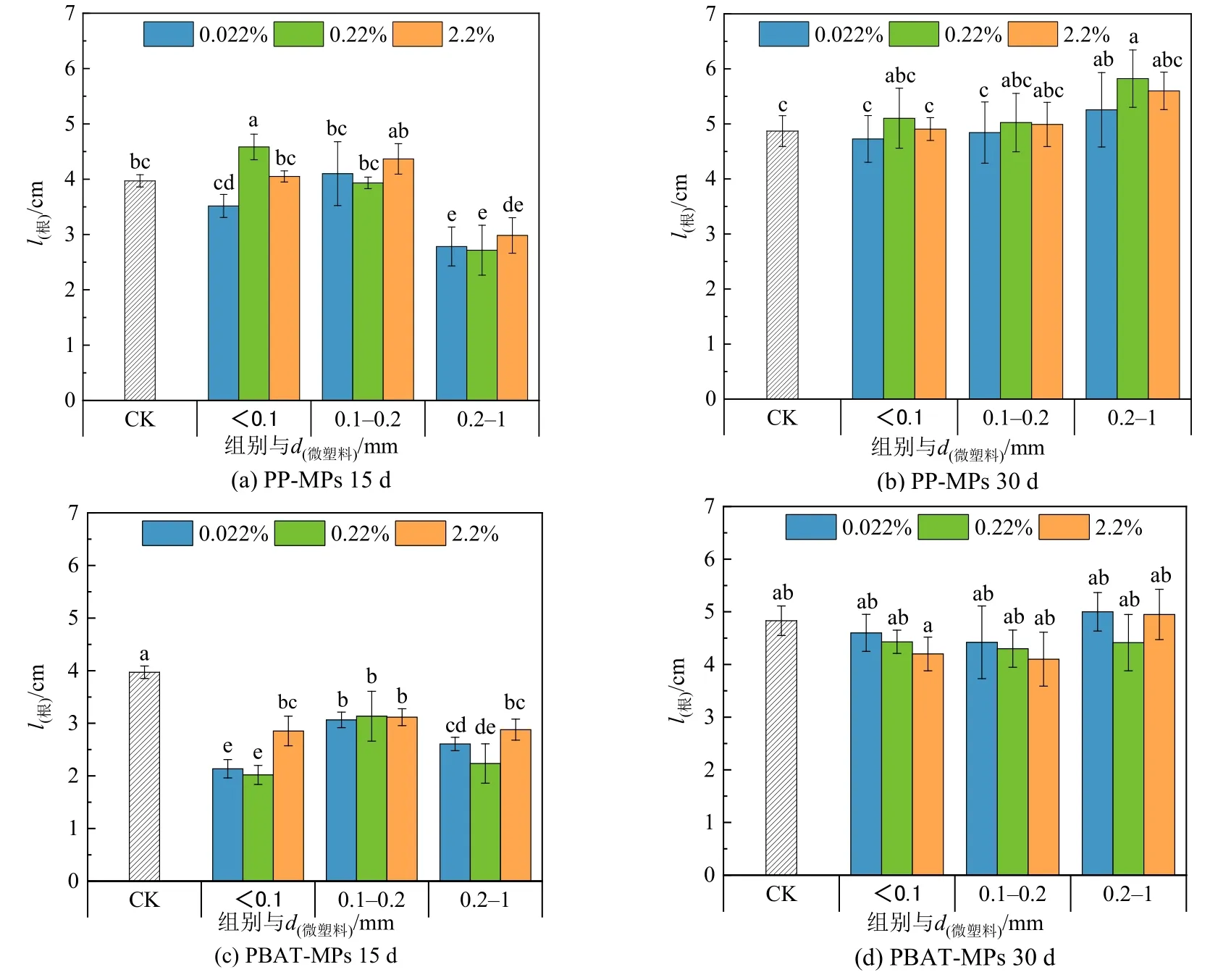
图7 不同MPs 的添加对上海青根长的影响Figure 7 Effect of different MPs on root length of Brassica Chinensis L.
图 8 为不同粒径、不同浓度的 PP-MPs、PBAT-MPs 对上海青茎长的影响。无论是15 d 还是30 d,不同粒径PP-MPs 处理下,茎长均会随着MPs 浓度的增加而增加,与对照组相比,且大粒径PP-MPs 会对茎长有明显的抑制作用。15 d 时,PBAT-MPs 的添加会抑制茎长,其中<0.1 mm、0.2—1 mm 的PBAT-MPs 的抑制作用更显著;30 d 时,可能由于植物的自身调节作用,抑制作用减弱,甚至产生促进作用。大粒径的PP-MPs 对茎长的抑制可能是因为它的添加破坏了土壤的结构,影响了植物对营养物质的吸收,从而影响上海青的生长发育,PBAT-MPs 对茎长的影响可能与合成高聚物的单体有关,降解过程中长链会发生断裂,PBAT 中的己二酸和苯系物的出现,这会对植物的生长造成影响(Wang et al.,2015)。
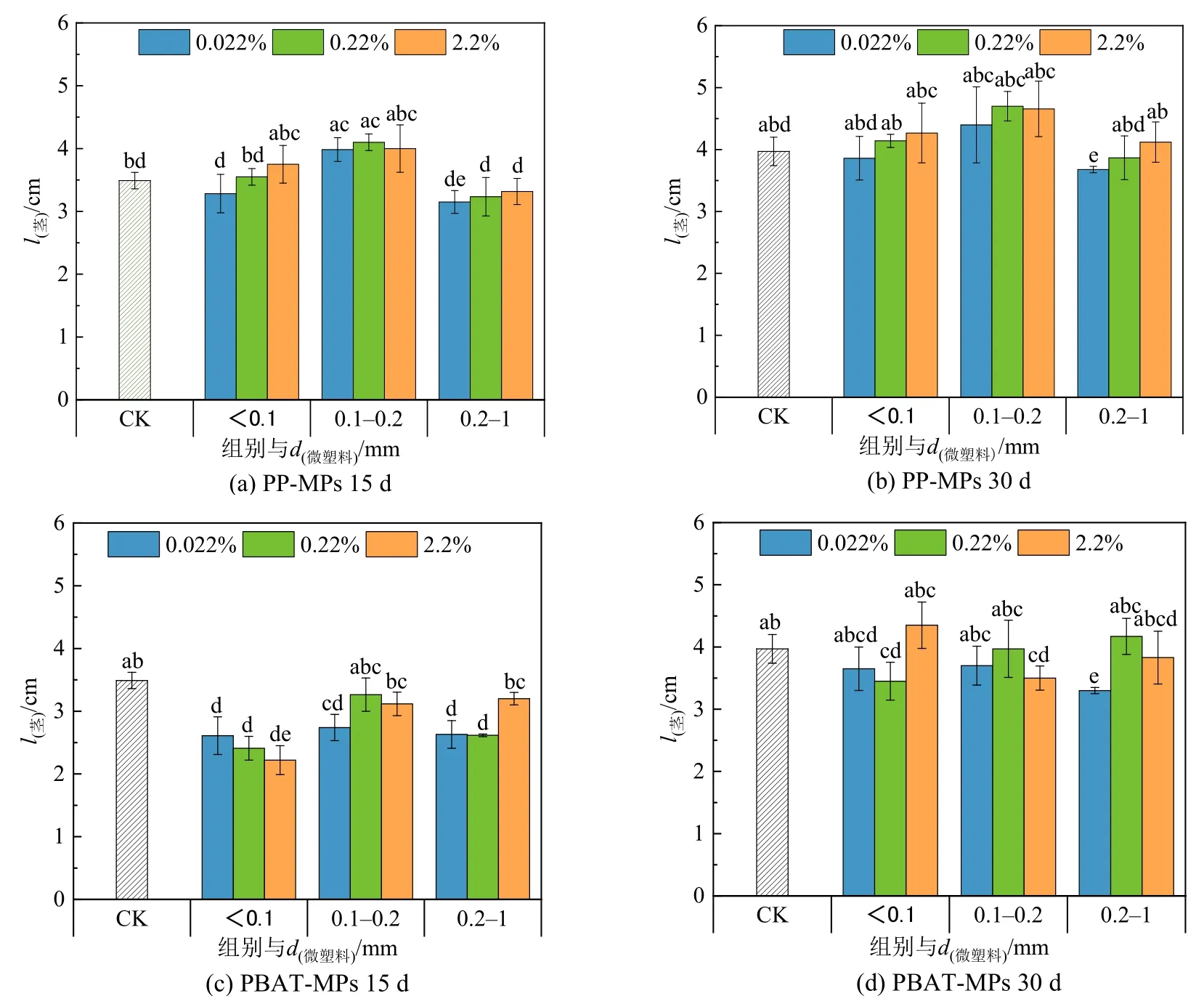
图8 不同MPs 的添加对上海青茎长的影响Figure 8 Effect of different MPs on stem length of Brassica Chinensis L.
2.3.2 对根系活力的影响
图 9 为不同粒径、不同浓度的 PP-MPs、PBAT-MPs 对上海青生长过程中根系活力的影响。15 d 时,PP-MPs 对根系活力有一定的促进作用,且大粒径的促进作用强于小粒径,30 d 时与对照组相比没有显著性变化。PBAT-MPs 在15 d 时抑制植物根系活力,30 d 时小粒径PBAT-MPs 的抑制作用减轻,而0.2—1 mm 的PBAT-MPs 仍具有显著的抑制作用,但总体而言MPs 对根系活力的抑制在植物自身调节作用下减弱。PP-MPs 的添加对根系活力没有显著影响可能是由于化学结构较稳定不易降解(de Souza Machado et al.,2018),对土壤性质影响不显著,而PBAT-MPs 可能由于促进土壤根际细菌的生长,与植物根系争夺养分,从而对根系活力产生影响(Van Weert et al.,2019)。
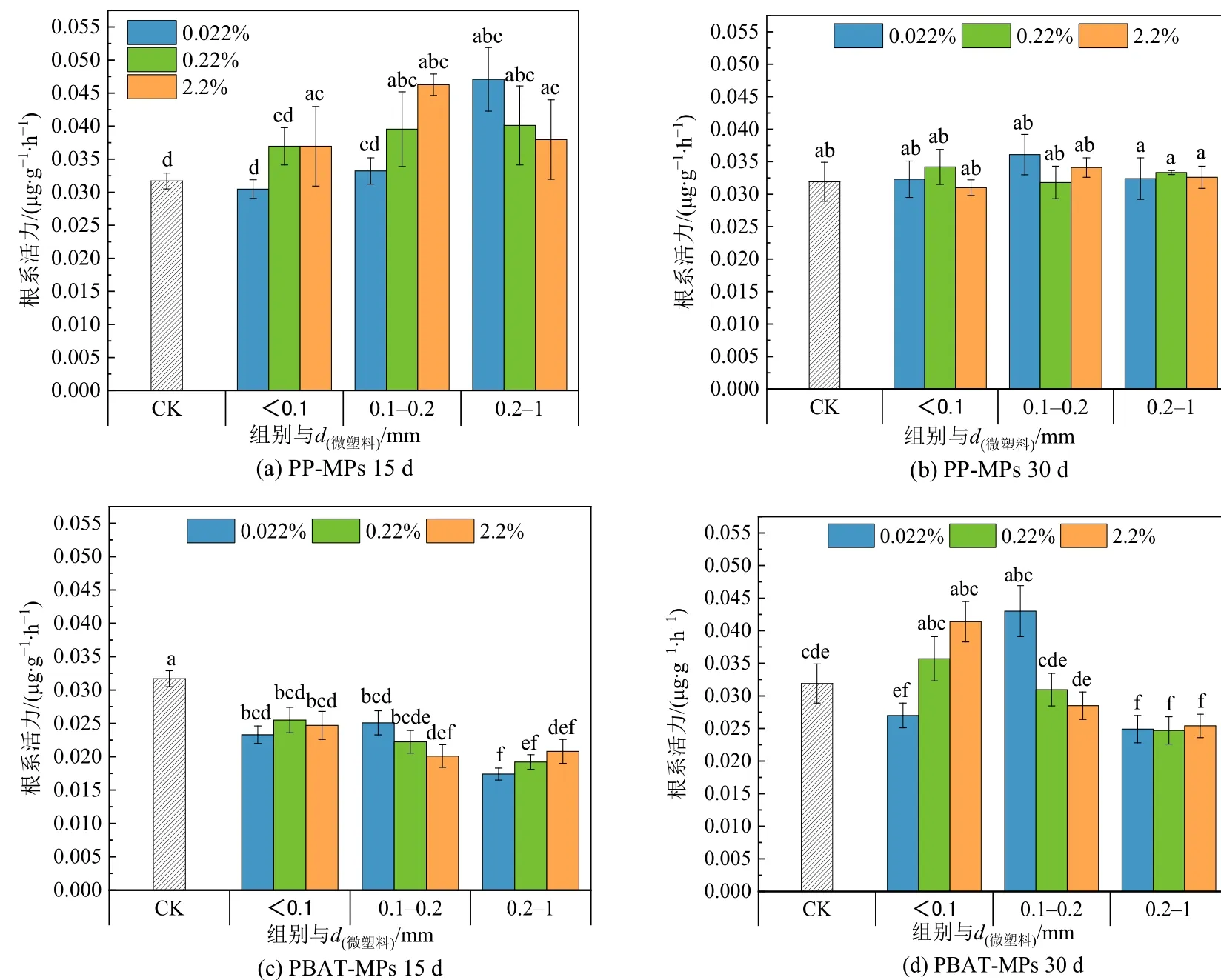
图9 不同MPs 的添加对上海青根系活力的影响Figure 9 Effect of different MPs on root vigour of Brassica Chinensis L.
2.3.3 对叶片丙二醛含量的影响
图10 为不同粒径、不同浓度的PP-MPs、PBAT-MPs 对上海青生长过程中叶片MDA 含量的影响。15 d 时,PP-MPs 会增加MDA 含量,这说明细胞质膜过氧化程度高,细胞膜可能受到损伤,30 d 时,<0.1 mm 和0.1—0.2 mm 的PP-MPs 未对MDA 含量产生显著影响,而0.2—1 mm 的PP-MPs依然会增加上海青MDA 含量,说明粒径越大对其影响越大。15 d 时,PBAT-MPs 的添加降低上海青MDA 含量,未对植物造成脂质过氧化,30 d 时,<0.1 mm的高浓度PBAT-MPs显著增加MDA含量,导致上海青产生较强的脂质过氧化,这可能是因为粒径较小的PBAT-MPs 降解程度更大,降解产物对上海青产生较强的胁迫作用。

图10 不同MPs 的添加对叶片MDA 含量的影响Figure 10 Effect of different MPs on MDA content in leaves
2.3.4 对叶片超氧化物歧化酶活性的影响
图11 为不同粒径、不同浓度的PP-MPs、PBAT-MPs 对上海青生长过程中叶片SOD 活性的影响。15 d 时,<0.1 mm 和0.2—1 mm 的PP-MPs会增加SOD 的活性,说明PP-MPs 的添加会增加活性氧(ROS)的产生,从而激发了SOD 的活性,30 d 时,与对照组相比,PP-MPs 均显著提高了SOD活性,说明ROS 含量过高,植物建立起保护机制,产生更多的SOD 来清除植物体内的ROS 自由基。15 d 时,0.1—0.2 mm 的PBAT-MPs 提高了SOD 活性,说明上海青此时在遭受环境胁迫;30 d 时,<0.1 mm 和0.1—0.2 mm 的PBAT-MPs 提高了SOD 活性,但0.1—0.2 mm 的高浓度PBAT-MPs 反而会抑制SOD 活性,这说明高浓度的添加量已经超过植物本身自我调节的阈值。

图11 不同MPs 的添加对叶片SOD 活性的影响Figure 11 Effect of different MPs SOD activation in leaves
2.3.5 对叶片过氧化物酶活性的影响
图12 为不同粒径、不同浓度的PP-MPs、PBAT-MPs对上海青生长过程中叶片POD活性的影响。15 d 时,0.1—0.2 mm 的高浓度PP-MPs 显著增强POD 活性,但其它两个粒径对POD 活性产生抑制,结合本文2.3.4 部分分析可能是因为由于前期<0.1 mm 和0.2—1 mm 的PP-MPs 并未激活POD 酶活性,因而导致SOD 活性激增,30 d 时,各试验组与对照组相比没有显著性差异。15 d 时,PBAT-MPs 对POD 活性影响不显著但也产生了抑制,造成SOD 活性的激增;30 d 时,<0.1 mm 的高浓度PBAT-MPs 与0.2—1 mm 的低浓度PBAT-MPs显著降低了POD 活性,对应了本文2.3.4 中的SOD活性升高,说明植物在消耗POD 以消除SOD 产生的H2O2。酶的活性在短时间内的暂时增加是一种调节行为,可以保护植物自身免受外部的压力和毒害,而活性的降低又代表着酶的调节能力已经到了阈值并受到了伤害,这说明可生物降解MPs 对上海青毒性机制可能涉及氧化损伤(廖苑辰等,2019)。

图12 不同MPs 的添加对叶片POD 活性的影响Figure 12 Effect of different MPs on POD activation in leaves
2.4 指标相关性分析
图13 为两种MPs 填埋后土壤与植物各指标间的相关性分析,图中椭圆面积越小表示相关系数绝对值越大。从PP-MPs 的指标相关性分析可以看出,SOD 活性与MDA 活性息息相关,它们同处于抗氧化系统,建立防护机制并且帮助植物清除体内的ROS,TP 对水稳性团聚体呈现正相关作用,同时POD 也会促进茎长的生长;从PBAT-MPs 的指标相关性分析可以看出土壤TP 对根系活力、发芽率、根长和茎长呈现正相关,而MDA 含量与根系活力、发芽率和茎长之间呈现负相关,表明PBAT 引起土壤TP 含量增加时可促进上海青的生长,MDA 含量的适当降低对上海青生长有利。此外,对MPs 种类、粒径、添加量与土壤TN、TP、水稳性团聚体及上海其各生理指标间进行多因素方差分析,结果表明,15 d 时MPs 种类与上海青茎长、根系活力及 MDA 含量之间存在显著相关性,其中PBAT-MPs 对上海青影响更大,与其他指标相关性不显著,推测可能是由于此时PBAT 微塑料发生了一定降解,与不可降解微塑料相比其表面更粗糙,对土壤中的营养元素吸附及富集作用更强,进而对上海青茎长、根系活力、MDA 含量影响更大;30 d时MPs 种类、粒径、添加量与各测定指标间均无显著性相关,表明此时不同种类、粒径、添加量的微塑料对土壤及上海青造成的影响无显著性差异。
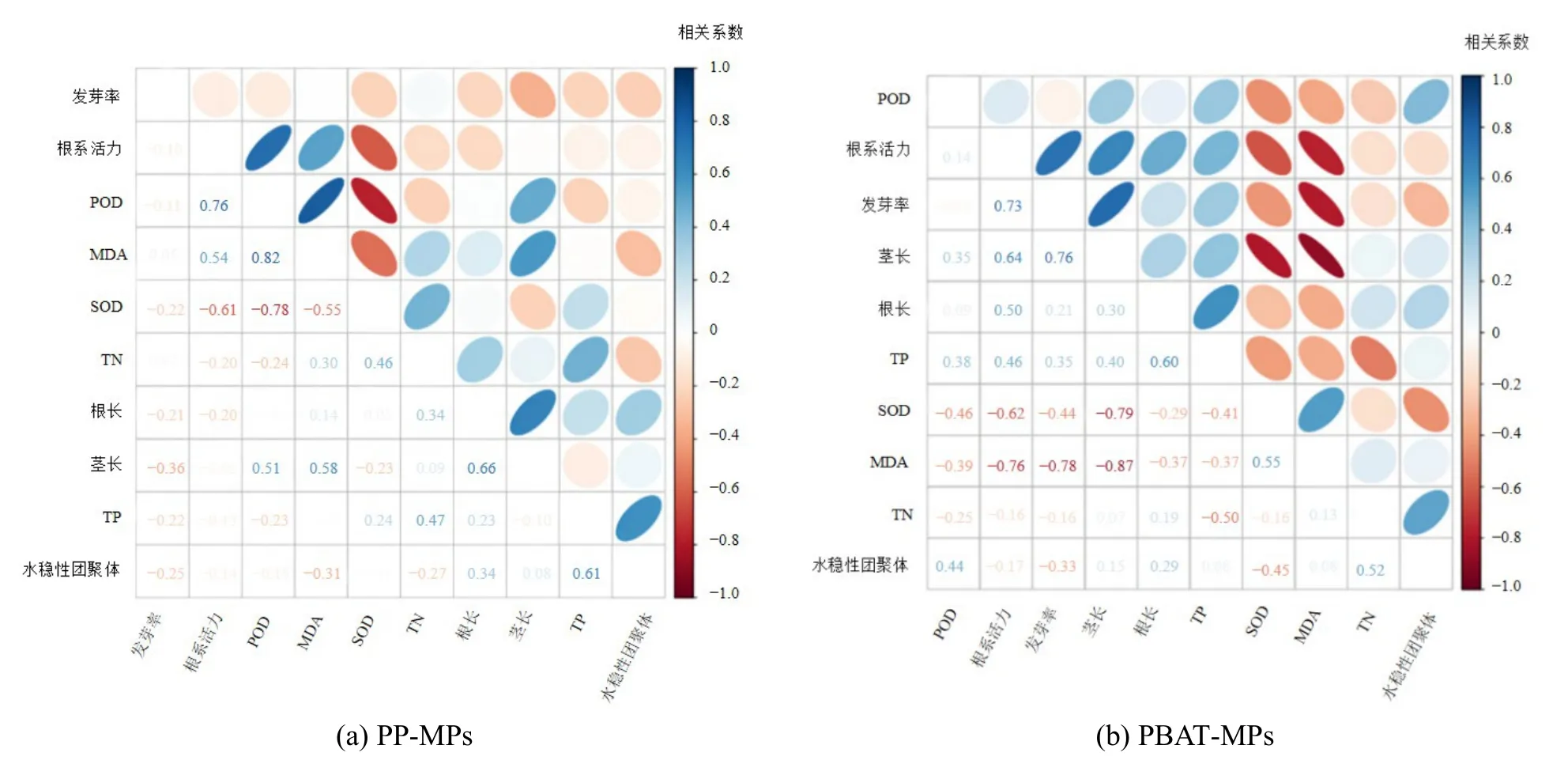
图13 各指标间的相关性分析Figure 13 Correlation analysis of each index
由于众变量之间存在一定的相关性,故不能依赖某一个或两个指标对MPs 对上海青的影响进行评价。结合已有研究,MPs 与植物根部相互作用的过程中,对植物组织造成机械性伤害,对植物的影响主要为物理损伤所引起(邵雪纯等,2023),而可生物降解微塑料的暴露除了会造成物理损伤之外,还可通过触发植物体内抗氧化酶活性的变化,导致氧化应激反应,从而影响植物生长,且可生物降解微塑料产生的降解中间产物可能会加剧生物体内的氧化应激反应(Souza et al.,2013)。
结合之前的研究,推测MPs 对上海青的影响机制(图14):MPs 会物理附着在植物的根系,从而阻碍上海青对养分的吸收以及对根长、茎长产生影响,MPs 的添加也会改变土壤的孔隙度,这会增加土壤生态系统中的养分通量,加速水分流失,进而会影响根系的下扎;添加的MPs 可能与土壤聚集体结合,进而会改变土壤颗粒内的结合机制并干扰水稳性团聚体的形成;同时可生物降解材料PBAT-MPs 也会在填埋期间在微生物的作用下发生降解行为,这其中也会产生中间产物(例如己二酸和对苯二甲酸等),同时还有塑料中的添加剂也会释放到土壤中,这就会对土壤的微生物以及酶活性产生影响,会影响硝化酶和反硝化酶的活性,从而影响土壤中的氮循环;MPs 也会通过物理作用,吸附土壤中的磷,从而会改变土壤中的TP 的变化;由于土壤生态系统的改变,植物生长会受到影响,所以植物为了防止产生膜脂质过氧化而带来的DNA 损伤或是改变细胞膜的结构和功能,上海青的防御基因会被激活,抗氧化剂酶诱导通路被激活,帮助自身解毒。整体而言,不可降解微塑料PP 对上海青的影响可能是由于其与植物根部相互作用的过程中,对植物组织造成机械性伤害,影响生理指标的变化,而可生物降解微塑料的暴露除了造成物理损伤,可能还会触发生物体内抗氧化酶活性的变化,进而导致氧化应激反应,从而影响植物生长,且其降解中间产物可能会加剧植物体内的氧化应激反应。
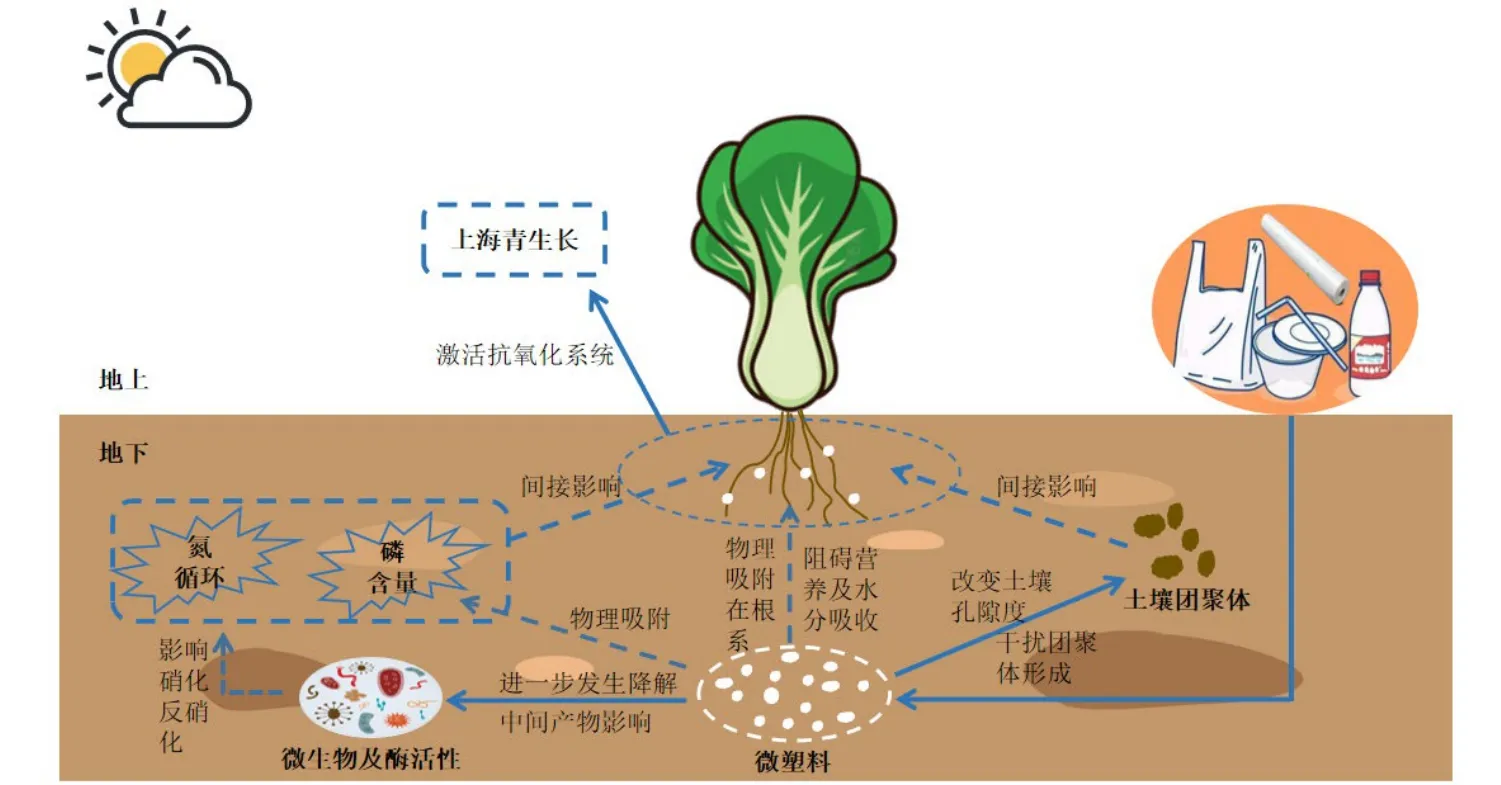
图14 MPs 对土壤理化性质和上海青生长影响机制Figure 14 Mechanisms of MPs effects on soil physicochemical properties and growth of Brassica Chinensis L.
3 结论
1)与不添加MPs 的对照相比,PP-MPs 的添加会导致土壤中TN 含量的下降,PBAT-MPs 会增加土壤TN 含量,可能会促进土壤生态系统的氮循环;PP-MPs 会使土壤TP 先降低后升高,PBAT-MPs先降低TP 含量后与对照组基本持平;两种MPs 的添加整体会增加土壤中水稳性团聚体,并影响团聚体的粒径分布。
2)不同粒径、添加量的PP、PBAT 微塑料对上海青的发芽率、根长、茎长、根系活力及抗氧化酶活性的影响存在差异,但并未表现出明显的规律,MPs 对上海青产生的影响会随着植物的自身调节作用减弱,植物通过MDA、SOD、POD 等指标的相互调节作用下应对MPs 胁迫,MPs 在根系的附着影响对土壤中水分和营养的吸收,进一步影响植物的生长。
3)15 d 时微塑料种类与上海青茎长、根系活力及MDA 含量之间存在显著相关性,PBAT-MPs对上海青影响稍大,30 d 时微塑料种类、粒径、添加量与土壤TN、TP、水稳性团聚体及上海青各生理指标间均无显著性相关,整体来看可生物降解微塑料PBAT 并未因其自身降解而对土壤、成熟农作物产生显著的不良效应,因此可以考虑使用可生物降解农膜代替传统的不可降解农膜,以减轻白色污染问题。
