抗生素抗性基因在土壤中积累、转移与消减的研究进展
2024-01-20高晓宇王磊
高晓宇,王磊
1. 同济大学环境科学与工程学院,上海 200092;2. 上海市污染控制与生态安全研究院,上海 200092
抗生素原本是环境中自然存在的微生物用以杀死或抑制其他微生物生长的物质(Davies et al.,2010),后被广泛用于医疗、禽畜养殖业、农渔业等,预防及治疗人类、动物的微生物感染(Rayner et al.,2005;Cho et al.,2012;Hvistendahl,2012)。抗生素的过度使用导致ARGs 丰度增加及新型耐药菌出现。携带各种ARGs 多重耐药细菌可能导致一部分被感染的病人因无抗生素可用而死亡(Matthiessen et al.,2016)。由于抗生素的广泛使用及ARGs 的水平转移特性导致各种环境介质中的ARGs 种类及丰度激增(Martínez,2008)。尽管有不少学者认为耐药基因通过环境耐药菌向致病菌水平转移的概率较小,但是不能排除这种“低概率、高影响的一次性事件”的风险(王娜等,2021)。
土壤是细菌生活的重要场所,土壤细菌的丰富度要远远高于水体、大气等生态系统。土壤尤其是农业土壤也是接受禽畜粪便,回用污水污泥的主要场所(Chee-Sanford et al.,2009;Chen et al.,2014;2018;冀秀玲等,2011)。同时土壤也是人类赖以生存的基础,土壤-植物-动物-人类系统使土壤中的耐药微生物感染人类成为了可能,威胁人类及动物的健康和生命(Zhang et al.,2019a;Zhu et al.,2019)。土壤接收来源于外界的耐药基因及其在土壤中的继续传播成为形成耐药威胁的两个重要方面/环节。因此阐明ARGs(iARGs/eARGs)在土壤的定殖、转移和降解规律对于评估外界输入对土壤环境造成的耐药威胁风险有重要的意义。关于土壤ARGs的来源,积累及生态风险已有较多总结,但缺乏关于ARGs 在土壤中的转移及消减研究的总结。本文汇总了目前关于土壤ARGs 的富集、转移与消减等相关研究情况,并提出后续研究需要关注的重点方向及亟待解决的问题,以期给后续的研究工作带来一些思考。
1 ARGs 在土壤中的积累
ARGs 是微生物对抗抗生素的重要手段,土壤微生物中也存在丰富的内在抗性来对抗环境中的不良条件。但近年来的调查发现,土壤ARGs 的丰度因抗生素滥用而逐渐提高(Zhu et al.,2013;Zhang et al.,2015),引起了人们的广泛关注。
1.1 土壤中ARGs 的积累现状
四环素类、多重耐药性类、β-内酰胺类、氨基糖苷类、磺胺类、氯霉素类、万古霉素类、大环内酯类-林可酰胺类-链阳性菌B 类(MLSB 类)ARGs在土壤中均有检出,其中四环素类、磺胺类、多重耐药类、氨基糖苷类是检出率最高的几类ARGs(Wang et al.,2014;Xie et al.,2016;Han et al.,2022)。土壤中ARGs 的富集倍数可以达到几十甚至几万倍。例如,朱永官教授团队利用高通量qPCR检测了北京、浙江和福建3 个大型商业养猪场附近土壤的ARGs,发现土壤样品中有63 种ARGs 的丰度显著高于对照土壤,最高达21 600 倍(Zhu et al.,2013)。另一项其团队的调查表明在经再生水灌溉的公园土壤中检测出147 种ARGs,与对照土壤相比,再生水灌溉的土壤ARGs 的丰度富集了99—8 655 倍不等,其中多重耐药类ARGsqacEdeltal-02富集了800 倍(Wang et al.,2014)。
ARGs 污染的热区与人类利用抗生素密切相关。施用禽畜粪便及有机肥的农业土壤ARGs 的相对丰度达到9.94×10+2gene copies/16S rRNA gene copies,但不同土壤ARGs 丰度的变动较大,在6.68×10-8—9.94×102gene copies/16S rRNA gene copies 之间变动(表1)。一项针对中国农业土壤磺胺类药物和四环素类药物ARGs 丰度的调查发现,东北农业土壤是ARGs 的热区,这可能是因为东北地区长期的污水灌溉引起的(Zhou et al.,2017)。在长三角地区开展的一份土壤ARGs 丰度调查显示ARGs 主要存在于农业和经济最具活力的地区:太湖和上海市的农业土壤(Sun et al.,2020)。Zheng et al.(2022)利用机器学习绘制了全球土壤ARGs丰度分布图,发现全球土壤微生物耐药性热点区域主要位于美国东部、欧洲西部、南亚和东亚等人口密集、农牧业发达的地区。因此,需要加强经济及农业发达地区抗生素使用规范,加大抗生素危害及科学使用的宣传。
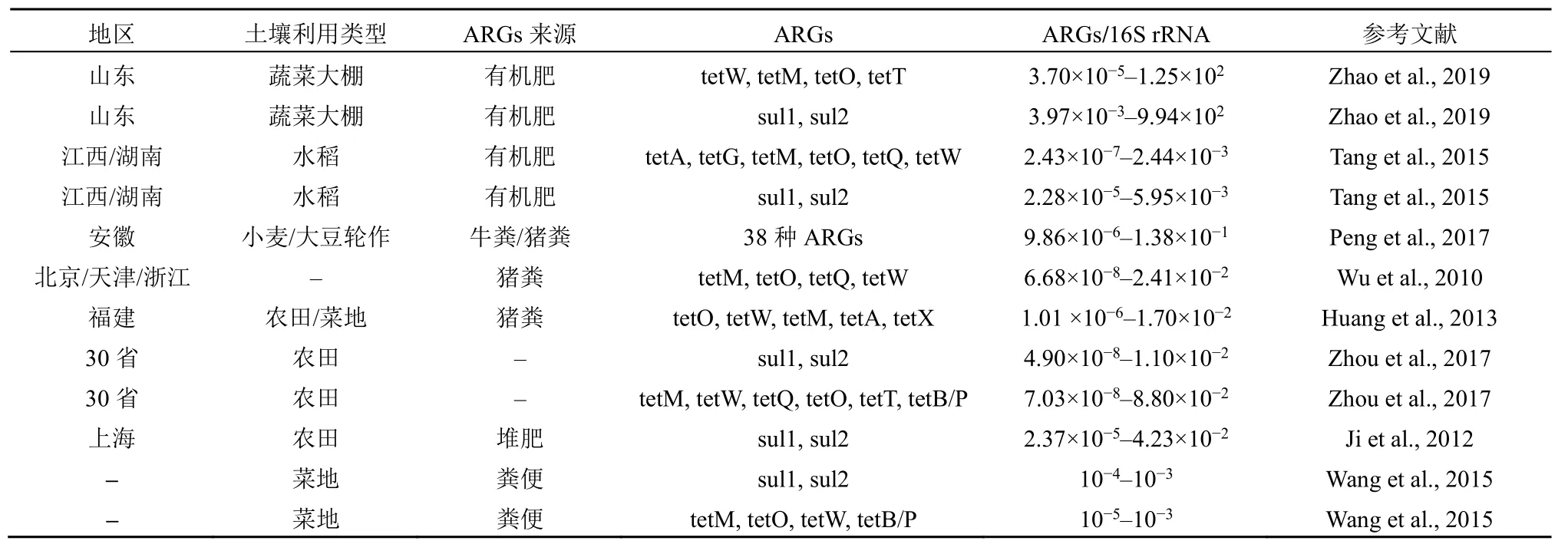
表1 中国不同地区粪肥施用土壤中ARGs 的丰度Table 1 Abundance of some selected ARGs in manure application soils from different regions of China
1.2 土壤中ARGs 的主要来源
土壤中的ARGs 除土壤微生物的内在抗性之外,主要来源于粪肥施用及污水灌溉等。粪肥及污水中原本存在ARGs 被带入土壤后,可能在土壤中继续存活或通过ARGs 的水平转移到土壤细菌(Heuer et al.,2011;Xie et al.,2016)。粪肥及污水中的抗生素或重金属可能导致土壤微生物产生更多的ARGs(Li et al.,2017)。另外,粪肥的施用可刺激土壤ARB 大量繁殖,导致土壤ARGs 丰度提高(Han et al.,2018)。长期施肥与污水灌溉使土壤积累大量的抗生素及ARGs(Tang et al.,2015;Pan et al.,2018)。为控制多粘菌素抗性基因mcr-1的传播,中国在2016 年正式停止在动物饲料中添加多粘菌素作为生长促进剂。在多粘菌素禁用3 年后,一项全国范围内养猪场和土壤中多粘菌素ARGs 的丰度变化的调查发现,养猪场及土壤中的mcr-1丰度均显著下降(Shen et al.,2020)。因此,需要加强对粪肥及污水处理工作,从源头上控制ARGs 的输入。2019 年7 月中国农村农业部发布公告,自2020 年起,停止将抗生素作为促生长类物质添加在饲料中。
2 ARGs 在土壤中的转移及影响因素
由外界进入土壤中的ARGs 在土壤中的积累及转移引起了众多学者的担忧。在评估ARGs 的生态风险时,其进入土壤后的传播扩散能力备受关注。因为iARGs 和eARGs 赋存形态的差异(Zhang et al.,2013;Mao et al.,2014),其在环境中的传播方式也截然不同,本文总结了不同赋存形态ARGs 在土壤中的扩散机制,如图1 所示。针对研究中出现的差异,应考虑不同形态,不同类型的ARGs 在土壤中的转移特征及不同土壤性质对ARGs 的影响,以明确其在土壤中对细菌耐药性传播带来的风险及为寻找正确的处置方式提供依据。
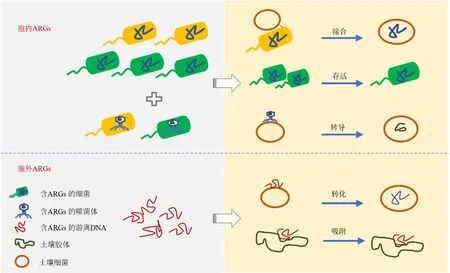
图1 ARGs 在土壤中的转移模式图Figure 1 Transfer pattern of ARGs in the soil
2.1 ARB 在土壤中的定殖与ARGs 的转移
iARGs 可以通过接合转移和转导的方式在细菌间进行水平转移。其中,接合转移被认为是ARGs借助可移动元件进行水平转移的主要方式。可移动元件包括转座子、整合子、质粒等。目前对质粒介导的ARGs 在土壤中的转移的研究最为深入。Fan et al.(2019)利用荧光蛋白标记的含有RP4 质粒的恶臭假单胞菌KT2442,发现在长达75 d 的土壤培养试验后,获得了至少15 个菌门的接合子,其中变形菌门占绝对优势,达85%以上,其它的优势菌门有拟杆菌、厚壁菌和放线菌。一项针对外源细菌在土壤细菌悬浮液中的接合转移试验也证明主要的接合子是变形菌且转移率可达到1 次/104土壤细菌(Musovic et al.,2010)。通过粪便引入耐药菌后,土壤通过接合转移获得的新耐药菌数量在施用粪便4 d 内达到最大数量,说明接合转移在耐药菌进入土壤后很快即可发生(Macedo et al.,2022)。携带ARGs的抗性菌进入土壤后可能由于不能适应土壤环境而死亡,但由其携带ARGs 可能会迅速通过接合转移进入土壤土著细菌,并在土壤环境中持续存在(Udikovic-Kolic et al.,2014)。更深入的研究发现,土壤细菌特别是变形杆菌可能从外源大肠杆菌中捕获RP4 质粒并将其转移到植物内生菌中(Xu et al.,2021)。以上的研究结果表明,ARGs 可以通过接合转移在土壤中传播并有可能转移到植物体内。
携带ARGs 的宿主进入土壤后的定殖能力限制了ARGs 在土壤中的持久性及传播能力。不同种类ARGs 进入土壤后的传播能力与其宿主的关系密切。例如,环境样本中sul1丰度要高于sul2(He et al.,2014;Su et al.,2017),可能是因为sul1通常与整合子有关,具有更广的宿主范围(Skold,2000)。另外,ARB 与土壤微生物的相互作用也影响着ARGs 在土壤中的命运。土壤中变形杆菌和放线菌是ARGs 的主要潜在宿主(Yang et al.,2019;Guo et al.,2020;Qian et al.,2020;Li et al.,2022)。细菌群落结构塑造了土壤抗性组(Forsberg et al.,2014)。研究表明土壤ARGs 丰度与微生物多样性呈负相关关系,可能是因为更高的微生物多样性抵抗了外源抗性组对土壤微生物的冲击(Chen et al.,2018;Li et al.,2020;Chen et al.,2022)。
噬菌体介导的转导作用可以将宿主细菌内的任何DNA 片段转移到另一个细菌。环境病毒组数据表明各生态系统噬菌体中均含有大量的ARGs(Calero-Caceres et al.,2019)。噬菌体介导的ARGs转导也在多种细菌中被发现,包括化脓性链球菌、大肠杆菌和沙门氏菌属等(Hyder et al.,1978;Schmieger et al.,1999;Billard-Pomares et al.,2014)。越来越多的研究证实环境中含有ARGs 的噬菌体与人类活动密切相关,携带ARGs 的噬菌体多出现在受动物粪便和城市废水影响的地区(Ross et al.,2015;Sun et al.,2018;Calero-Caceres et al.,2019)。禽畜粪便的施用增加了土壤噬菌体中的ARGs 的丰度(胡雪莹等,2022)。噬菌体可能是土壤中另一个重要ARGs 储存库,了解噬菌体ARGs 的水平转移机制对于研究移动抗性组具有重要意义,有利于控制ARGs 的传播。研究表明从土壤中分离的噬菌体可以介导ARGs 的水平转移(Ross et al.,2015)。然而,由于土壤环境的复杂性和物种的多样性,目前对土壤中噬菌体介导的ARGs 水平转移的研究还处于起步阶段。
2.2 胞外游离ARGs 在土壤中的转移
细菌能将胞外DNA 吸收,并在体内重新发挥作用是ARGs 环境危害的原因之一(Johnston et al.,2014;Luby et al.,2016)。目前已发现约有87 种细菌可通过自然转化吸收胞外游离的DNA 并发生水平转移(De Vries,2004;Johnston et al.,2014;Liu et al.,2017)。另外,已知12 种最优先抗生素耐药病原体中的11 种(世界卫生组织于2017 年确定)可以通过自然转化获得胞外游离ARGs(Lerminiaux et al.,2019)。研究者们在不同的生境环境中均检测到丰度不等的胞外游离ARGs(Dong et al.,2019;Hao et al.,2019;Yuan et al.,2019a)。游离ARGs的浓度甚至会在经污水处理工艺后提高,尤其在消毒之后(Yuan et al.,2019b;Yuan et al.,2022)。土壤拥有世界上最丰富的微生物多样性,另外由于土壤的特殊性质,土壤中的各种颗粒及胶体可以吸附游离的DNA 使其免于DNA 酶的降解,从而得以在土壤中存留较长的时间,使游离DNA 有更大的机会被细菌吸收(Khanna et al.,1992;Lee et al.,1999)。
自然转化在环境中抗生素耐药性的传播中起到重要的作用(Martínez,2008;Zhang et al.,2018a)。Li et al.(2020)利用单细胞拉曼光谱,结合重水逆向标记技术,跟踪胞外ARGs 从土壤到临床病原菌转化过程,发现土壤携带ARGs 的游离质粒的可转化性如下:氨苄青霉素>头孢拉定和环丙沙星>美罗培南和万古霉素。总结已有的研究发现,土壤中游离ARGs 的转化频率约为10-6—10-3(转化子/受体细菌)(Zarei-Baygi et al.,2021)。由于检测方法的限制,自然转化在实验室中并不经常被检测到,但在自然条件下,自然转化可能更为常见(Arnold et al.,2022)。因此,游离ARGs 在土壤中的转化对ARGs 的抗生素耐药性传播的贡献需要更多关注。
2.3 影响ARGs 在土壤中转移的因素
ARGs 在土壤中的传播受到多种因素的影响。ARGs 进入土壤的过程中往往伴随着高浓度的抗生素残留。抗生素的选择压力是ARGs 传播的主要因素。除此之外,影响ARGs 在土壤中传播的因素可以分为两个方面,如图2 所示。一是土壤类型、土壤质地及理化性质(pH、含水率等);二是环境污染物(重金属、农药残留等)。

图2 ARGs 在土壤中转移的影响因素Figure 2 Factors relevant to the transfer of exogenous ARGs in soil
不同类型土壤在施入有机肥后,其ARGs 丰度的变化有所差异。Zhang et al.(2018b)的研究发现污泥堆肥引入了大量的ARGs 到土壤中,经过172 d 的污泥堆肥处理,黄土中的总ARGs 丰度增加,但红土和黑土中的总ARGs 丰度降低至控制水平。亦有研究发现对不同土壤质地农田施用猪粪和污泥后tetO,tetW及sul1的丰度变化的研究发现,壤土中3 种ARGs 的丰度均有增加,沙壤土却无明显变化(Munir et al.,2011)。土壤理化性质对ARGs传播的影响体现在土壤微生物群落结构、对DNA的吸附特性等方面(Saeki et al.,2010;Manzoni et al.,2012)。Liu et al.(2023)通过宏基因组分析pH塑造了土壤多重耐药抗性组。针对华南地区水稻土ARGs 的研究发现,其丰度与土壤pH 显著相关,这可能是由于pH 影响了微生物群落结构(Xiao et al.,2016)。土壤含水率是影响ARGs 在土壤中传播的另一因素。例如,Kittredge et al.(2020)的研究表明土壤含水率在10%时,转化效率最高,并随着土壤含水率的上升而下降。胞外DNA 的降解速率与土壤含水率成正比(Sirois et al.,2009)。根据在滴灌农业土壤的研究发现,土壤含水率更高的滴灌点的土壤比距离50 cm 的采样点处的ARGs 的丰度更高,这可能是由于潮湿土壤中更高水平的微生物活性或水平基因转移(Negreanu et al.,2012)。尽管针对土壤特性对ARGs 传播的影响有较多研究,但是不同种类及赋存形态ARGs 与土壤之间的相互作用的复杂性导致目前很难理清土壤特性对ARGs 的影响,需要进一步的研究去揭示其中的机理。
重金属与ARGs 会产生共选择抗性(Davies et al.,2010)。研究发现,多种环境介质中ARGs 的丰度与重金属含量呈正相关关系(Ji et al.,2012;He et al.,2017)。例如,针对上海养猪场附近土壤ARGs、抗生素及重金属的量化分析发现sulA和sulIII与Cu、Zn 和Hg 的浓度密切相关(Ji et al.,2012)。通过量化分析长期施用猪粪的土壤重金属含量及ARGs 丰度发现,Cu、Zn 和Pb 的浓度与tetG,tetO,tetW,tetB(P),sul1,sul2,ermB和ermF的相对丰度呈显著正相关(Peng et al.,2017)。除重金属外,环境中其他的污染物,如杀菌剂、农药、纳米颗粒等都会对ARGs 在环境中的变化产生影响。因此,在ARGs 的环境风险评估中,要将其与其他污染物的复合作用考虑其中。
3 土壤ARGs 的消减特征及强化措施
3.1 消减特征
堆肥或污水施加到土壤中后,土壤中ARGs 通常会在一开始出现提高的现象,如果不继续施加堆肥或污水,土壤中ARGs 的丰度通常会逐渐下降,甚至在一段时间以后,回到原来的水平(Marti et al.,2014;Muurinen et al.,2017),这可能是由于土壤土著细菌的竞争,导致外源携带ARGs 细菌的死亡(Zhang et al.,2023)。然而,不同的ARGs 在土壤中的消减快慢可能有差异。比如Zhang et al.(2018b)的研究表明,在施入污泥后的6 个月时间内,tetX的丰度在22 d 时下降到施肥前的水平,ermF的丰度在172 d 后下降到施肥前的水平,然而tetG的丰度在土壤中的变化不大。Cheng et al.(2016)的研究也发现,tetG在农业环境中持久性较长。这可能是因为tetG在土壤中具有最多的潜在寄主细菌类群,寄主的高度多样性有助于tetG在土壤中的持久性(Zhang et al.,2018b)。不同种类ARGs 在土壤中的消减特征对于评估其生态风险至关重要,但目前相关研究还处于起步阶段,仍需进一步的研究。
禽畜粪便、污水等中的微生物在土壤中的适应性对其中的ARGs 进入土壤后的命运起到了重要的作用。研究表明,禽畜堆肥中的细菌进入土壤后是否能生存下来受到很多因素的影响,如微生物种类、温度等(Chee-Sanford et al.,2009)。粪便或堆肥中的细菌可能会被土著细菌取代并逐渐消失在土壤中(Riber et al.,2014)。部分细菌可以在土壤中存在几天到几个月,尤其是沙门氏菌及大肠杆菌等病原微生物(Scallan et al.,2015)。在土壤中长时间的存留可能导致其进入食物链而威胁人类健康。携带ARGs 的外源细菌尤其是能在土壤中长期存活的病原菌,不仅其自身会对人类健康造成危害,而且会增加耐药性向土壤中其他土著细菌传播的风险。
另外,土壤中的胞外ARGs 可以在土壤中留存几个月甚至一年以上(Blum et al.,1997;Hill et al.,1998),可能被土壤微生物吸收,使微生物获得新的抗性。因此,在外源细菌逐渐死亡及游离DNA 降解的这一段时间是外源ARGs 能否在土壤中定殖的重要时间节点,很有可能成为控制ARGs在土壤中传播的关键时间。图3 总结了ARGs 进入土壤后逐渐消减的情况,但携带ARGs 的宿主细菌进入土壤后的消减规律及游离ARGs 在土壤中的转化可能性的研究还处于起步阶段,仍需开展大量的研究。

图3 ARGs 进入土壤后的消减模式图Figure 3 Elimination pattern of exogenous ARGs into the soil
3.2 强化消减措施
抗生素的过度使用是ARGs 在环境中泛滥的主要原因,因此减少抗生素的使用也是减少环境耐药菌及耐药基因最重要的手段。全世界范围内针对控制抗生素的使用出台了很多措施以控制耐药性的传播及风险。近10 年,中国陆续出台了“减抗”,“禁抗”措施以减少并规范抗生素使用。此外,研究者们也测试了堆肥及污水处理过程中的各类技术对抗生素和ARGs 消减的影响,例如好氧高温堆肥,厌氧发酵,紫外线和氯消毒技术(Ma et al.,2011;Qian et al.,2016;Zhang et al.,2019b)。然而,目前的处理技术并不能完全去除堆肥,污水,污泥中的ARGs(Qian et al.,2018;Liu et al.,2019),甚至有可能增加某些ARGs 的丰度(Wu et al.,2018;Liu et al.,2019)。
此外,针对土壤环境,研究者们也做了许多研究。农艺措施可以改变土壤pH、结构、有机质及氮磷等元素含量,从而进一步改变土壤的微生物含量及种群结构,被认为可以改变土壤中的ARGs 丰度及种类(Han et al.,2022)。生物炭添加到土壤中后,会对微生物活动产生不同的效应(Ennis et al.,2012)。生物炭在不同的研究中对土壤中ARGs 的反馈也不相同。如在长期施肥的土壤上,竹子生物炭在添加60 d 后,土壤,生菜叶片及根系中的ARGs的丰度均有所下降(Duan et al.,2017)。而Chen et al.(2018)的研究却表明在种植植物的土壤上,生物炭的施入对土壤及青菜叶中ARGs 的丰度并无影响,但无植物生长的土壤ARGs 会降低。另外,有研究表明添加生物质炭30 d 后土壤中ARGs 显著降低,而60 d 后,添加生物质炭的土壤中ARGs 显著高于对照(Cui et al.,2018)。将堆肥粪便和由堆肥粪便产生的生物炭施用于土壤,与堆肥相比,生物炭的施用显著降低了土壤中ARGs 和MGEs 的丰度(Zhou et al.,2019)。生物炭在不同研究中产生的不同效果可能与不同的生物炭性质,ARGs 的赋存形态及其宿主等有关。但由于目前对ARGs 在土壤中的消减机制尚不明确,因此难以采取有效的强化措施。
另外,噬菌体疗法被认为是治疗抗生素抗性细菌的新方法(Kortright et al.,2019)。Sun et al.(2019)的研究发现生物炭与多价噬菌体联合能够阻控或消除抗生素抗性细菌和ARGs 的迁移,而且这种组合疗法适用于多种土壤系统而不受非生物因素的干扰。目前,针对土壤ARGs 消减措施的研究仍处于初步阶段,在接下来的研究中不仅要关注已有的污染处置方法对ARGs的处置效果,也要针对ARGs创新性的开发新的处理方法。
4 结语
外源污染物(抗生素、重金属、ARGs 等)的输入导致土壤尤其是农业土壤积累了大量的ARGs。部分ARGs 在土壤环境中继续传播扩散,增加了ARGs 的生态风险。目前针对不同种类及赋存形态ARGs 在土壤中的传播规律、生态风险及消减的强化措施的研究仍需进一步加强。因此,针对目前的研究现状,本文对土壤抗生素耐药性的研究提出以下建议:
1)结合高通量测序与微生物培养等技术,阐明不同种类ARGs 与宿主之间的联系。
2)重视土壤胞外游离ARGs 的环境风险。
3)阐明ARGs 在土壤环境中的转移、消减过程的机制尤其是土壤细菌与致病菌之间的ARGs 转移规律,并评估其风险等级。
4)通过科学的管理及农业措施减少ARGs 进入农业土壤并寻找强化ARGs 消减的新措施。
