LncRNA DSCAM-AS1调节miR-150-5p/BRAF轴对甲状腺癌细胞恶性生物学行为的影响
2024-01-20彭云温美玲吕云霞陈万志何春俞建平丁振罗
彭云 温美玲 吕云霞 陈万志 何春 俞建平 丁振罗
1赣州市人民医院甲状腺外科(江西赣州 341000);2南昌大学第二附属医院甲状腺外科(南昌 330000)
甲状腺癌(thyroid cancer,TC)是内分泌系统常见的恶性肿瘤,近年来其发病率和死亡率均呈上升趋势[1-2]。目前手术、放射性核素和内分泌治疗,虽然显著提高患者生存率,但仍有部分患者会复发并发生远处转移[3]。此外,TC 发生和发展的机制尚未完全阐明,因此,深入研究TC 发生发展的分子机制可能有助于发现潜在的治疗靶点,对改善患者生存具有重要意义。lncRNA 对多种癌症的生物学进程具有调控作用[4]。研究发现,DSCAM-AS1 在肝细胞癌[5]、子宫内膜癌[6]和骨肉瘤组织和细胞[7]中异常高表达,并能促进这些癌症的发生发展。经生物信息学分析显示,LncRNA DSCAM-AS1、BRAF 与miR-150-5p 存在靶向关系,miR-150-5p 在多数肿瘤中发挥抑癌基因作用。研究[8]显示,miR-150-5p 通过靶向调控EZH2 表达,抑制细胞增殖、迁移和侵袭,并诱导凋亡,减弱TC的进展。BRAF 参与TC 的发展,其基因突变与TC患者的甲状腺外浸润、淋巴结转移和TNM 分期、复发转移等密切相关[9]。推测LncRNA DSCAM-AS1可能通过调节miR-150-5p/BRAF 轴影响TC 的发生发展。因此,本研究在体内体外验证LncRNA DSCAM-AS1 对TC 发生发展的影响,以期为TC 的靶向治疗提供新的参考依据。
1 材料与方法
1.1 细胞来源 人正常甲状腺上皮细胞TEC 及人TC 细胞系SW579、TPC-1、BCPAP 购于美国ATCC。6 周龄SPF 级BALB/c 裸鼠购自河南省实验动物中心,许可证号:SCXK(豫)2022-0001,体质量15 ~ 20 g。
1.2 主要试剂与仪器 MTT 试剂盒购于江苏麦格公司;RNA 提取、反转录、EdU apollo 488 in vitro 试剂盒购于北京Solarbio;qRT-PCR 试剂盒购于江西艾博公司;双荧光素酶报告基因检测试剂盒(RG029S)上海碧云天生物技术有限公司;兔源一抗vimentin、E-cadherin、BRAF、Ki67、GAPDH 及HRP 标记的羊抗兔二抗购于美国Abcam 公司;多功能酶标仪(LD-96A)山东莱恩德智能科技有限公司;实时荧光定量PCR 仪(CFX96 Touch)上海艾研生物科技有限公司;光学显微镜(CX31)日本奥林巴斯公司。
1.3 实验方法
1.3.1 细胞转染及分组 将TEC、TPC-1、SW579、BCPAP 接种至DMEM 培养基进行传代培养,培养48 h 后,检测细胞DSCAM-AS1 表达水平。
取对数生长期的SW579 细胞,按照1.2 × 106个接种于6 孔板中,使用转染试剂盒进行转染,根据质粒将细胞分为si-NC 组、si-DSCAM-AS1 组、si-DSCAM-AS1+NC inhibitor 组、si-DSCAM-AS1+miR-150-5p inhibitor 组、miR-NC 组、miR-150-5p mimics组、miR-150-5p mimics+pcDNA 组、miR-150-5p mim⁃ics+BRAF 组,转染48 h 后检验转染效率并进行后续实验。
1.3.2 DSCAM⁃AS1 在SW579 细胞定位检测 使用细胞核/胞浆分离试剂盒分离细胞质与细胞核,收集大约5 × 106个SW579 细胞,500×g离心5 min,取细胞沉淀,加入预冷的PBS洗涤2次、离心弃上清、在细胞沉淀加入预冷的提取液,冰上静置30 min、1 200 ×g离心5 min,上清为胞浆组分、沉淀为细胞核组分。qRT-PCR 法检测DSCAM-AS1 表达。
1.3.3 FISH 与pull down 实验 SW579 细胞经组织固定液固定15 min、脱水后,加入10 μL 杂交缓冲液与1 μL 的Cy3 标记的DSCAM-AS1 荧光探针,46 ℃恒温箱,杂交1.5 h,DAPI 溶液复染细胞核15 min,PBS 清洗、晾干后,共聚焦显微镜下观察并拍照。
将生物素化的miR-150-5p-wt/mut探针与SW579细胞裂解物4 ℃下孵育过夜,以生物素标记的无意义RNA 序列作为阴性对照(NC),加入裂解液提取RNA,qRT-PCR 检测相对RNA 富集。
1.3.4 双荧光素酶活性检测 分别构建含有DSCAM-AS1 与BRAF 野生型(wt)、突变型(mut)表达载体,将突变位点克隆至PmirGLO 载体,将DSCAM-AS1-wt、DSCAM-AS1-mut、BRAF-wt、BRAFmut 分别与miR-NC、miR-150-5p mimics 共转染SW579 细胞48 h,荧光素酶报告分析系统检测相对荧光素酶活性。
1.3.5 DSCAM⁃AS1、miR⁃150⁃5p 表达检测 采用qRT-PCR 法检测DSCAM-AS1、miR-150-5p 表达水平,根据试剂盒说明书进行PCR 扩增,以GAPDH、U6 为内参,采用2-ΔΔCt方法计算DSCAM-AS1、miR-150-5p 相对表达。DSCAM-AS1 上游引物:5′-GT⁃GACAGCAAGACTCCCT-3′和下游引物5′-GATCC⁃GTCGTCCATCTGT-3′;miR-150-5p上游引物5′-ACT⁃GTCTCCCAACCCTTGTA-3′和下游引物5′-GTG⁃CAGGGTCCGAGGT-3′;GAPDH上游引物5′-GGAGC⁃GAGATCCCTCCAAAAT-3′和下游引物5′-GGCTGTTGTCATACTTCTCATGG-3′;U6上游引物5′-CTCGCTTCGGCAGCACA-3′和下游引物5′-AACGCTTCACGAATTTGCGT-3′。
1.3.6 细胞增殖检测 各组转染后的SW579 细胞接种于96 孔板中,每孔加入100 μL 的EdU 溶液,孵育2 h,PBS 洗涤,经固定通透后,加入100 μL的1×Apollo 染液反应,染色30 min,DAPI 复染细胞核,荧光显微镜下观察并拍照,计算Edu 阳性细胞率。
另取转染后的各组SW579 细胞按照800 ~1 000 个细胞接种于6 孔板中,连续培养14 d,固定后用0.5%结晶紫溶液染色观察集落形成数。
1.3.7 细胞迁移与侵袭实验 转染后的SW579 细胞生长至对数期时,使用涂有Matrigel 基质胶的Transwell 小室进行侵袭实验,迁移实验未涂有Matrigel 基质胶,各组细胞取200 μL(2 × 105)细胞悬液加入上室,下室加入600 μL 含10% FBS 的DMEM 培养基,培养24 h,固定染色,显微镜下随机选取5 个视野计算穿膜细胞数。
1.3.8 Western blot法BRAF、E⁃cadherin、vimentin蛋白检测 BRAF、E⁃cadherin、vimentin 及GAPDH一抗稀释液按照1∶1 500 稀释,HRP 标记的二抗按照1∶1 000 稀释,实验结束后,以GAPDH 为内参,采用Image J 软件分析各蛋白表达。
1.3.9 体内肿瘤形成实验 6 周龄BALB/c 裸鼠适应性饲养1 周后,随机分为si-DSCAM-AS1 组、si-NC 组,每组8 只,通过皮下注射200 μL(5 × 106)si-DSCAM-AS1 或si-NC 转染的SW579 细胞,每周测量移植瘤体积,28 d 后,处死小鼠分离肿瘤,测量肿瘤质量与体积,qRT-PCR 检测移植瘤组织中LncRNA DSCAM-AS1、miR-150-5p 表达,免疫组化法检测移植瘤组织BRAF、Ki-67 蛋白表达。
1.4 统计学方法 采用SPSS 25.0 软件对数据进行统计分析,计量资料以(±s)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK⁃q检验。P< 0.05表示差异有统计学意义。
2 结果
2.1 DSCAM⁃AS1 在细胞中的表达 与TEC 细胞比较,DSCAM-AS1 在SW579、TPC-1、BCPAP 表达水平显著升高(F= 123.50,P< 0.05),且DSCAM-AS1在SW579 细胞中表达水平最高,选择SW579 细胞进行后续实验,见图1。

图1 DSCAM-AS1 在细胞中的表达Fig.1 Expression of DSCAM-AS1 in cells
2.2 DSCAM⁃AS1靶向调控miR⁃150⁃5p表达 核/细胞质分离实验与FISH 实验表明,DSCAM-AS1主要分布在细胞质中(图2A、B)。经starBase 在线分析显示,DSCAM-AS1 与miR-150-5p 有结合位点(图2C),下拉实验证明,生物素标记的miR-150-5p-wt 比NC 及miR-150-5p-mut 探针捕获更多的DSCAM-AS1(图2D)。双荧光素酶实验显示,DSCAMAS-wt 与miR-150-5p mimics 共转染SW579 细胞后,与miR-NC 比较,相对荧光素酶活性显著降低(P<0.05)(图2E)。qRT-PCR 结果显示,在SW579 细胞中抑制DSCAM-AS1 表达可显著升高miR-150-5p 表达水平(F= 116.437,P< 0.05),而抑制miR-150-5p表达对DSCAM-AS1 表达无显著影响(P> 0.05)(图2F)。
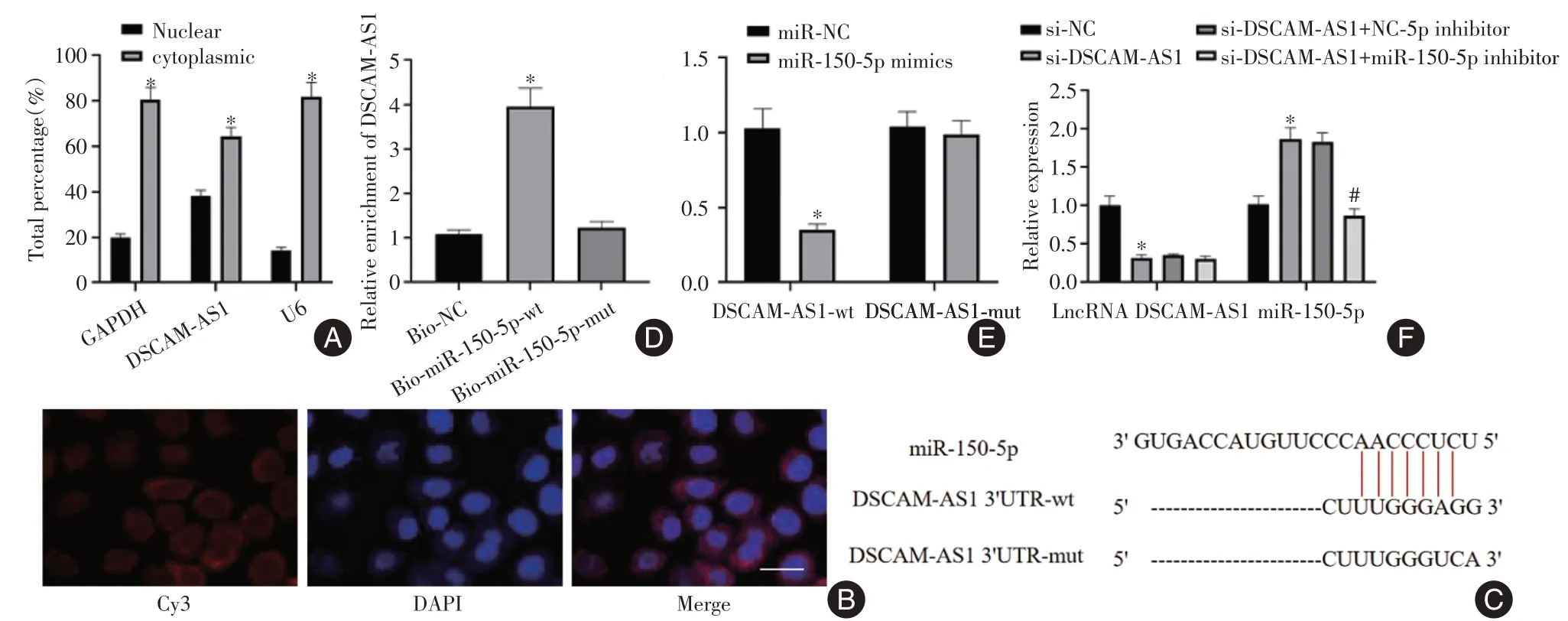
图2 DSCAM-AS1 靶向调控miR-150-5p 表达Fig.2 DSCAM-AS1 targeted regulation of miR-150-5p expression
2.3 DSCAM⁃AS1靶向调节miR⁃150⁃5p对SW579细胞恶性行为的影响 与si-NC组比较,si-DSCAMAS1 组SW579 细胞Edu 阳性率、集落形成数、迁移与侵袭细胞数及vimentin 蛋白表达水平显著降低,E-cadherin 蛋白表达水平显著升高,与si-DSCAMAS1+NC inhibitor 组比较,si-DSCAM-AS1+miR-150-5p inhibitor 组SW579 细胞Edu 阳性率、集落形成数、迁移与侵袭细胞数及vimentin 蛋白表达水平显著升高,E-cadherin 蛋白表达水平显著降低(F=171.543、39.669、59.968、41.767、169.227、158.783,P< 0.05)(图3)。
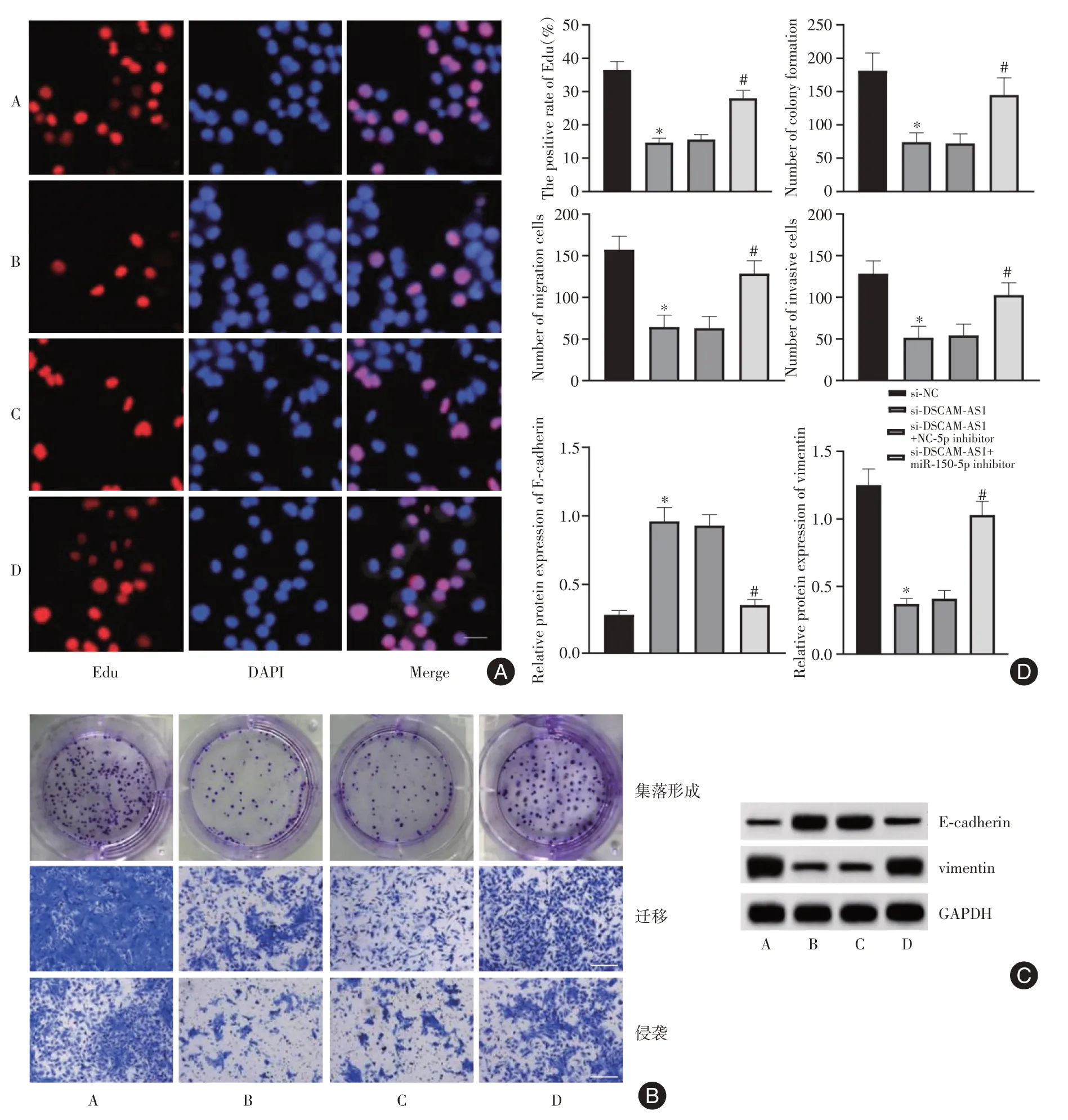
图3 DSCAM-AS1 靶向调节miR-150-5p 对SW579 细胞恶性行为的影响Fig.3 The effect of DSCAM-AS1 on the malignant behavior of SW579 cells by targeting miR-150-5p
2.4 miR⁃150⁃5p 与BRAF 靶向关系验证 经star⁃Base 在线分析显示,miR-150-5p 与BRAF 基因有靶向结合位点(图4A);下拉实验证明,miR-150-5p 与BRAF 结合(图4B);双荧光素酶实验结果显示,与BRAF-wt+miR-NC 共转染比较,BRAF-wt+miR-150-5p mimics 共转染SW579 细胞荧光素酶活性显著降低(P< 0.05)(图4C)。qRT-PCR 结果显示,在SW579细胞中过表达miR-150-5p可显著下调BRAF表达水平(t= 16.267,P< 0.05)(图4D、E)。
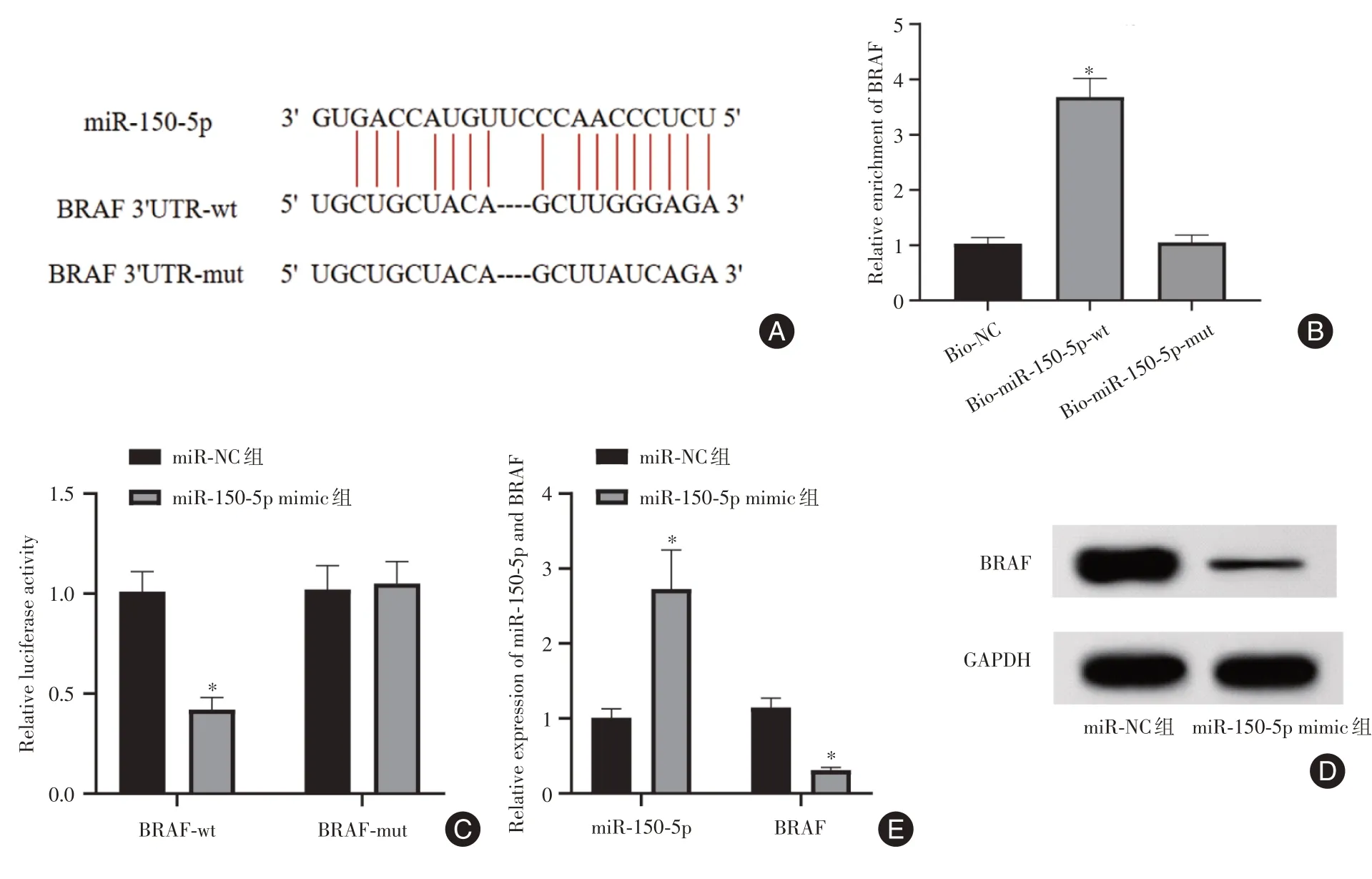
图4 miR-150-5p 与BRAF 靶向关系验证Fig.4 Verification of the targeting relationship between miR-150-5p and BRAF
2.5 miR-150-5p 靶向调节BRAF 对SW579 细胞恶性行为的影响 与miR-NC 组比较,miR-150-5p mimics 组SW579 细胞Edu 阳性率、集落形成数、迁移与侵袭细胞数及vimentin 表达水平显著降低,E-cadherin 表达水平显著升高,与miR-150-5p mim⁃ics+pcDNA 组比较,miR-150-5p mimics+BRAF 组SW579 细胞Edu 阳性率、集落形成数、迁移与侵袭细胞及vimentin表达水平数显著升高(P< 0.05),E-cadherin表达水平显著降低(F= 176.776、58.926、32.248、39.609、122.911、182.620,P< 0.05),见图5。
2.6 体内抑制LncRNA DSCAM⁃AS1 表达抑制TC 肿瘤生长 si-DSCAM-AS1 组小鼠移植瘤体积与重量显著低于si-NC 组(t= 12.912,P< 0.05);si-DSCAM-AS1 移植瘤中LncRNA DSCAM-AS1 表达水平显著降低,miR-150-5p 表达水平显著升高(t= 17.379、12.211,P< 0.05);si-DSCAM-AS1 组移植瘤中,BRAF、Ki-67 阳性率显著降低(t=14.933、20.252,P< 0.05),见图6。
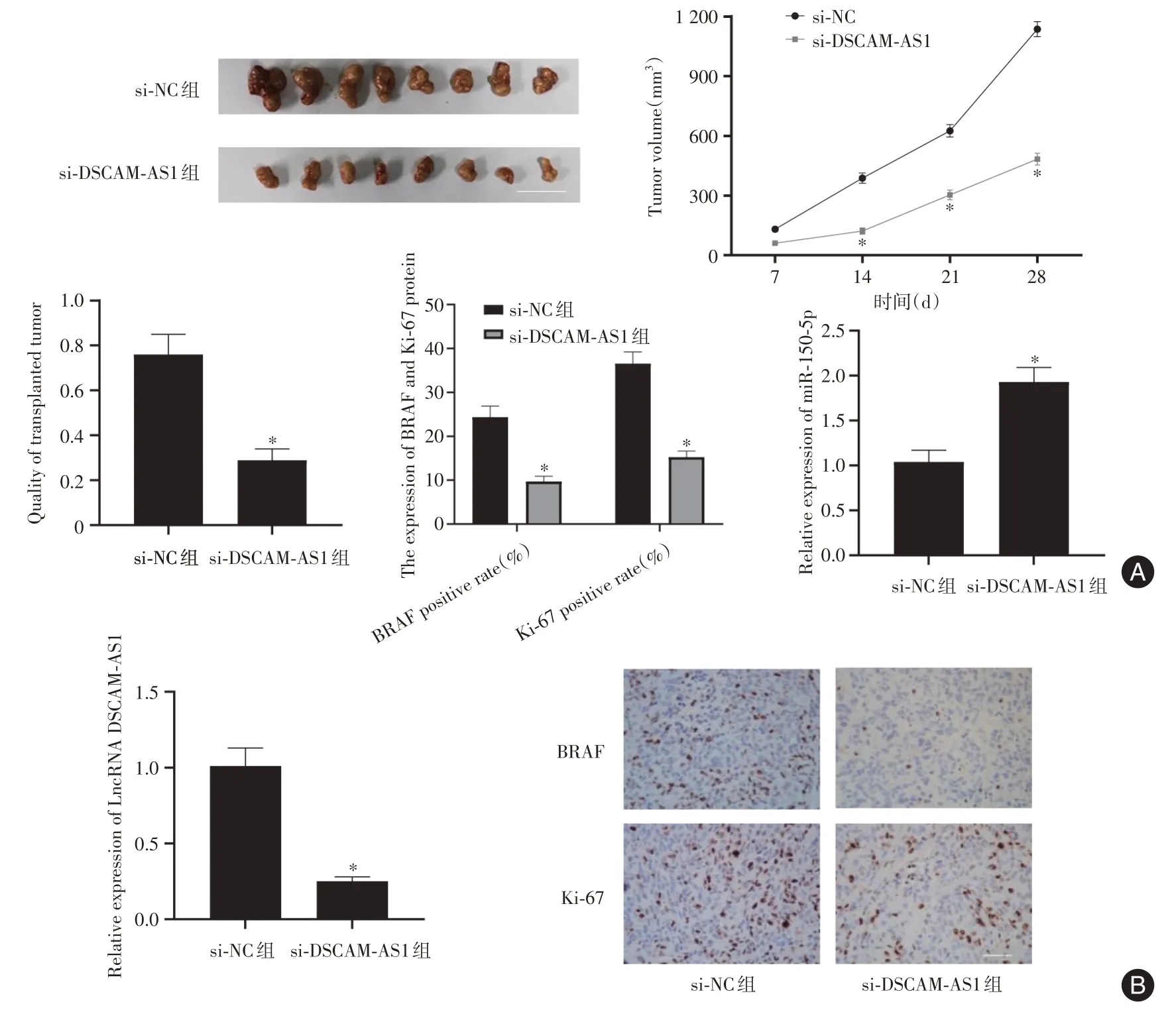
图6 LncRNA DSCAM-AS1 对裸鼠移植瘤生长的影响Fig.6 Effect of LncRNA DSCAM-AS1 on the growth of transplanted tumor in nude mice
3 讨论
TC 的发生机制复杂,涉及遗传、环境和表观遗传改变等因素[10]。尽管在检测和治疗技术方面取得了进步,但仍有部分TC 患者会出现肿瘤转移和复发,这凸显了开发更有效疗法的重要性[11]。
据多项报道[12-13]显示,LncRNAs 的异常表达可导致TC 的调节异常,与肿瘤的恶性进展有关,如LncRNA NORAD、LncRNA XIST 在TC 组织和细胞中异常高表达,通过调控miR-451、miR-34a/MET/PI3K/AKT调节TC细胞增殖和肿瘤生长。研究[5-7,14]发现,LncRNA DSCAM-AS1 在肝细胞癌、子宫内膜癌、骨肉瘤和结肠癌等多种肿瘤中发挥致癌功能,抑制LncRNA DSCAM-AS1 表达可显著抑制肿瘤细胞增殖、迁移与侵袭。本研究发现,LncRNA DSCAM-AS1 在TC 组织和SW579、TPC-1、BCPAP 细胞中高表达,抑制LncRNA DSCAM-AS1 表达可显著抑制TC 细胞增殖、迁移、侵袭及EMT,表明LncRNA DSCAM-AS1 在TC 中发挥癌基因的作用。
LncRNA 可作为竞争性内源RNA 或miRNA"海绵"来调节肿瘤中关键基因,从而发挥肿瘤抑制或肿瘤促进功能[15]。本研究显示,LncRNA DSCAMAS1 主要分布在细胞质中,表明LncRNA DSCAMAS1 在TC 细胞中发挥CeRNA 的作用。此外生物信息学分析、pull down 及双荧光素酶报告实验证实miR-150-5p 可与LncRNA DSCAM-AS1 靶向结合。miR-150-5p 被证明是一种肿瘤抑制因子,miR-150-5p 过表达抑制结直肠癌[16]、非小细胞肺癌[17]细胞的增殖、迁移、侵袭和肿瘤生长。在TC中,miR-150-5p 作为LncRNA-MIAT 的下游分子,发挥抑癌基因的作用[8]。本研究显示,过表达miR-150-5p 可抑制TC 细胞增殖、迁移、侵袭及EMT,LncRNA DSCAM-AS1 负向调控miR-150-5p 表达,促进TC 的恶性生物学行为。
miRNA 通过与靶mRNA 内的互补序列进行碱基配对,在基因表达的转录后调控中发挥作用[18]。本研究发现BRAF 是miR-150-5p 的靶点基因,miR-150-5p 可靶向调节BRAF 表达影响SW579 细胞的增殖、迁移及侵袭。BRAF 在包括TC 在内的多种肿瘤中发挥促癌作用,BRAF 是MAPK 信号通路的一部分,在BRAF 基因第15 中外显子的突变(BRAFV600),造成MAPK 通路持续活化,从而导致参与细胞增殖的基因转录,促进肿瘤发生、细胞增殖和转移[19-21]。BRAFV600E突变与TC 复发及相关死亡率显著相关,沉默BRAF 基因表达显著抑制体外和体内的癌细胞侵袭和肿瘤生长[22-23]。然而,BRAF 如何影响TC 进展的分子机制尚未完全阐明[24]。
本研究证实,miR-150-5p 与BRAF 存在靶向关系,且在SW579 细胞过表达miR-150-5p 可显著降低BRAF 表达水平,而过表达BRAF 可逆转过表达miR-150-5p 对SW579 细胞增殖、迁移、侵袭及EMT的抑制作用。体内实验结果表明,抑制LncRNA DSCAM-AS1 表达可显著抑制移植瘤生长及BRAF表达,促进miR-150-5p表达。LncRNA DSCAM-AS1/miR-150-5p/BRAF 轴可能成为治疗TC 的一种新的靶点。
综上所述,LncRNA DSCAM-AS1 在TC 细胞中上调表达,抑制LncRNA DSCAM-AS1 表达可通过调节miR-150-5p/BRAF 信号轴,抑制TC 恶性进展。
【Author contributions】PENG Yun performed the experiments and wrote the article.WEN Meiling,YU Jianping and DING Zhenluo per⁃formed the experiments.LV Yunxia and CHEN Wanzhi revised the article.HE Chun designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
