白细胞分化抗原74和 CXC 趋化因子配体9阳性巨噬细胞亚群在大鼠肝移植排斥反应中的作用
2024-01-20魏思东陈凯歌张继翔轩娟娟王耀权苗舜赵开心王维伟陈国勇
魏思东 陈凯歌 张继翔 轩娟娟 王耀权 苗舜 赵开心 王维伟 陈国勇
河南省人民医院,河南大学人民医院,郑州大学人民医院 (郑州 450003)
器官移植术后需长期使用抗排斥药物来防止排斥反应发生,如何降低和减少排斥反应是移植后患者长期生存的重要任务[1-2]。其关键在于肝移植排斥反应机制的深入研究,在排斥反应中单核细胞释放炎症因子,活化淋巴细胞分泌细胞因子导致肝损伤,但巨噬细胞具有广泛的异质性[3],每个细胞亚群的功能分类及作用尚不完全清楚。本研究通过建立大鼠肝移植排斥模型,首次发现移植肝巨噬细胞分为9 个功能亚群,白细胞分化抗原74(cluster of differentiation 74,CD74)阳性的巨噬细胞亚群和CXC 趋化因子配体9(C-X-C motif chemokine ligand 9,CXCL9)阳性的巨噬细胞亚群排斥反应中明显升高,提示巨噬细胞的抗原呈递亚群和趋化亚群是肝移植排斥反应防治的关键。
1 材料与方法
1.1 实验动物与分组处理 健康雄性Lewis 大鼠和棕色挪威(brown norway,BN)大鼠,来源于北京维通利华生物有限公司[SCXK(京)2016⁃0006],体质量260 ~ 300 g,处置符合郑州大学医学伦理学标准(伦理许可号:U2004124)。分组:免疫耐受组(B⁃B),将BN 大鼠供体的肝脏移植至BN 大鼠受体[4],供体6 只,受体6 只;免疫排斥组(L⁃B),将Lewis 大鼠供体的肝脏移植至BN 大鼠受体[5-6],供体6 只,受体6 只。
1.2 肝移植模型建立 采用单人裸眼操作的门脉优先二袖套法建立大鼠肝移植模型,供体肝脏采用0 ~ 4 ℃的冷生理盐水灌注后获取。受体肝脏先阻断并离断门静脉,受体门静脉和供体门静脉套管吻合,套管完成后阻断肝下下腔静脉和肝上下腔静脉,移除受体肝脏,吻合肝上下腔静脉后开放肝上下腔静脉和门静脉,肝下下腔静脉套管完成后开放,动脉不吻合,胆管采用支架管插入法吻合,见文献[7-8]。
1.3 标本获取 移植术后1 周获取肝脏及血液标本,血液标本进行肝功能检测,新鲜冷藏肝脏标本行单细胞测序和新鲜肝脏标本⁃80 ℃冷冻行高通量检测,部分标本于室温下使用4%多聚甲醛固定并嵌入石蜡,用于组织学及免疫组化检测。
1.4 高通量测序 新鲜肝脏组织获取后⁃80 ℃保存,高通量RNA 测序时统一处理为匀浆液后室温提取RNA 溶液,使用StringTie 将Mapping 到基因组上的序列进行组装,使用GffCompare 与已知基因模型进行比较,StringTie 与已知的基因模型评估基因的表达量,进行基因表达差异分析,由生工生物工程(上海)股份有限公司完成。
1.5 单细胞测序 新鲜肝脏组织进行单细胞RNA测序(Single⁃Cell RNA Sequencing)。于核酸保存液中低温运输,化学法分离得到单细胞悬液,分别使用Qubit2.0 Fluorometer 和qRT⁃PCR 对文库有效浓度进行定量。Illumina 测序,对单个细胞基因表达进行定量分析,首先使用官方提供初步分析软件进行基因表达定量和细胞数目鉴定分析,然后使用通元分析流程进行后续分析,由新格元(南京)生物科技有限公司完成。
1.6 组织病理学生化检测和免疫组化 标本固定后封蜡,切5 μm 厚蜡片,HE 染色分析病理改变,排斥反应采用banff 分级法统计分析[9]。采用雷杜/长春汇力试剂盒全自动分析检测谷丙转氨酶和谷草转氨酶。切片进行水合和抗原提取后,使用脱脂奶粉阻断非特异抗原,分别加一抗:抗CD68(K200071M;1∶500;北京莱宝生物)、抗CD⁃74(K004121P;1∶200;北京莱宝生物)、抗CXCL9(bs⁃2551R;1∶200;北京博奥森生物)和抗CD14(bs⁃1192R;1∶500;北京博奥森生物),在4 ℃下孵育过夜,加二抗山羊抗兔 IgG⁃HRP 抗体(ab6721;abcam)显色。图像采用数字切片扫描仪(宁波江丰KFPBL12000107009)采集,每高倍视野阳性细胞进行统计学分析。
1.7 统计学方法 单细胞测序和高通量测序采用DESeq2进行基因表达差异分析,版本号:1.22.1,余下所有统计采用使用SPSS 22.0 进行分析,计量结果均数±标准差表示,组间差异分析采用独立样本t检验,双边检验,以P< 0.05 为差异有统计学意义。
2 结果
2.1 巨噬细胞在大鼠肝移植排斥反应中增加 大鼠肝移植术后1 周,发现免疫耐受组仅汇管区有少量的炎性细胞浸润,肝细胞无形态学改变;而排斥组汇管区有大量炎性细胞浸润、胆管损伤和内皮炎性改变,肝细胞有不同程度的水肿及坏死(图1A)。进行排斥反应分级对比分析显示,排斥组的Banff 分级明显升高(图1B)(P< 0.05)。同时肝功能检测发现,排斥组的谷丙转氨酶和谷草转氨酶明显高于耐受组(图1C)(P< 0.05)。以上结果说明模型建立符合排斥反应研究的需要。通过CD68 阳性来鉴定巨噬细胞,发现耐受组中仅有少量巨噬细胞存在,排斥组则有大量的巨噬细胞浸润,汇管区更为显著(图1D);进行巨噬细胞统计分析发现,排斥组阳性细胞数明显多于耐受组(图1E)(P< 0.05)。
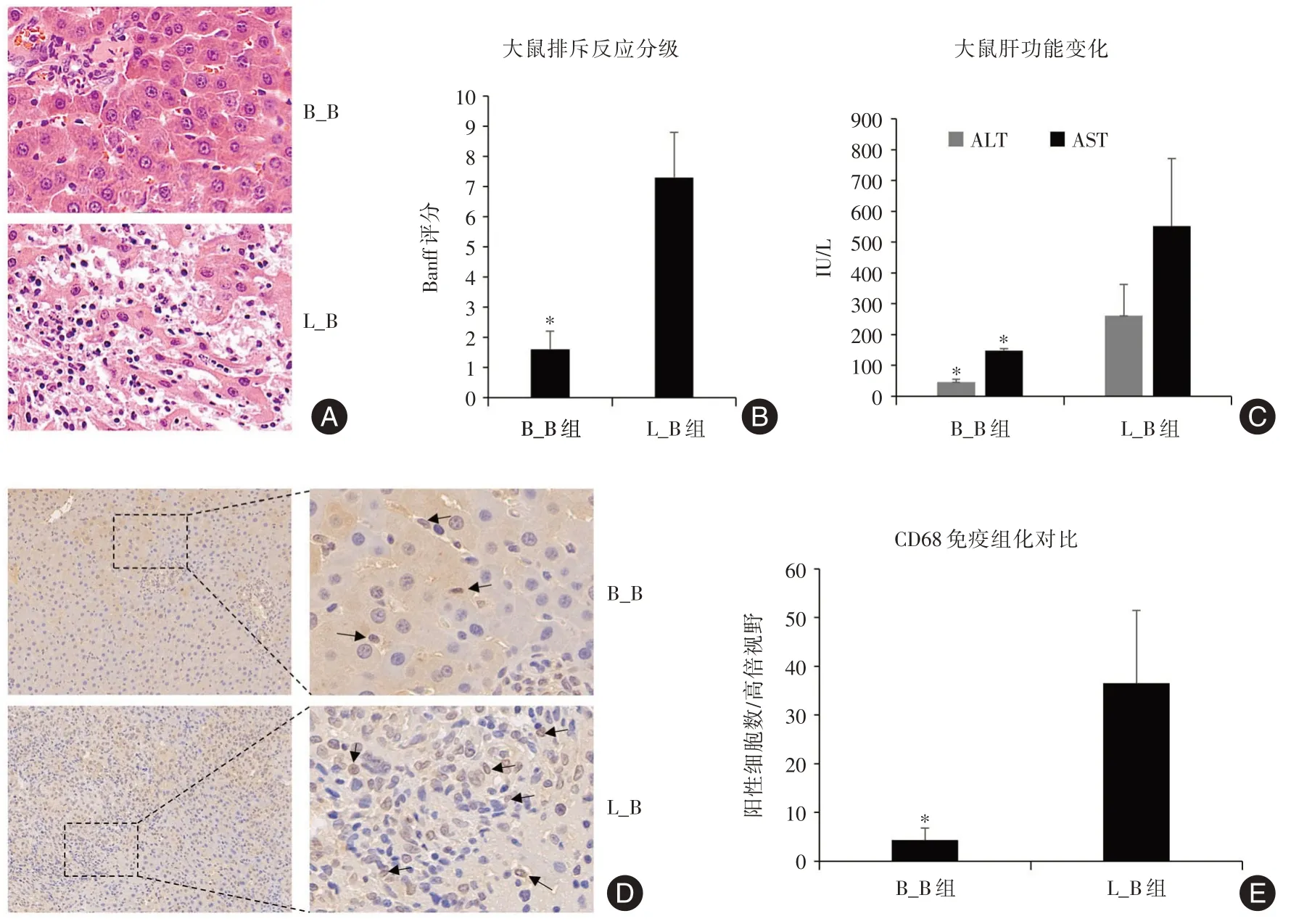
图1 CD68 阳性巨噬细胞在肝移植排斥反应中浸润增加Fig.1 Increased infiltration of CD68 positive macrophages in rejection of liver transplantation
2.2 巨噬细胞在大鼠移植肝内的功能异质性 单细胞测序对大鼠移植肝非实质细胞进行分类,发现单核巨噬细胞(Mononuclear phagocyte system,MPs)为最大的群体(图2A),通过CD68 基因标记巨噬细胞(图2B),根据功能差异UMAP 做图,发现巨噬细胞分为9 群(图2C),根据基因表达量、特异性及文献报道命名,分别为第1 群(Clec4f)、第2 群(Fggy)、第3群(G0s2)、第4群(Fcnb)、第5群(Cst3,Cd74)、第6 群(Trem2)、第7 群(Hspb1)、第8 群(Cxcl9,Cd14)及第9 群(Cxcl3)(图2D)。CD163 为肝脏耐受性巨噬细胞,第1 群和第7 群主要为CD163 阳性巨噬细胞,其余为非CD163 阳性细胞(图2E)。
2.3 CD74 和CXCL9 基因标记的巨噬细胞亚群在大鼠肝移植排斥反应中升高 为了发现肝移植排斥反应中升高的巨噬细胞亚群,将每个亚群中表达量前十的基因共90 个与移植肝高通量分析差异基因进行对比,发现这90 个基因中在排斥反应中有64 个基因存在差异,与耐受组比较,排斥组中表达量升高的基因有53 个,表达量前十的基因分别为Acod1、Ccl7、Clec10a、Ms4a7、Cxcl9、Cxcl10、Cd74、Slpi、Cst7和Mmp9,归属亚群为:第8群Acod1、Cxcl9、Cxcl10 和Cst7 共4 个,第5 群Clec10a、Ms4a7和Cd74 共3 个,第7 群Ccl7,第9 群Slpi 和Mmp9。从基因表达量(图2D)、差异倍数和统计学意义(图3A)上综合分析,排斥反应中巨噬细胞差异基因排名第1 位是第5 群的CD74,第2 位是第8 群的CXCL9,说明CD74 和CXCL9 基因功能及其所属的亚群可能在肝移植排斥反应中发挥关键作用。CD14 是炎症反应巨噬细胞的经典亚群,将CD14和CD74、CXCL9 基因综合分析发现,这3 个基因在MPs 中的表达明显高于其他细胞类型(P< 0.05),进一步分析显示CD74 在巨噬细胞第5 群以及CXCL9 和CD14 在巨噬细胞第8 群的表达明显高于其他巨噬细胞亚群(P< 0.05)(图3B),初步说明在移植肝内CD74 可以标记第5 群,暂定第5群巨噬细胞为CD74 巨噬细胞,CXCL9 可以标记第8 群巨噬细胞,暂定第8 群为CXCL9 巨噬细胞,因为CD14 的表达低于CXCL9,CD14 可以辅助性标记第8 群巨噬细胞。CD74、CXCL9 和CD14 基因表达量进行聚类分析发现,3 个基因在排斥反应中的表达量升高具有较好的聚类现象(图3C)。进一步分析CD74 和CXCL9 基因所属的巨噬细胞亚群中表达量前十的基因聚类情况,发现这些基因在肝移植排斥反应中表达量的升高情况能够按照两个亚群聚类(图3D)。
2.4 CD74 阳性和CXCL9 阳性的巨噬细胞在肝移植排斥反应中的升高 免疫组化验证CD74 阳性和CXCL9 阳性的巨噬细胞在肝内的变化,发现耐受组移植肝汇管区仅有少量CD74阳性巨噬细胞浸润,但在排斥组汇管区可见大量CD74 阳性巨噬细胞浸润,并且在肝血窦的CD74 阳性巨噬细胞浸润也明显增加(图4A、D)(P< 0.05)。在耐受组移植肝汇管区有少量CXCL9阳性巨噬细胞浸润,但在排斥组汇管区和肝血窦可见大量CXCL9 阳性巨噬细胞浸润,且以汇管区更为显著(图4B、D)(P< 0.05)。同时发现CD14 在耐受组偶有表达,在排斥组汇管区表达明显增加(图4C-D)(P< 0.05),但其数量明显低于CD74阳性或CXCL9阳性细胞数。
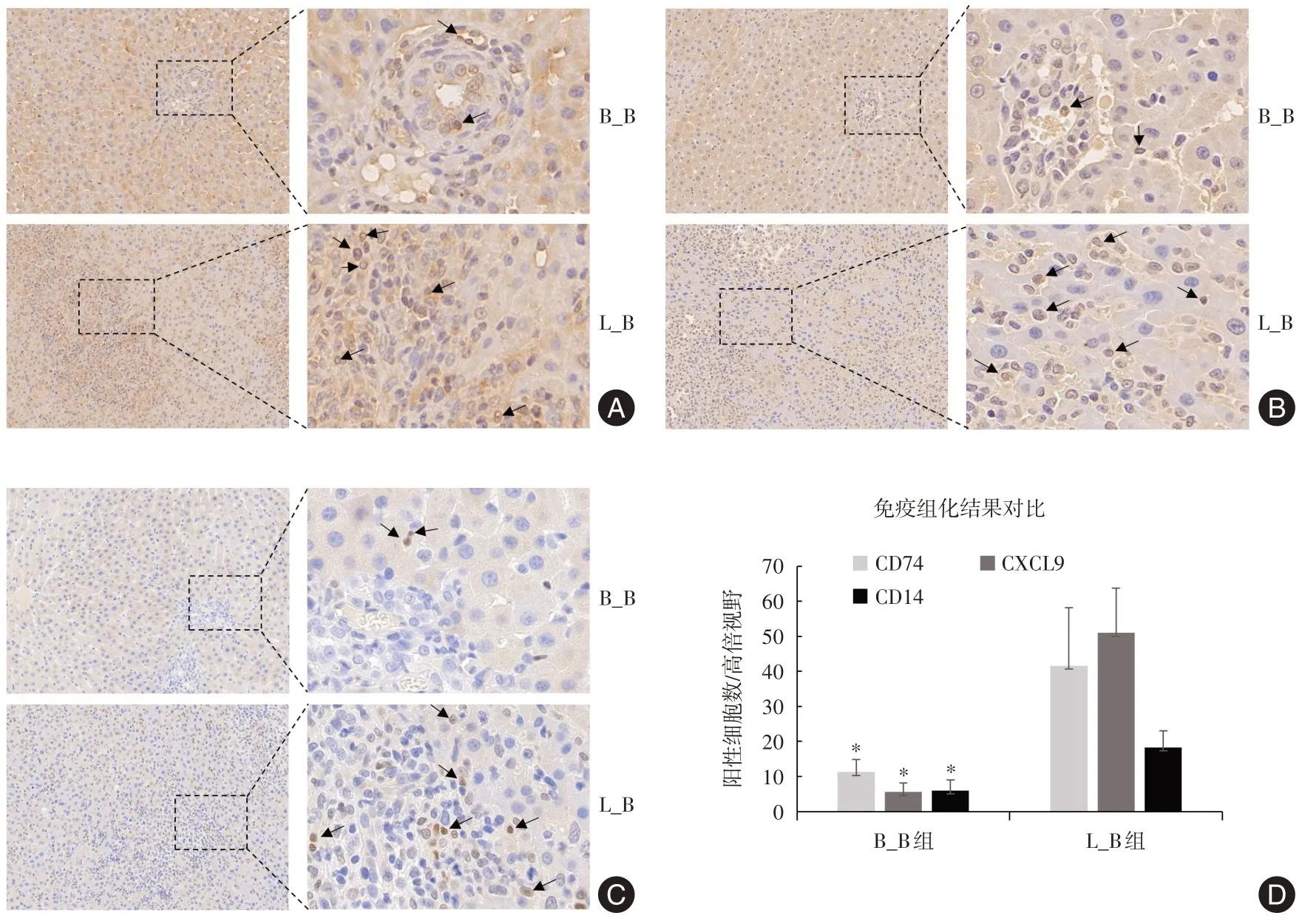
图4 CD74 阳性巨噬细胞和CXCL9 阳性巨噬细胞亚群在肝移植排斥反应中浸润增加Fig.4 Increased infiltration of macrophages CD74 positive and CXCL9 positive macrophage subsets in rejection of liver transplantation
3 讨论
巨噬细胞在肝脏损伤中发挥多种功能,包括细胞因子和趋化因子的分泌、白细胞粘附和吞噬作用等,巨噬细胞的抗原呈递和细胞因子释放能够抑制或者促进移植物的排斥反应[10]。本研究通过CD68 标记巨噬细胞发现发生排斥反应的肝脏汇管区及肝血窦中有大量巨噬细胞浸润。文献报道大鼠肝移植排斥反应中巨噬细胞浸润明显增加[11],临床肝移植排斥反应中,肝脏内门静脉系统及肝小叶中均存在CD68 巨噬细胞浸润,其浸润细胞的数量与排斥反应的严重程度相关[12],且浸润细胞的数量越多,排斥反应越严重[13],同时排斥反应中的CD68 巨噬细胞浸润程度超过单纯炎症引起的细胞浸润[14]。本研究结果和以往的文献报道的结果较为一致,说明本研究的方向具有科学性。巨噬细胞功能通常分为两类:具有促炎功能的经典1 型巨噬细胞(M1)和具有抗炎功能的替代性2型巨噬细胞(M2),M1 型巨噬细胞可产生促炎因子,M2 型巨噬细胞可产生抑炎因子[15],本研究用CD163 基因来鉴别M2 型巨噬细胞,发现CD163 表达的巨噬细胞功能并不完全一致。文献报道抑制M1 极化能够抑制排斥反应[16],过继移植M2 能够改善大鼠肝移植模型的急性排斥反应[17]。但另一项研究[18]显示表达CD163 的库普弗细胞浸润能抑制钠钾ATP 酶的活性而导致胆汁淤积,所以仅用M1 和M2 分型来分析巨噬细胞的功能尚不能满足临床需要。
本研究通过单细胞测序CD68 基因标记巨噬细胞,根据功能将其分为9个亚群,结合肝脏高通量检测的差异基因分析,发现肝移植排斥反应中巨噬细胞上调的基因前两位为CD74 和CXCL9,其所在的巨噬细胞亚群分别是CD74为第5群和CXCL9为第8 群,说明CD74 代表的第5 群和CXCL9 代表的第8 群在肝移植排斥反应中具有关键的作用。研究[19]表明在肝移植排斥反应中,FOLR3 巨噬细胞升高,而CD163巨噬细胞减少,LDLR表达的髓源性抑制细胞能够对抗排斥反应。本研究进一步细化了巨噬细胞亚群,首次发现CD74 巨噬细胞亚群和CXCL9 巨噬细胞亚群在肝移植排斥反应中升高。
本研究通过免疫组化分析验证了CD74 蛋白阳性的巨噬细胞在排斥反应中明显增加,同时发现CD74 阳性巨噬细胞主要分布于汇管区。CD74(Ⅱ类MHC 不变链,Ii)(MHC class Ⅱ invariant chain,Ii)是非多态性的Ⅱ型跨膜糖蛋白,CD74 参与其他非MHCⅡ类蛋白的运输,作为巨噬细胞迁移抑制因子(MIF)、D-多巴色素互变异构酶(D-DT/MIF-2)和细菌蛋白的细胞膜高亲和力受体,能够调节T 细胞发育。CD74 激活后能够通过丝裂原活化蛋白中的激酶1 和2 途径和PI3K/Akt/SRC 信号转导级联导致细胞增殖和细胞迁移,促进炎细胞因子的分泌[20-21]。研究[22]表明CD74 是非酒精性脂肪肝的关键基因,但在肝移植中的表达并不清楚,发现CD74 阳性巨噬细胞在肝移植排斥反应中的增加,提示CD74 阳性巨噬细胞亚群是抗原呈递的主要巨噬细胞亚群,是阻断排斥反应启动的主要细胞亚群,为抗原呈递的预防和治疗提供了理论依据。同时通过免疫组化发现CXCL9 阳性的巨噬细胞在肝移植排斥反应的汇管区明显增加,CXCL9 是趋化因子配体,可以通过CXCR9 招募CD8+T 细胞,同时能够促进CD8+T 细胞的功能[23],文献报道表明,在肝癌中血清CXCL9 能够作为新的标记物[24],在肝移植排斥反应中肝内CXCL9 mRNA 的表达升高[25]。说明CXCL9 阳性巨噬细胞亚群的招募和促炎作用可能是肝移植排斥反应中的重要机制,这一结果为肝移植排斥反应中细胞招募的防治提供了理论依据。CD14 巨噬细胞表达TLR-4 和TLR-2,在肝移植排斥反应中,肝移植受者循环单核细胞的TLR-2 和TLR-4 表达显著升高[26]。据此分析了CD14 基因在肝移植排斥反应和巨噬细胞亚群中的表达,发现CD14 基因主要表达在CXCL9 巨噬细胞上,通过基因表达分析和免疫组化发现,CD14 阳性的巨噬细胞在肝移植排斥反应中增加,但数量明显少于CXCL9 阳性巨噬细胞,说明CD14 阳性巨噬细胞的促炎作用在肝移植排斥反应中起到一定的作用。
但该研究仅分析了排斥反应中CD74 阳性和CXCL9 阳性的巨噬细胞亚群的基因及蛋白的表达,并没有进行多蛋白定位的免疫荧光分析和基因干扰,同时该研究为初步研究,标本数量仅达到统计学差异,需进一步扩大样本例数探索其科学价值的重要性,深入的研究将为该理论的完善和发展提供更充分的科学证据。
综上,本研究首次发现肝脏内巨噬细胞为9 个亚群,确定了在肝移植排斥反应中,CD74 阳性巨噬细胞亚群和CXCL9 巨噬细胞亚群是促进肝移植排斥反应中的关键亚群,为肝移植排斥反应中巨噬细胞抗原呈递和细胞趋化方面的防治提供了坚实理论依据,为排斥反应中细胞的相互作用的进一步研究提供了细胞亚群及关键的基因线索。
【Author contributions】WEI Sidong and CHEN Kaige designed the project,established the rat model of liver transplantation,and wrote the manuscript.ZHANG Jixiang and XUAN Juanjuan established the rat model of liver transplantation and carried out ALT,AST,and pathological detection.WANG Yaoquan,MIAO Shun,and ZHAO Kai⁃xin carried out sample collection,single cell and high-throughput data statistical analysis.WANG Weiwei,CHEN Guoyong contributed to the work on designing the project,immunohistochemistry,and manuscript revision.
