基于离子交换色谱法同时测定果酒中8种有机酸
2024-01-19徐玲萍张芳芳罗振玲夏慧丽
徐玲萍,张芳芳,罗振玲,夏慧丽*
(台州市食品检验检测中心,浙江 台州 318000)
所谓“无酸不成酒”,酸具有呈味作用,适量的酸可使酒口感活泼、爽口、协调[1]。水果本身含有大量的有机酸,果酒在发酵过程中也会产生不同种类的酸[2-4]。这些酸的组成和含量有别于白酒、黄酒,使果酒具备其独特风味。酸含量过低,酒味寡淡、单调;酸含量过高,酒味粗涩、不协调。曾竟蓝等[5]介绍了常见果酒中主要有机酸的种类和含量,并综述了有机酸对果酒口感、风味、稳定性等方面的影响。刘淑珍等[6]研究发现,采用D314弱碱性树脂进行降酸处理猕猴桃酒能更好地保存猕猴桃的特征香气成分,感官品质更好。卫春会等[7]以山葡萄酒为研究对象,发现发酵过程中不同的有机酸呈现出不同的变化规律,并阐明有机酸对山葡萄酒的色泽、口感、品质及生物稳定性方面的重要影响。因此,研究果酒中有机酸的组成和含量,用于解析果酒风味形成、控制果酒的品质具有重要意义。
目前,有机酸的检测方法主要有气相色谱(gas chromatography,GC)法[8]、气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)法[9]、高效液相色谱(high performance liquid chromatography,HPLC)法[10-13]、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[14]和离子色谱(ion chromatography,IC)法[15-16]。GC及GC-MS法主要用于测定易挥发的小分子有机酸,对于大分子有机酸需要衍生化处理,重现性差[17]。HPLC及LC-MS/MS法受到样品基质干扰,需要更为复杂的前处理过程,并且往往使用极性大的流动相,对色谱柱破坏性大[18]。离子色谱法因其灵敏度高、对物质有特异性选择、环境友好等优点,逐渐成为选择的重点[19]。离子色谱主要包括离子交换色谱、离子排斥色谱和离子对色谱三种,其中应用最广泛的是离子交换色谱。离子交换色谱是利用离子交换的原理对共存的多种阴离子或阳离子进行分离检测。近几年应用离子色谱法开展有机酸测定的研究越来越广泛[20-22],但相关研究很少涉及解决苹果酸和琥珀酸两个主要成分分离困难问题,也鲜有发现用离子色谱法同时测定果酒样品中有机酸组分的研究。
本研究以葡萄酒为基质,采用电导抑制器离子色谱法,考察样品前处理、色谱柱、梯度洗脱程序等多方面的影响因素,建立同时测定果酒中8种有机酸的离子交换色谱法,为研究果酒中有机酸的组成和变化规律提供有力的技术支撑。
1 材料与方法
1.1 材料与试剂
D-(-)-奎宁酸、乙酸、甲酸、乳酸、柠檬酸、DL-苹果酸、琥珀酸、DL-酒石酸标准品(纯度≥90%):上海安谱璀世标准技术服务公司;IC-Guard RP净化小柱(1 mL):上海安谱实验科技股份有限公司;杨梅酒、葡萄酒、桑葚酒、荔枝酒、蓝莓酒:市售。其他试剂均为国产分析纯。
1.2 仪器与设备
Dionex-ICS6000离子色谱仪、Dionex IonPac AS11-HC色谱柱、Dionex IonPac AS19色谱柱、Dionex IonPac AG19色谱柱:美国ThermoFisher公司;MS204S电子天平:梅特勒-托利多公司;Milli-Q超纯水仪:美国Millipore公司。
1.3 方法
1.3.1 标准溶液的制备
准确称取D-(-)-奎宁酸、乳酸、甲酸、乙酸、柠檬酸、DL-苹果酸、琥珀酸、DL-酒石酸标准品各100 mg,用超纯水溶解并定容至100 mL,配制成质量浓度均为1 000 mg/L的标准储备溶液。分别取1 mL标准储备溶液于同一容量瓶,超纯水定容至50 mL,配制成各组分质量浓度均为20 mg/L的混合标准中间溶液。取混合标准中间溶液,用超纯水配制成质量浓度为0.5 mg/L、1.0 mg/L、2.0 mg/L、5.0 mg/L、10.0 mg/L、20.0 mg/L的系列标准工作液。
1.3.2 样品前处理方法的选择
取葡萄酒样品1 mL,用超纯水稀释并定容至100 mL,记为样品A,即为直接稀释的前处理方法。取样品A通过RP净化小柱(经5 mL甲醇和15 mL超纯水活化),弃去前面3 mL流出液,收集后面流出液,记为样品B,即为稀释样品再经RP净化小柱净化的前处理方法。样品经0.22 μm水系滤膜过滤后,观察样品外观,并进行离子交换色谱分析,考察2种前处理方式对样品杂质的净化效果及目标物的保留能力。
1.3.3 仪器条件
分离色谱柱:Dionex IonPac AS19(4 mm×250 mm);保护柱:Dionex IonPac AG19(4 mm×50 mm);进样量:50 μL;流动相:KOH溶液(由Dionex EGC500 KOH淋洗液自动发生器在线产生);流速:1.0 mL/min;检测器:电导检测器;池温:30 ℃;柱温:30 ℃;抑制器:Dionex ADRS 600 4 mm;抑制电压:3.7 V;梯度洗脱条件:0~13 min,4 mmol/L KOH溶液;13~14 min,4~16 mmol/L KOH溶液;14~33 min,16 mmol/L KOH溶液;33~37 min,16~50 mmol/L KOH溶液;37~43 min,50 mmol/L KOH溶液;43~45 min,50~4mmol/LKOH溶液;45~50min,4mmol/LKOH溶液。
1.3.4 仪器条件选择
色谱柱选择:分别采用Dionex IonPac AS11-HC和Dionex IonPac AS 19两种阴离子交换柱对质量浓度为10 mg/L的8种有机酸混合标准溶液进行测定,考察不同的色谱柱对目标化合物的分离效果。
淋洗液浓度选择:调整氢氧化钾淋洗液浓度,对质量浓度为10 mg/L的8种有机酸混合标准溶液进行测定。考察不同浓度(2 mmol/L、4 mmol/L、6 mmol/L)的氢氧化钾淋洗液对奎宁酸、乳酸、乙酸、甲酸的分离效果,不同浓度(10 mmol/L、13 mmol/L、16 mmol/L、19 mmol/L)的氢氧化钾淋洗液对苹果酸、酒石酸、琥珀酸的分离效果。
流动相流速选择:设置不同流动相流速(0.8 mL/min、1.0 mL/min、1.2 mL/min),从柱压和柱效方面考察方法的适宜性。
1.3.5 方法学考察
线性关系:采用最优的检测方法对不同质量浓度的有机酸系列标准工作液进行测定,以有机酸质量浓度(x)为横坐标,峰面积(y)为纵坐标,绘制有机酸标准曲线,并计算标准曲线的回归方程和相关系数(R2)。
精密度试验:选择质量浓度为10 mg/L的8种有机酸混合标准溶液进行6次重复进样,记录目标化合物保留时间和峰面积,计算保留时间相对标准偏差(relative standard deviation,RSD)和峰面积RSD。
稳定性试验:选择质量浓度为10 mg/L的8种有机酸混合标准溶液分别在0 h、2 h、4 h、8 h、10 h、12 h、24 h进样测定,记录目标化合物峰面积,并计算峰面积RSD。
检出限、定量限试验:选择质量浓度为20 mg/L的8种有机酸混合标准溶液,采用最优的检测方法进行检测,以3倍的信噪比确定方法检出限(limit of detection,LOD),以10倍的信噪比确定方法定量限(limit of quantitatively,LOQ)。
加标回收率试验:取葡萄酒样品,结合本底值添加一定质量浓度的标准品,奎宁酸、乙酸、甲酸、苹果酸、琥珀酸、柠檬酸为250 mg/L、500 mg/L、1 000 mg/L三个水平加标量,乳酸为1 000 mg/L、2 000 mg/L、4 000 mg/L三个水平加标量,酒石酸为500 mg/L、1 000 mg/L、2 000 mg/L三个水平加标量。平行测定三次,计算目标化合物的回收率及RSD。
1.3.6 数据处理
采用Chromeleon 7.2.7软件进行数据处理和分析。
2 结果与分析
2.1 样品前处理条件优化
发酵型果酒因未经蒸馏处理,含有色素、氨基酸、糖类、酯类等丰富的有机物[23-24],这些有机物会影响色谱柱的分离效果,缩短色谱柱的使用寿命。本研究以葡萄酒为基质,对直接稀释(A)和稀释后经RP柱净化(B)的两种前处理方法进行比较。从外观上比较,样品A呈红色有颗粒物,样品B无色澄清。采用离子交换色谱对两个样品进行检测,结果见图1。由图1可知,相较于样品A,样品B图谱基线平稳,杂质峰少。因此,为保护色谱柱,减少杂质干扰,最终选择稀释后经RP净化柱净化的前处理方式。
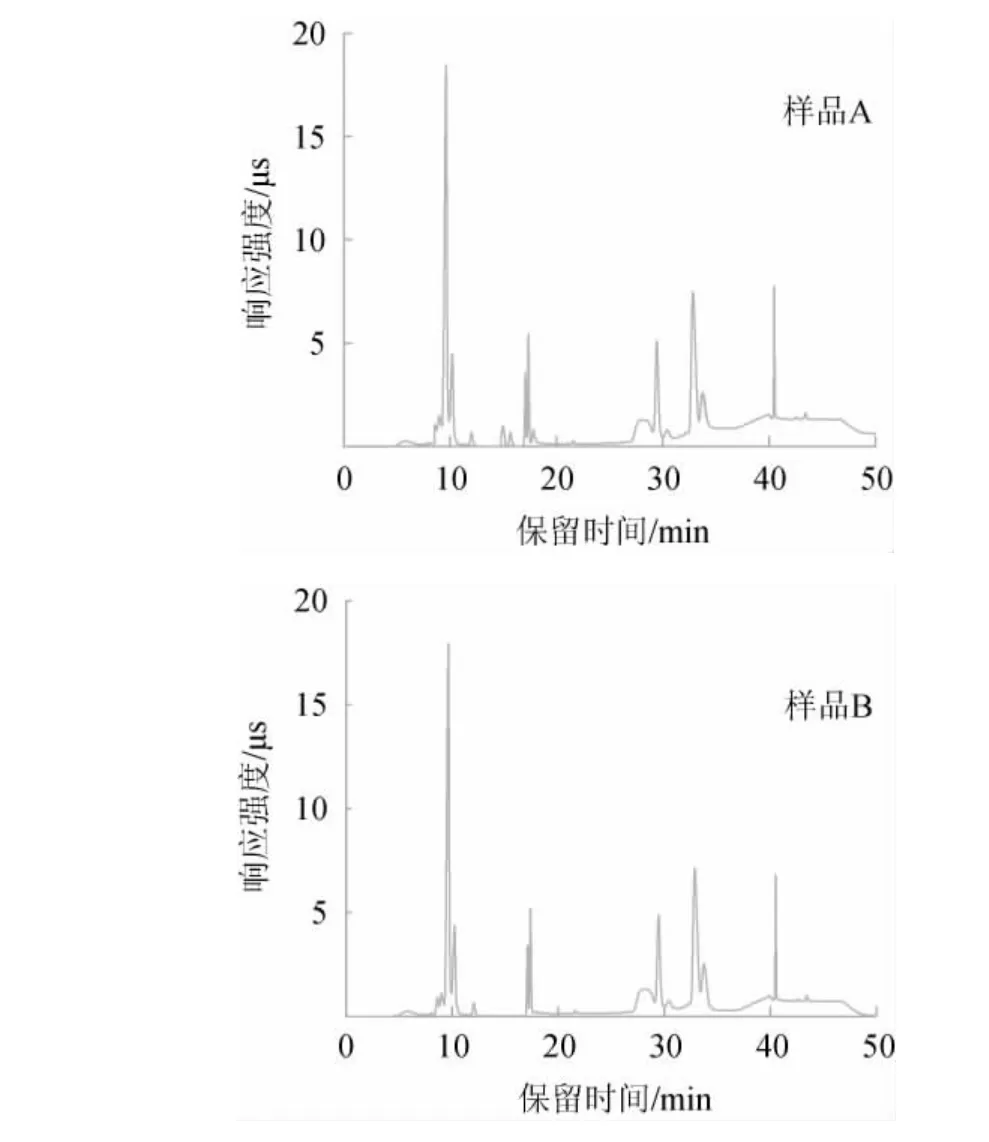
图1 葡萄酒样品经不同前处理方法离子交换色谱图Fig.1 Ion exchange chromatograms of wine samples with different pretreatment methods
2.2 仪器条件优化
2.2.1 色谱柱的选择
分别采用Dionex IonPac AS11-HC和Dionex IonPac AS19两种常用阴离子交换柱对质量浓度为10 mg/L的标准工作液进行测定,结果见图2。
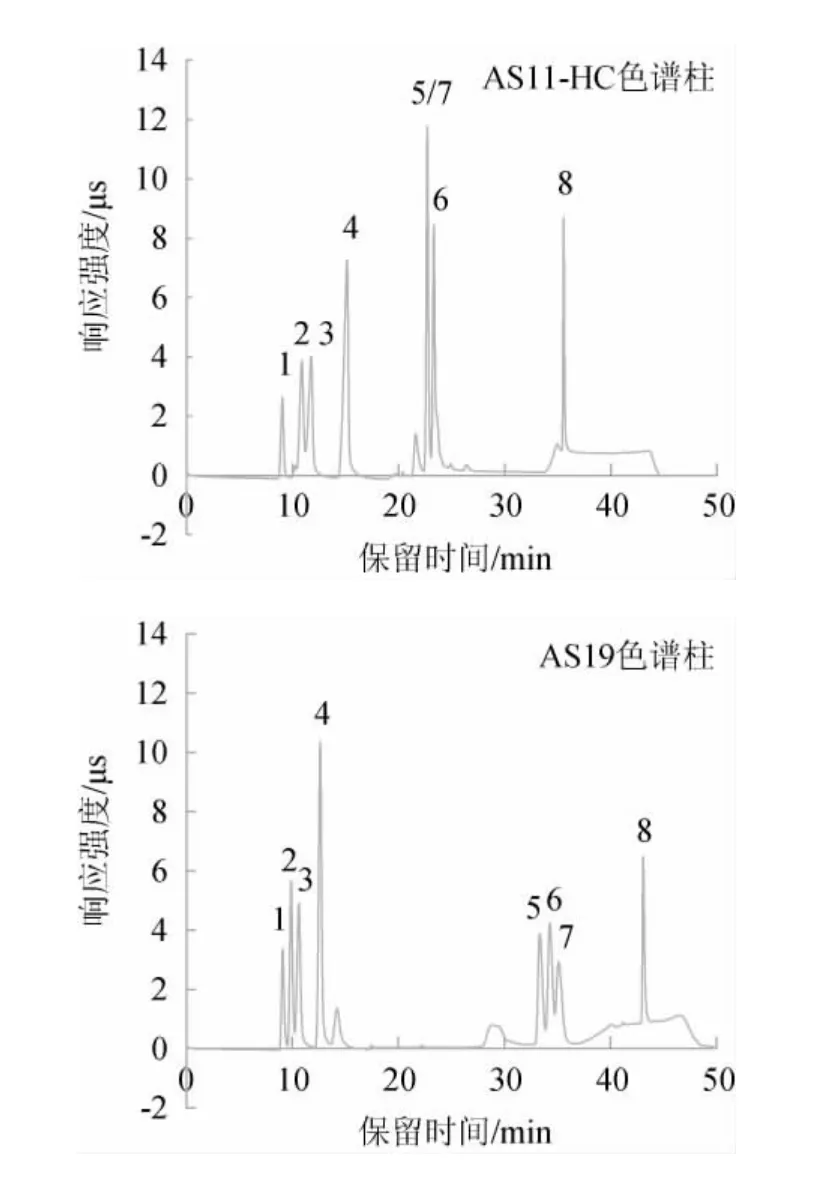
图2 10 mg/L标准工作液经Dionex IonPac AS11-HC(A)和Dionex IonPac AS19(B)色谱柱分离后的离子交换色谱图Fig.2 Ion exchange chromatogram of 10 mg/L standard working solution separated by Dionex IonPac AS11-HC (A) and Dionex IonPac AS19 (B) columns
由图2可知,两种色谱柱对有机酸的分离效果存在显著的差异。Dionex IonPac AS11-HC色谱柱无法很好地将琥珀酸和苹果酸分开,而Dionex IonPac AS19色谱柱能将8种有机酸有效分离,其中酒石酸和琥珀酸分离度稍差,其余组份的分离度均>1.4,分析原因可能是Dionex IonPac AS19色谱柱的固定相填料主要为超孔型EVB-DVB颗粒,本身带有正电荷,具有高容量、强亲水的特点,适用于各类复杂样品基体中的阴离子测定。因此,最终选用Dionex IonPac AS19色谱柱。
2.2.2 淋洗液浓度优化
因奎宁酸、乳酸、乙酸、甲酸待测组分与固定相亲和力较弱,最早被洗脱出来。选取不同浓度(2 mmol/L、4 mmol/L、6 mmol/L)的氢氧化钾溶液作为初始淋洗液,考察其对这4种有机酸的分离效果,结果见图3。由图3可知,氢氧化钾淋洗液浓度越高,洗脱能力越强,分离效果越差。当6 mmol/L氢氧化钾作为淋洗液时,奎宁酸、乳酸和乙酸分离效果不理想;当2 mmol/L和4 mmol/L氢氧化钾作为淋洗液时,目标化合物均能实现很好的分离,其中4 mmol/L氢氧化钾作为淋洗液时,总用时少,信号响应高,检测效率和灵敏度更优。故选用4 mmol/L氢氧化钾作为0~13 min的淋洗浓度。

图3 不同浓度氢氧化钾淋洗液分离奎宁酸、乳酸、乙酸及甲酸的离子交换色谱图Fig.3 Ion exchange chromatogram of quinic acid, lactate, acetate and formic acid separated at different concentrations of potassium hydroxide
苹果酸(2-羟基丁二酸)、酒石酸(2,3-二羟基丁二酸)、琥珀酸(丁二酸)的结构和性质比较相似,目标物出峰时间较为集中,分离难度大。因此,以10 mmol/L、13 mmol/L、16 mmol/L、19 mmol/L的氢氧化钾作为淋洗液,考察其分离效果,结果见图4。

图4 不同浓度氢氧化钾淋洗液分离苹果酸、酒石酸及琥珀酸的离子交换色谱图Fig.4 Ion exchange chromatogram of malate,tartaric acid and succinate separated at different concentrations of potassium hydroxide
由图4可知,10 mmol/L、13 mmol/L氢氧化钾作为淋洗液时,峰有拖尾现象,且检测时间较长;当选用19 mmol/L氢氧化钾作为淋洗液时,苹果酸、酒石酸和琥珀酸分离效果略差,影响其定量的准确性。综合比较,16 mmol/L氢氧化钾作为淋洗液时,苹果酸、酒石酸和琥珀酸的分离效果均较佳,因此,确定16 mmol/L氢氧化钾作为14~33 min的淋洗浓度。
2.2.3 流速优化
流动相流速对保留时间和系统压力都有很大的影响,因此考察不同流速(0.8 mL/min、1.0 mL/min和1.2 mL/min)对系统压力、峰形、出峰时间方面的影响,结果见图5。由图5可知,流速为1.2 mL/min时,柱压接近3 000 psi,目标峰尖锐对称;流速为1.0 mL/min时,柱压接近2 000 psi,目标峰略有变宽;流速为0.8 mL/L柱效较前两者有明显的降低,目标峰延后明显,因此,最终确定流速为1.0 mL/min。

图5 不同淋洗液流速下10 mg/L标准工作液的离子交换色谱图Fig.5 Ion exchange chromatogram of 10 mg/L standard working solution at different eluent flow rates
2.3 方法学考察结果
2.3.1 线性范围、检出限、定量限、精密度及稳定性试验
对8种有机酸的相关系数、检出限、定量限、精密度和稳定性进行测试,结果见表1。由表1可知,8种有机酸标准曲线的相关系数R2为0.996 5~0.998 7,说明各组份含量与峰面积呈良好线性关系,该方法可对相关物质进行准确定量分析。8种有机酸的检出限(LOD)为0.82~4.05 mg/L,定量限(LOQ)为2.74~13.5 mg/L,保留时间精密度试验结果的RSD≤0.07%,峰面积精密度试验结果的RSD≤1.90%,方法稳定性试验结果的RSD≤3.65%,各参数符合方法学要求,能满足8种有机酸定性和定量分析的要求。
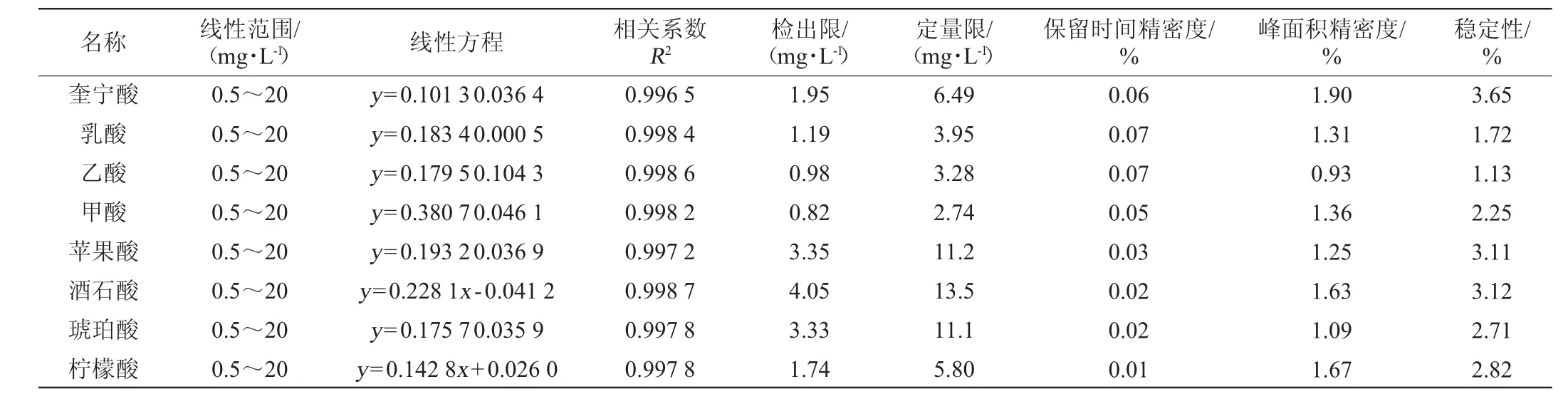
表1 8种有机酸的线性相关系数、检出限、定量限、精密度和稳定性结果Table 1 Correlation coefficients, limit of detection, limit of quantification, precision and stability results of the 8 organic acids
2.3.2 加标回收率试验
葡萄酒样品添加不同质量浓度标准物质的加标回收率试验结果见表2。由表2可知,8种有机酸的加标回收率在82%~125%之间,加标回收率试验结果的RSD为0.21%~5.13%,表明该方法具有较高的准确度。

表2 葡萄酒样品8种有机酸含量测定加标回收试验结果Table 2 Results of 8 organic acid content determination and standard recovery rate tests of wine samples
2.4 不同基质样品8种有机酸含量的测定
有机酸的组成和占比构建出不同果酒特有的味道,也是果酒功效性成分的重要来源之一[25-27]。为考察不同果酒中主要有机酸的组成和含量,运用建立的检测方法,对在市面上随机采集的葡萄酒、桑葚酒、蓝莓酒、杨梅酒和荔枝酒等不同基质果酒样品中的8种有机酸成分及含量进行测定,结果见表3。
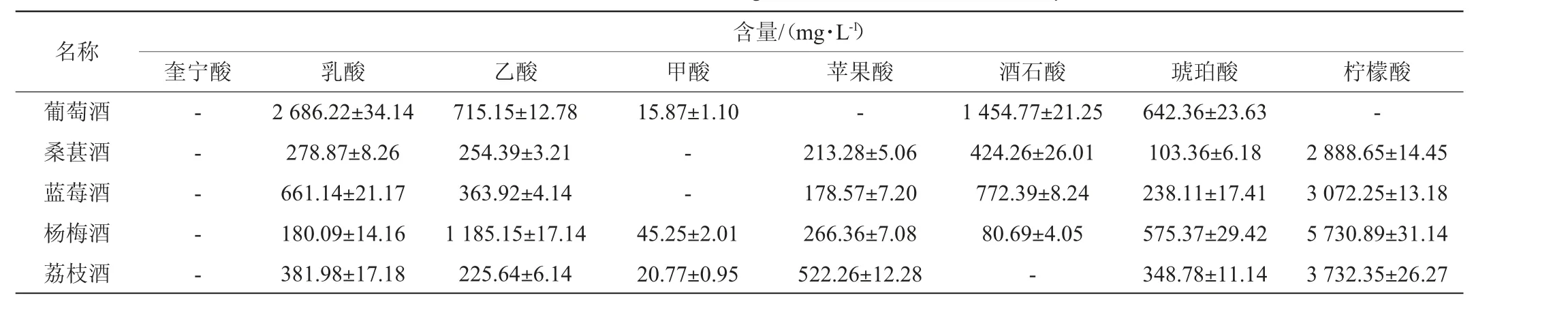
表3 5种果酒样品中8种有机酸含量的测定结果Table 3 Determination results of 8 organic acids in 5 fruit wine samples
由表3可知,葡萄酒主要有机酸成分是乳酸、酒石酸、琥珀酸和乙酸,这4种有机酸的总含量为5 498.50 mg/L,占总有机酸含量的99.7%,为葡萄酒主要呈味物质。桑葚酒、蓝莓酒、杨梅酒、荔枝酒的主要有机酸均为柠檬酸,其含量在2 888.65~5 730.89 mg/L之间,占比均>50%。此外,桑葚酒和蓝莓酒含有丰富的酒石酸,含量分别为424.26 mg/L和772.39 mg/L。杨梅酒含有乙酸和琥珀酸,含量分别为1 185.15 mg/L和575.37 mg/L,是其独特的果酸味重要来源。荔枝酒相对于其他果酒苹果酸含量更高,为522.26 mg/L。
3 结论
本研究通过优化样品前处理和仪器条件建立了同时测定发酵型果酒中8种有机酸含量的离子交换色谱法,即样品经稀释和RP柱净化后,经Dionex IonPac AS19色谱柱(4 mm×250 mm)分离,0~13 min 4 mmol/L和4~33 min 16 mmol/L氢氧化钾梯度淋洗,采用抑制型电导检测器进行检测。8种有机酸标准曲线的相关系数R2在0.996 5~0.998 7之间,检出限为0.82~4.05 mg/L,定量限为2.74~13.5 mg/L,精密度试验结果的相对标准偏差(RSD)均<3%,稳定性试验结果的RSD≤3.65%,加标回收率为82%~125%,加标回收率试验结果的RSD为0.21%~5.13%。该方法操作简便、性能稳定、安全环保,适用于各类果酒的测定。采用该方法对5类市售果酒样品中的8种有机酸进行检测,发现葡萄酒主要有机酸成分为乳酸、酒石酸、琥珀酸和乙酸,这4种有机酸的总含量为5 498.50 mg/L;桑葚酒、蓝莓酒、杨梅酒、荔枝酒的主要有机酸均为柠檬酸,其含量在2 888.65~5 730.89 mg/L之间。
