蓝莓叶提取物对2型糖尿病小鼠糖脂代谢的调节
2024-01-18王怡婷蒲首丞刘芬芬赵雯靓徐丽珊
王怡婷, 蒲首丞, 刘芬芬, 赵雯靓, 徐丽珊,2
(1.浙江师范大学 生命科学学院,浙江 金华 321004;2.浙江师范大学 浙江省特色经济植物生物技术研究重点实验室,浙江 金华 321004)
糖尿病是一种以持续性的高血糖症为典型病症的内分泌疾病,由胰岛素分泌水平下降和胰岛素敏感度下降导致,可致使机体糖脂代谢紊乱[1].2型糖尿病(type 2 diabetic,T2D)为发病率最高的一种糖尿病类型,若血糖得不到严格的控制,机体氧化应激反应激活的炎症反应将引发一系列的慢性并发症,给患者生活质量带来严重的影响[2].研究表明,糖尿病及其并发症的发生与氧化应激导致的炎症反应息息相关[3-4].目前,临床口服降血糖药物多种多样,因我国多以淀粉类食物为主食,α-葡萄糖苷酶(α-glucosidase,AG)抑制剂可延缓小肠中的糖苷酶对碳水化合物的水解,从而可有效控制患者餐后血糖[5-6].阿卡波糖作为典型的α-葡萄糖苷酶抑制剂(α-glucosidase inhibitor,AGI)类降血糖药物,因其作用强、起效快等优势被我国广泛使用,但同时也存在缺乏治疗的整体协调性和长期服用可能产生胃肠不适等不良反应等缺点[7-9].近年来,随着对植物来源降糖物质研究的不断深入,发现AGI不仅具有来源广泛、毒副作用小的优势,同时兼具多成分、多途径、多靶点、多环节的整体调节优势,在糖尿病的预防及治疗中受到了广泛的重视[10].
蓝莓是杜鹃花科(Ericaceae)越橘属(Vacciniumspp.)植物,每年定期整形修剪植株将产生大量的蓝莓叶,因对蓝莓叶的相关研究较少,且仍未得到有效利用,只能将其废弃处理[11].早在我国古代,越橘属植物叶子可作药茶,具有解毒、消炎之功效[12].研究显示,蓝莓叶富含多酚、黄酮、花青素等活性成分,且蓝莓叶多酚的平均含量约为蓝莓果实的30倍,有望将其应用于糖尿病、癌症、病毒抵抗等治疗[13-14].因此,本实验室前期已对12个常见栽培蓝莓品种4个季节叶子进行体外保健活性的比对分析,其中冬季‘杰兔’蓝莓叶在AG抑制活性及抗氧化活性方面脱颖而出,有望深入动物模型进行抗糖尿病的相关研究[15].目前,有关蓝莓叶活性成分分析及其体外生物活性方面报道较多,但对改善糖尿病方面却鲜有研究.
本研究通过分析冬季‘杰兔’蓝莓叶提取物(blueberry leaf extract,BLE)对高糖高脂饮食联合链脲佐菌素(streptozotocin,STZ)法诱导的T2D小鼠的生化指标、组织病理变化,以期评估其对T2D小鼠胰岛素抵抗、糖脂代谢的改善作用,并通过分析机体氧化应激水平的变化以初步探究改善机制,为蓝莓叶未来应用于降糖产品的开发提供理论依据.
1 材料与方法
1.1 实验材料与试剂
12月‘杰兔’蓝莓叶采自浙江金华浙江师范大学蓝莓基地,于80 ℃杀青5 min,50 ℃鼓风干燥至恒质量,粉碎后通过40目筛网过筛得蓝莓叶粉末,以1/20的料液比(g/mL)加入去离子水,于70 ℃水浴锅中热水浸提1.5 h,趁热抽滤,减压旋蒸浓缩,真空干燥至恒质量,即得BLE,于-4 ℃冰箱中保存备用[15].
高糖高脂饲料和普通饲料均购于南京盛民科研动物养殖场;STZ购于美国Sigma公司,WXBD5718V;阿卡波糖购于德国Bayer公司,H20010716;血清胰岛素(fasting insulin,FINS)水平、血脂水平、糖代谢水平、氧化应激水平、TUNEL细胞凋亡原位检测试剂盒均购于南京建成生物工程研究所;其他化学试剂均购于国药集团.
1.2 动物造模与分组干预
SPF级雄性ICR小鼠,体质量(20±2) g,购于浙江省医学科学院,合格证号:SYXK(浙)2019—0011.动物操作符合浙江师范大学实验动物福利伦理审查要求,受理编号:ZSDW2022012.将适应性饲养7 d的ICR小鼠根据体质量随机分为正常组(n=10,饲以基础饲料)和造模组(n=100,饲以高糖高脂饲料),饮食诱导28 d.禁食不禁水12 h后给予造模组小鼠STZ腹腔注射,注射剂量为125 mg·kg-1,注射次数为1次.STZ注射后的3 d和7 d,对造模组小鼠进行12 h禁食不禁水的处理,剪尾取血测定空腹血糖值(fasting blood glucose,FBG),若2次均≥11.1 mmol·L-1,则认定T2D小鼠模型建成可用于后续实验,将其以每组10只,按FBG随机分为5组:模型组、阳性组、BLE低剂量组(BLEL)、BLE中剂量组(BLEM)、BLE高剂量组(BLEH),分别按25 mL·kg-1·d-1去离子水、20 mg·kg-1·d-1阿卡波糖、200 mg·kg-1·d-1BLE、400 mg·kg-1·d-1BLE和800 mg·kg-1·d-1BLE灌胃干预35 d;正常组以25 mL·kg-1·d-1去离子水灌胃干预35 d.
1.3 血糖指标的测定
灌胃干预期间每隔7 d,禁食不禁水12 h后,对各实验组小鼠进行剪尾取血测定其FBG.让小鼠自由进食2 h,测定小鼠餐后2 h血糖值(2-hours postprandial blood glucose,2 h PG).根据疗效评定标准中的总有效率标准,评价BLE对降低T2D小鼠2 h PG的疗效,按文献[16]计算总有效率.显效率为实验组2 h PG相对模型组下降30%及以上的小鼠占比;有效率为实验组2 h PG相对模型组下降10%~29%的小鼠占比;无效率为实验组2 h PG无变化或相对模型组下降10%以内的小鼠占比.
1.4 FINS与血脂指标的测定
末次灌胃干预后对各实验组小鼠进行禁食不禁水12 h的处理,小鼠乙醚麻醉后眼眶静脉丛采血.将采集的血液样品静置于4 ℃冰箱过夜分层,以1 500 r·min-1离心15 min取上层血清.根据试剂盒操作流程完成FINS、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定.根据FINS和FBG,按文献[17]计算胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR).
1.5 肝脏糖代谢途径相关指标的测定
将取血后的小鼠立即脊椎脱臼处死,置于冰袋上快速解剖取肝脏保存于-80 ℃超低温冰箱中备用.按预实验所得稀释比例,于肝脏组织中加入0.9%生理盐水.根据试剂盒操作流程,取组织匀浆上清液完成葡萄糖激酶(glucokinase,GCK)、葡萄糖-6-磷酸酶(glucose-6-phosphatase,G-6-Pase)和肝糖原测定.
1.6 胰脏、肝脏氧化应激途径相关指标的测定
将取血后的小鼠立即脊椎脱臼处死,置于冰袋上快速解剖取胰脏保存于-80 ℃超低温冰箱中备用.于储存备用的胰脏和肝脏组织中,按预实验所得稀释比例加入0.9%生理盐水制得匀浆.根据试剂盒操作流程,取组织匀浆上清液完成总超氧化物歧化酶(total superoxide dismutase,T-SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)和丙二醛(malondialdehyde,MDA)测定.
1.7 胰脏、肝脏病理切片制作及观察分析
将解剖取得的胰脏和肝脏迅速固定于4%的多聚甲醛中,制作石蜡切片,切片厚度为4 μm.常规苏木精-伊红(hematoxylin-eosin staining,H&E)染色,根据试剂盒操作流程完成TUNEL细胞凋亡原位检测,显微镜观察组织的病理学变化情况,使用Image-Pro Plus软件分析计算细胞凋亡率.
1.8 数据处理
2 结果与分析
2.1 BLE对T2D小鼠FBG和2 h PG的影响
灌胃干预前,造模组小鼠血糖值分布集中,均极显著高于正常组(P<0.01),表明T2D小鼠模型建立成功.干预35 d后,与模型组相比,BLE干预组小鼠血糖均极显著下降(P<0.01),且随剂量增大FBG下降程度增大,说明BLE能剂量依赖性地降低T2D小鼠的FBG水平(见图1).
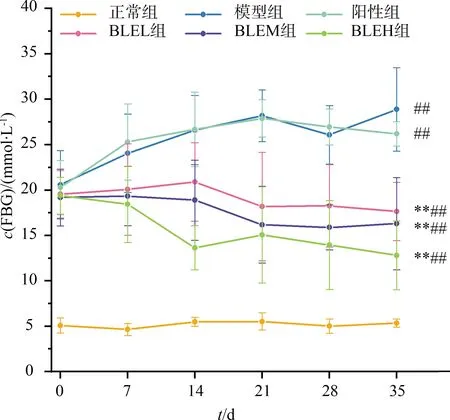
注:与模型组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);与正常组相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);与阳性组相比,+表示差异显著(P<0.05),++表示差异极显著(P<0.01).下同
BLE干预前,与正常组相比,造模组小鼠的2 h PG均极显著升高(P<0.01),说明T2D小鼠餐后血糖调节功能出现异常.干预28 d后,与模型组相比,BLE干预组小鼠血糖水平均极显著下降(P<0.01),且随剂量增大,2 h PG下降程度增大,说明BLE能剂量依赖性地降低T2D小鼠的2 h PG(见图2).且BLEM组和BLEH组小鼠治疗总有效率均达100%,与阳性组总有效率一致,说明BLE可有效降低T2D小鼠2 h PG(见表1).
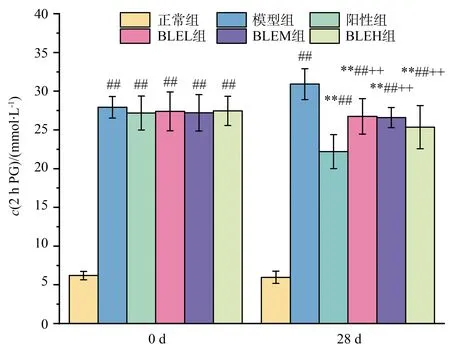
图2 BLE对T2D小鼠2 h PG的影响(n=10)
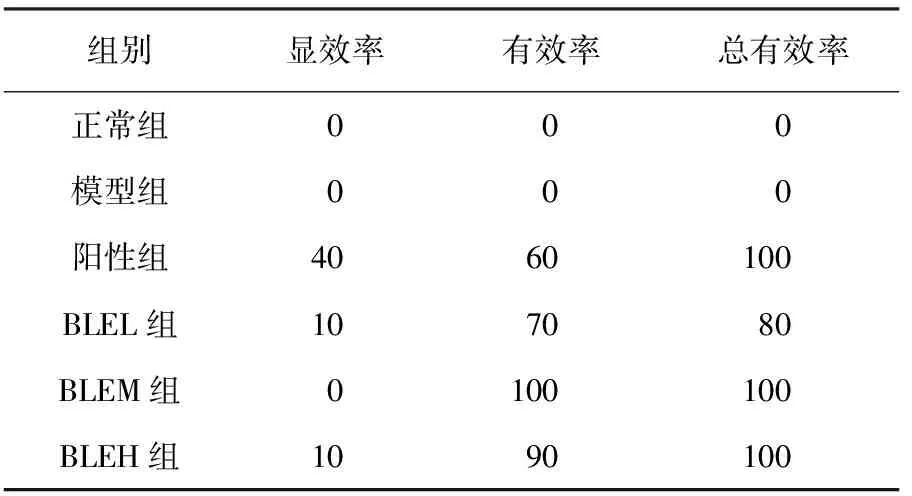
表1 BLE对T2D小鼠2 h PG的总有效率的影响(n=10) 单位:%
2.2 BLE对T2D小鼠FINS和HOMA-IR的影响
模型组小鼠的FINS含量与正常组相比显著下降(P<0.05),结合FBG含量计算可知,模型组HOMA-IR较正常组显著升高(P<0.05),说明模型组小鼠的胰岛素分泌水平下降且伴随机体胰岛素抵抗现象.与模型组相比,BLE干预组小鼠的FINS含量增加,其中BLEH组呈极显著增加(P<0.01),与正常组无显著性差异,说明BLE可有效改善T2D小鼠胰岛素分泌水平.与模型组相比,BLE干预组小鼠的HOMA-IR均极显著降低(P<0.01),且随剂量上升呈梯度下降,说明BLE可极显著改善T2D小鼠胰岛素抵抗症状,且具有剂量依赖效应(见表2).

表2 BLE对T2D小鼠FINS和HOMA-IR的影响(1U=1.67×10-8 kat,n=6)
2.3 BLE对T2D小鼠血脂水平的影响
BLE灌胃干预T2D小鼠35 d后,模型组小鼠血清中TC,TG和LDL-C浓度均显著高于正常组(P<0.05),HDL-C浓度显著低于正常组(P<0.05),说明T2D小鼠血脂异常.BLE干预组小鼠血清的TC,TG和LDL-C浓度随BLE灌胃剂量的上升呈梯度下降,HDL-C浓度随BLE灌胃剂量的上升呈梯度上升;BLEH组小鼠的TC,TG,HDL-C和LDL-C浓度与模型组呈极显著差异(P<0.01),其中TC浓度与正常组无显著性差异,HDL-C浓度显著高于正常组(P<0.05),说明BLE可有效改善T2D小鼠的血脂异常症状(见表3).
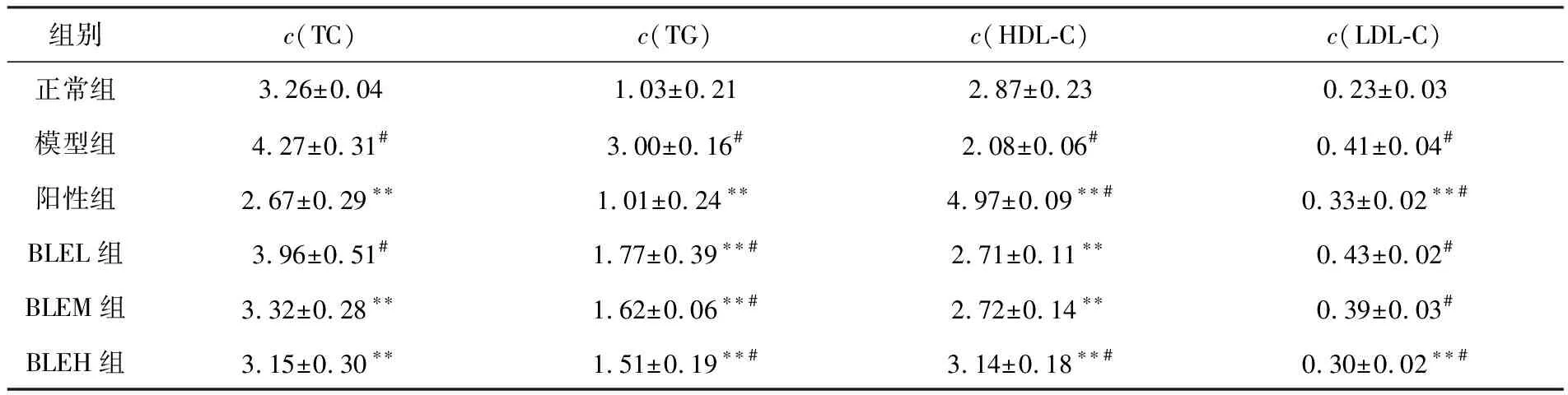
表3 BLE对T2D小鼠TC,TG,HDL-C和LDL-C的影响(n=6) 单位:mmol·L-1
2.4 BLE对T2D小鼠肝脏糖代谢水平的影响
酶水平及中间代谢产物水平是探究糖代谢的一种重要途径,肝脏中GCK和G-6-Pase的活性及肝糖原浓度则可作为重要指标.干预35 d后,与正常组相比,模型组小鼠的GCK活性和肝糖原浓度极显著下降(P<0.01),G-6-Pase活性极显著升高(P<0.01),说明T2D小鼠糖代谢过程发生异常.与模型组相比,BLE干预组小鼠的GCK活性和肝糖原浓度均极显著升高(P<0.01),且随剂量的增加呈梯度上升,说明BLE可剂量依赖性地抑制糖异生途径,促进肝糖原的合成,从而使肝糖原的储备量增多;BLEM组和BLEH组小鼠的G-6-Pase活性极显著下降(P<0.01),且随剂量的增加呈梯度下降,说明BLE可剂量依赖性地增强糖酵解途径.综上表明,BLE可综合多条途径改善T2D小鼠糖代谢异常症状(见表4).
表4 BLE对T2D小鼠GCK,G-6-Pase和肝糖原的影响(n=6)
2.5 BLE对T2D小鼠胰脏和肝脏抗氧化水平的影响
模型组小鼠胰脏和肝脏的T-SOD活性和GSH-PX质量摩尔浓度与正常组相比均极显著下降(P<0.01),MDA浓度极显著升高(P<0.01),说明T2D小鼠胰脏和肝脏的抗氧化水平极显著下降,组织细胞氧化应激损伤严重.BLE干预组小鼠胰脏和肝脏的T-SOD活性和GSH-PX质量摩尔浓度随BLE灌胃剂量的增加呈梯度增加,其中BLEH组小鼠胰脏和肝脏的T-SOD活性和GSH-PX质量摩尔浓度极显著高于正常组(P<0.01);胰脏和肝脏的MDA浓度随BLE灌胃剂量的增加呈梯度下降,其中BLEM组和BLEH组胰脏的MDA已降低至与正常组无显著性差异,BLEH组肝脏的MDA已降低至与模型组产生极显著差异(P<0.01).说明BLE可剂量依赖性地增强T2D小鼠胰脏和肝脏的抗氧化水平,减轻其氧化应激损伤(见表5).

表5 BLE对T2D小鼠胰脏和肝脏T-SOD,GSH-PX和MDA的影响(n=6)
2.6 BLE对T2D小鼠胰脏和肝脏抗氧化水平的影响
正常组小鼠胰脏胰岛边界清晰,胰岛体积较大,岛内细胞数量多且分布均匀,胞质丰盈,核圆均匀.模型组小鼠胰脏出现明显的病理变化,箭头所指为典型病变处,表现为严重的胰岛萎缩,岛内只可见少数细胞,且中心部细胞出现空泡化现象.BLE干预组随BLE灌胃剂量增加,小鼠胰脏病理症状呈梯度减轻,说明BLE可减轻糖尿病对胰脏的损伤,并呈现出一定的剂量依赖性(见图3).
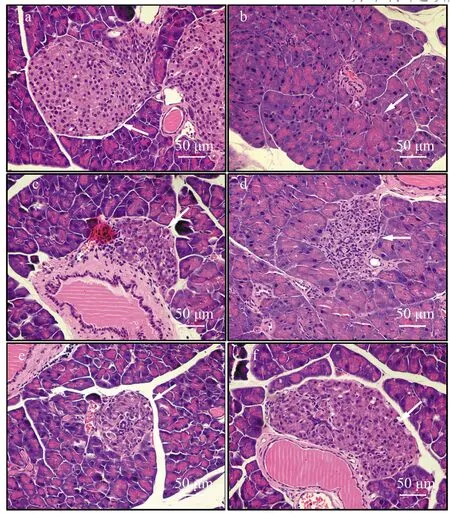
正常组小鼠TUNEL染色切片中只可见少量细胞核出现棕染现象,清晰可见较大体积的胰岛,凋亡率仅为1.02%;模型组显示大部分细胞核存在棕染现象,胰岛萎缩严重,岛内细胞较少,凋亡率可达24.38%;阳性组、BLEL组、BLEM组、BLEH组的细胞凋亡率分别为11.52%,24.21%,17.49%,1.67%.BLE干预组细胞核的棕染现象随灌胃剂量增加而减少,凋亡率呈下降趋势,说明BLE可剂量依赖性地减轻糖尿病带来的胰脏细胞凋亡现象,缓解胰脏器官损伤(见图4).
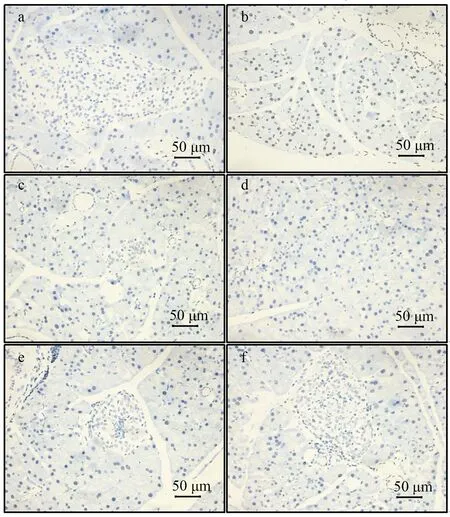
正常组小鼠肝脏细胞边界清晰,均围绕中央静脉呈放射状排列,细胞核与细胞质均一,几乎无脂滴液泡.模型组小鼠肝脏出现较严重的形态变化,主要表现为细胞排列紊乱,肝细胞体积明显增大,细胞核质疏松模糊,出现大量脂滴空泡.BLE干预组随BLE灌胃剂量增加肝脏细胞排列更为整齐,脂滴液泡减少,说明BLE可减轻T2D小鼠肝脏损伤(见图5).
正常组小鼠细胞凋亡率仅为0.87%,仅有少数细胞发生核棕染现象;模型组小鼠TUNEL染色切片显示大多数细胞呈现阳性反应,凋亡率可达39.91%;阳性组、BLEL组、BLEM组、BLEH组的TUNEL染色细胞凋亡率分别为29.56%,36.86%,26.43%,15.81%.BLE干预组细胞核的棕染现象随灌胃剂量增加而减少,凋亡率呈下降趋势,说明BLE可减轻糖尿病带来的肝脏细胞凋亡现象,缓解肝脏器官损伤,并呈现一定的剂量依赖性(见图6).
3 讨 论
据本实验室前期研究,BLE对AG活性具有良好的抑制作用[15],可将其作为AGI类型的降血糖物质进行研发[18].纯化分离BLE后发现,其多酚类物质中的槲皮素及其衍生物不仅含量高,且为最优活性的体外降血糖化合物[15],该类物质可通过协同疏水作用与氢键作用改变AG的内聚模式,从而竞争性地抑制AG活性[19].基于体外降血糖活性实验,本文进一步以糖尿病小鼠模型探究BLE的体内降血糖活性,结果显示,BLE可剂量依赖性地降低T2D小鼠2 h PG,且治疗总有效率与阳性组相一致,提示BLE与阳性组阿卡波糖的降糖机制相似,在体内竞争性地抑制AG活性阻断葡萄糖来源,从而达到降餐后血糖的作用.
此外,BLE作为天然来源的降血糖物质,同时还具备了阿卡波糖所缺乏的整体性调节糖尿病病症的能力[10].糖尿病最典型的病症之一为持续性高血糖症,血糖水平持高不下可使FINS水平代偿性升高,导致机体对胰岛素的敏感性降低;随病情发展,胰岛β细胞进入超负荷耗竭状态使胰岛素分泌水平下降,机体最终产生胰岛素抵抗[20].本实验中,BLE能有效降低T2D小鼠的FBG、升高FINS、降低机体的HOMA-IR,提示BLE相较阿卡波糖可更为快速的改善糖尿病FBG水平和FINS分泌水平,减轻胰岛素抵抗症状,推测其可通过多条途径,更快速地改善糖尿病典型症状.
a:正常组;b:模型组;c:阳性组;d:BLEL组;e:BLEM组;f:BLEH组图3 BLE对T2D小鼠胰脏病理形态影响
a:正常组;b:模型组;c:阳性组;d:BLEL组;e:BLEM组;f:BLEH组图4 BLE对T2D小鼠胰脏细胞凋亡的影响
a:正常组;b:模型组;c:阳性组;d:BLEL组;e:BLEM组;f:BLEH组图5 BLE对T2D小鼠肝脏病理形态的影响

a:正常组;b:模型组;c:阳性组;d:BLEL组;e:BLEM组;f:BLEH组图6 BLE对T2D小鼠肝脏细胞凋亡的影响
氧化应激系统可与不同炎症通路中的促炎因子和转录调节因子相互作用影响糖尿病的发生[21].正常人在血糖水平升高时,机体可通过激活AMPK/SIRT1通路,下调NOX2/NOX4通路中NADPH的表达,升高SOD和GSH-PX等抗氧化酶的活性,同时降低MDA等具有细胞毒性的脂质过氧化终产物浓度[22].本实验显示,BLE可通过提高T2D小鼠胰脏和肝脏中SOD活性和GSH-PX浓度增强机体活细胞抗氧化能力,使机体维持在氧化还原自稳态,同时降低胰脏和肝脏中MDA浓度减轻其氧化应激损伤,从而有效保护胰脏和肝脏正常生理形态结构,这与胰脏和肝脏组织HE染色切片观测结果相一致.本实验室前期研究[15]显示,冬季‘杰兔’品种蓝莓叶多酚含量高,其提取物具有优良的体外抗氧化活性(DPPH·,ABTS+和·OH清除能力).体内外实验相结合表明,BLE可作为抗氧化剂在减弱所摄入的食物氧化作用的同时,通过提升T2D小鼠胰脏和肝脏的抗氧化水平,减少脂质过氧化带来的氧化应激损伤,保护脏器正常生理形态结构,使其正常行使生化功能.
目前认为,胰岛β细胞是机体内唯一能产生降血糖激素——胰岛素的组织细胞.而肝脏是胰岛素调节糖代谢的主要靶器官之一,其维稳血糖主要是以协调糖异生、糖酵解及糖原的合成分解三大过程实现的,肝脏糖代谢异常可直接体现在糖代谢酶活性和糖代谢产物浓度的变化中[23].GCK作为糖酵解和肝糖原合成过程的第1个关键酶,其活性的升高可提升感知和响应胰岛素主要信号通路IRS1/PI3K/AKT调控的能力,促进糖酵解过程,并启动肝糖原的合成以增加肝糖原储存量;G-6-Pase是糖异生过程的关键限速酶,GCK活性的升高可同步下调G6PC等基因的表达以抑制糖异生过程,维持血糖稳态[24].本实验结果显示,BLE能有效提高T2D小鼠肝脏中的GCK活性和肝糖原浓度,降低G-6-Pase活性,提高T2D小鼠血清FINS水平,表明BLE可改善肝脏的糖代谢功能,同时增强胰腺的胰岛素分泌功能,从而达到显著的体内降血糖功效.
糖尿病常因糖代谢紊乱联动导致脂代谢紊乱,从而引起高脂血症,血脂异常可直接体现在TC,TG,LDL-C和HDL-C的浓度变化中.本实验结果显示,BLE能有效降低T2D小鼠TC,TG和LDL-C水平,同时升高HDL-C水平,表明BLE可有效改善糖尿病高血脂症状,对脂质代谢具有很好的调节作用.长期高血脂状态可在动脉管腔内壁形成斑块堵塞,致使动脉粥样硬化、冠心病、肢体坏死等严重的糖尿病并发症,因此,BLE对脂质代谢的改善和脂毒性的清除可成为预防、改善糖尿病的一种重要手段[25].
BLE中富含多酚类物质,作为新型AGI,推测其可通过竞争性抑制小肠黏膜上的AG活性,阻断葡萄糖的来源,达到降低餐后血糖的作用;BLE同时具有优良的抗氧化活性,可作为新型抗氧化剂,其不仅可与小鼠消化道中的食物反应减弱其氧化作用,还可通过提高T2D小鼠主要胰岛素靶器官——胰脏和肝脏的抗氧化水平,减轻其氧化应激损伤,保护组织细胞的生理形态结构,增强胰腺胰岛素分泌功能的同时维稳肝脏糖代谢功能.综上所述,BLE可综合多条途径、多个环节、多项靶点,整体性地对机体血糖和血脂水平进行有效调节.
本研究从小鼠生理生化指标的变化入手,揭示了BLE对T2D小鼠糖脂代谢的调节作用,根据对氧化应激途径和糖脂代谢途径中酶水平和中间代谢产物水平的分析,初步解释了BLE对T2D小鼠糖脂代谢的调节机制,为蓝莓叶在预防治疗糖尿病方面的应用提供理论基础.为了更好地探究BLE对T2D小鼠的降血糖机制,可从PI3K/AKT/mTOR信号通路结合AMPK/SIRT1/NOX4信号通路,进一步从分子水平综合探究BLE对T2D小鼠的胰脏和肝脏的氧化应激反应、炎症反应和脏器细胞变性等的影响机制.
