从品种特性到功能基因组:双峰驼基因组学研究进展
2024-01-18TuyatsetsegJambal吉日木图
明 亮,Tuyatsetseg Jambal,吉日木图*
骆驼是荒漠、半荒漠地区特有的畜种,是当地农牧民极为重要的奶源、肉源及交通工具,素来有“沙漠之舟”美称[1]。骆驼属于骆驼科动物,起源可追溯到始新世时期(3500万年前)的北美洲,包括骆驼属、羊驼属和小羊驼属[2]。骆驼属包括双峰驼(Bactrian camel)和单峰驼(Dromedary),其中双峰驼主要分布在亚洲中部和东部的沙漠或干旱、寒冷地区;早在4500年前在伊朗北部和土库曼斯坦南部地区被驯化[3]。单峰驼主要分布在阿拉伯、印度及北非等较为炎热的地带;大约在5000年前在阿拉伯地区被驯化[4]。羊驼属和小羊驼属的原产地为南美洲,其特点是无驼峰,也称为无峰驼或羊驼、骆马[5]。骆驼科动物的生物学分类及其分布地区见图1。世界上骆驼属唯一幸存的野生物种-野生双峰驼(Wild two-humped camel),目前仅存1000峰左右[6-7]。2002年,野生双峰驼被国际动物保护同盟(IUCN)提升为极濒危物种,同大熊猫一样珍贵。
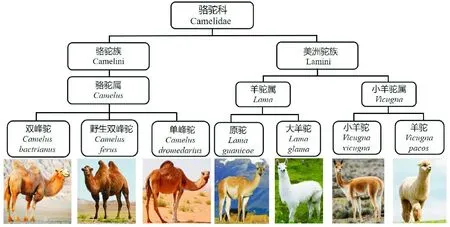
图1 骆驼科动物的生物学分类
1 双峰驼分布及品种分类
双峰驼被列为蒙古民族的“草原五畜”之一,是最能适应沙漠极端气候的大型哺乳动物之一。双峰驼善于行走在茫茫无际的沙漠中,是古代丝绸之路上最适合、最主要的运输工具,被誉为连接东西方文化的“桥梁”,也成为了古丝绸之路的不朽象征[8]。双峰驼分布广泛,广阔的沙漠、半沙漠和荒漠草原都是双峰驼适合的生存环境。由于地理分7布广泛,再加之牧民长时间的驯养和精心选育,形成了双峰驼各具特色而又品性优良的特点,为养驼业的发展及骆驼产品的开发与利用做出了巨大贡献[9]。
1.1 家养双峰驼品种分类
中国是世界上双峰驼的主要分布区域之一。根据2020国家统计年鉴,全国现有骆驼40.5万峰,主要分布在新疆、内蒙古、青海、甘肃、宁夏等地,其中内蒙古自治区17.3万峰,新疆维吾尔自治区18.5万峰,甘肃省3.0万峰,青海省1.7万峰。中国的双峰驼属于乳、肉、绒、役兼用型,毛色多以浅褐色、杏黄色为主。目前,根据地理位置的分布分别形成了阿拉善双峰驼(Alxa Bactrian)、苏尼特双峰驼(Sonid Bactrian)、青海双峰驼(Qinghai Bactrian)、塔里木双峰驼(Tarim Bactrian)和准噶尔双峰驼(Junggar Bactrian)五个品种[10-11](见表1)。

表1 双峰驼分布及品种特性
蒙古国的家养双峰驼属毛、肉、皮、乳、役兼用型,毛色以棕红色为主,现存约43.4万峰,主要分布在戈壁地区,包括东部和南部戈壁以及戈壁阿勒泰地区,可占到全国骆驼总数的71.2%。此外,8.1%的骆驼群体分布于蒙古国的平原及戈壁草原地带;剩余少部分主要集中在东方省、苏和巴托尔省、库苏古尔省、后杭爱省等山脉地区。由于地理位置上广度的分布,蒙古国境内形成了适应当地气候环境的独特的骆驼品种,为嘠利宾戈壁红驼(Galbiin Gobiin Ulaan Bactrian),哈那赫彻棕驼(Heniin Hetsiin Huren Bactrian)和图赫么通拉嘎驼(Tokhom-tungalag Bactrian)[12-13](表1)。
哈萨克斯坦地处欧亚大陆腹地,东接我国新疆地区,是世界第一大内陆国。哈萨克斯坦境内的荒漠与草地占国土总面积的80%以上,为骆驼提供了良好的生存环境,是世界上骆驼分布最集中的国家之一。与仅有双峰驼品种的中国相比,哈萨克斯坦既有双峰驼,又有单峰驼,骆驼资源丰富。其中,双峰驼主要以哈萨克双峰驼品种(Kazakh)为主,主要用于产奶、肉和皮[14](表1)。
1.2 野生双峰驼群体特性
长期以来,根据文献记载和考查资料,早期野生双峰驼分布范围相当广泛,数量也较多;整个中亚至西亚东部的低海拔丘陵及平原地区都是野生双峰驼的栖息地。但时至今日,由于人类活动的影响及生态环境的日益恶化,野生双峰驼的分布区域极度缩小,种群数量也不断下降。目前,野生双峰驼孤立分布在我国新疆塔里木盆地的塔克拉玛干沙漠、罗布泊北部、阿尔金山北麓、蒙古国以及中蒙边境的阿尔泰戈壁地区[6-7]。野生双峰驼毛色以浅褐色为主,四肢袖长,喜欢群居,嗅觉及其灵敏,可嗅出1 500 m远的水源,这对于生存在荒野的野生双峰驼来说是及为重要的。
2 双峰驼全基因组特性
相比其他畜种,双峰驼群体遗传学及基因组测序研究相对滞后。2007年,Jirimutu等[15]测定并揭示了国家一级保护动物野生双峰驼的全长线粒体序列,并说明现存野生双峰驼和家养双峰驼具有各自独立的母系起源[16],首次打破了“野生双峰驼是家养双峰驼的直系祖先”的说法,揭开了双峰驼遗传学研究中最主要的奥秘之一。为了进一步探究双峰驼基因组特性,研究人员进行了高深度的denovo测序,拼接了第一版双峰驼参考基因组,并绘制了首份基因组草图[17]。通过拼接共获得了2.01Gb的基因组序列(contig N50 85.3Kb,scaffold N50 2.0Mb),共注释出20 821个蛋白编码基因;与野生双峰驼相比,家养双峰驼基因组外显子区域内的杂合子率(6×10-4)要显著低于野生双峰驼的杂合子率(7×10-4),表明家养双峰驼基因组中的一些基因受到了人工选择;同时又揭示了双峰驼独特的红细胞、脂类代谢和重链抗体相关联的特异基因的进化历程,为后续进一步深入研究双峰驼的功能基因组奠定了基础[17](表2)。

表2 双峰驼基因组研究比较
随后,Wu等[2]基于比较基因组学的方法对有峰驼(双峰驼和单峰驼)和无峰驼(羊驼)基因组进行了测序组装,进一步提升了双峰驼基因组组装水平(contig N50 139Kb,scaffold N50 8.8Mb);且群体历史规模分析显示三个物种的群体规模与地质年代变化密切相关,表明有峰驼和无峰驼祖先分歧时间大约发生在1700万年前,单峰驼和双峰驼分歧时间发生在440万年前。进一步,从比较基因组层面剖析了骆驼科动物的沙漠适应性机制,并发现了一系列与双峰驼沙漠适应性相关的新基因[2]。此外,基于线粒体序列的双峰驼群体基因组学的研究发现,中国、蒙古国和俄罗斯地区的家养双峰驼群体属于单母系起源,且不同地理位置之间的双峰驼群体之间存在基因渗入情况[18-20]。
为了进一步提升双峰驼基因组组装质量,Ming等[21]利用二代、三代及Hi-C(高通量染色体构象捕获技术)辅助组装相结合的测序策略,组装获得了连续性好、准确度高的染色体水平的野生双峰驼基因组精细图谱,其基因组大小为2.09 Gb,组装的Contig N50和Scaffolds N50分别达到了5.37 Mb和76.03 Mb。为双峰驼功能基因组的研究提供了较完整、全面的染色体水平的参考序列(表2)。
3 双峰驼的起源与进化的基因组学研究
家养动物的起源与驯化一直是考古学家和动物遗传学家共同关注的热点问题之一,其研究的核心是野生祖先的来源,起源地及驯化时间等。根据古生物学家发现的地质化石资料,双峰驼是由始新时期(距今约5 500万年)的原柔蹄类动物进化而来;约在200万年前,双峰驼从北美发源地一路迁徙,渡过白令海峡进入欧亚大陆,并在此大量扩散[23]。考古学家发现,在伊朗北部和土库曼斯坦南部地区出土的双峰驼化石,是现存最早的双峰驼化石,表明此地是双峰驼最早的驯化地,驯化时间可追溯到距今4 500年前[24]。然而,对出土的考古材料并未进行遗骸形态测量和种属鉴定,不确定早期发现的骆驼化石是经过驯化的双峰驼还是现存的野生双峰驼。
随着现代分子生物学技术与分子系统学理论的飞速发展,使人们可以直接在分子水平上追踪家养动物起源与进化历程,为人们探索动物的起源与驯化时间和地点提供了新途径。研究人员通过线粒体基因组的研究揭示了家、野双峰驼的分歧关系,其分化时间发生在70万年前[15]。与此同时,基于全基因组学的研究表明,家、野双峰驼分离时间发生在43万年前,晚于线粒体基因组研究的结果[25]。此外,在不同地理位置的家养双峰驼群体中,伊朗双峰驼群体具有最高的遗传多样性,且群体TreeMix分析显示伊朗双峰驼最先从家养双峰驼群体中分离出来,分歧时间大约在4 450年前,推测伊朗是家养双峰驼可能的驯化地区;随后,大约2 400年前,双峰驼向东路线到达蒙古高原,形成了表型特征各异的不同品种或类型[25]。双峰驼迁徙路线见图2。

图2 双峰驼迁徙路线[21]
4 双峰驼功能基因组研究进展
4.1 沙漠适应性基因的研究
经过长期的自然选择和人工驯化,双峰驼适应荒漠地区的严寒、酷热、干旱、多盐、缺草等恶劣自然条件,使其形成了独特的体貌特征和沙漠环境适应能力,如耐寒(戈壁沙漠地区冬季最低温度可达零下40 ℃以下)、耐热(夏季中午时气温可达37~42 ℃,沙面温度可达65~75 ℃)、耐脱水(脱水达到体重的30%,仍能维持自身的基础代谢)、耐高盐、体温调节能力(体温昼夜温差可达7 ℃)、独特的解毒能力等[26]。以上独特的生物学特性具有基因组学基础,使得双峰驼更能适应极端的沙漠环境[17,27-28]。
4.1.1 能量代谢相关功能基因的研究 能量的代谢和储存对于食物匮乏的沙漠地区的骆驼而言是至关重要的。Jirimutu等[17]在双峰驼基因组中共检测到了2 730个快速进化基因,主要富集在糖脂代谢、胰岛素信号通路和脂肪细胞因子信号通路中,推断以上快速进化基因与双峰驼能量储存和生产密切相关。通过功能注释发现,双峰驼基因组中与能量、葡萄糖和脂肪代谢类别(GO:0006200、GO:0016887、GO:0042626、GO:0006869)中的很多基因都进行了快速进化,进而增强了双峰驼脂肪储存和产生能力。与此同时,双峰驼体内与DNA损伤和修复(GO:0006974、GO:0003684、GO:0006302)、细胞凋亡(GO:0006917、GO:0043066)和蛋白质稳定性(GO:0050821)相关类别中的基因完成了快速进化,为双峰驼耐受严寒酷热的沙漠环境给予了基因组学方面的证据[2]。
4.1.2 水代谢相关功能基因的研究 双峰驼耐脱水能力与其适应干旱的沙漠环境是密不可分。水通道蛋白家族是选择性的水通道,在水的重吸收和代谢中起着重要作用。黄祖贤[29]研究发现,水通道蛋白AQP1和AQP2在双峰驼肾脏中均有高水平的表达,使得双峰驼肾小管管壁细胞的水通透性极大增强,进而加强了肾脏组织的水代谢能力。Wu等[2]研究发现,双峰驼肾皮质和肾髓质中水通道蛋白AQP1、AQP2和AQP3是表达差异最大的3个基因,这些基因可以使其在缺水的环境中更有效地吸收水分。王进宝[30]研究发现,双峰驼肾脏抗利尿激素V2型受体(V2R)可介导产生一系列的信号级联,最终导致双峰驼肾皮质和肾髓质集合管上皮细胞AQP2和AQP3的mRNA和蛋白质水平出现上调,从而加强了对原尿中水分的重吸收。
研究发现,禁水胁迫条件下的双峰驼肾脏组织通过下调ATP柠檬酸合酶和血红蛋白亚基β的基因表达来降低细胞呼吸和新陈代谢,同时上调聚结合蛋白2的基因表达来增强细胞的抗氧化能力,进而起到抗干旱的作用[31-32]。此外,对禁水胁迫条件下的双峰驼肾髓质组织中共检测到了17个差异显著的mRNA和26个microRNA(miRNA),并通过分析发现下调的ACLY和LOC105061856、上调的PCBP2和miR-195以及靶向的LOC105061856和PCBP2是双峰驼在禁水条件下水调节作用的重要功能基因[33]。
4.1.3 独特的细胞色素P450酶系 细胞色素P450酶(CYP)是一种氧化酶,其同工酶参与药物、致癌物、类固醇激素和脂肪酸的氧化代谢,其中与外源化合物(包括药物)相关的主要有CYP1A、2A、2B、2C、3A等[34],它们参与氧化、还原、水解等反应,对外源化合物有的起代谢解毒作用,有的则起代谢活化作用[35]。
戈壁荒漠中旱生盐生植物较多,且很多植物苦涩干硬、含有一定的毒性。一般家畜如牛、羊等尽量避开这些植物,一旦采食,轻则大病一场,重则不治而亡。而骆驼喜食这些植物,且不会产生不适应症状,这表征了骆驼另外一种沙漠适应能力,即耐盐、解毒能力。对双峰驼细胞色素P450基因家族注释分析发现,双峰驼具有63个拷贝数的CYP基因,分别被注释到了17个基因家族和38个亚基因家族中;参与到了18个代谢途径中,并在脂质代谢和外源物质的代谢过程中起到重要作用[36]。在参与代谢的P450基因中,CYP2E(2个拷贝)和CYP2J(11个拷贝)的拷贝数明显高于其它家畜,如牛和马[17,36]。CYP2E和CYP2J有助于将花生四烯酸转化为19(S)-羟基二十碳四烯酸,而此物质是肾脏肾小球血管的一种潜在血管扩张剂,可刺激水的再吸收,进而调节双峰驼体内的水盐平衡[37-38]。研究还发现,CYP2J2基因的表达受高盐饮食的调节,使得双峰驼摄入大量盐而不患高血压[39]。双峰驼具有6个拷贝的CYP3基因,都属于CYP3A亚科,其主要功能是中和有毒物质[40-41],并以尿液的方式从体内排出。因此,推测双峰驼体内的解毒能力与其含有更多拷贝数的CYP3基因有关。
4.1.4 骆驼嗜盐相关功能基因的研究 戈壁荒漠淡水资源缺乏,盐碱湖相对较多的自然环境促使骆驼形成了嗜盐的生理特性,且需盐量是其他家畜的6~8倍。研究发现,高盐诱导下双峰驼皮质细胞通过调控AVPR1A、SOS、SGK1、TGFB1、TLR2等基因,并激活钙离子、JAK-STAT和MARK信号通路,适应高盐的内环境[42]。同时,在盐胁迫条件下的双峰驼回肠和肝脏组织中筛选到的显著差异表达基因(MUC6、AQP5、PKP4、CDH11、TENM1、PLIN2、UPP2)可减少水分流失、抑制钠的过量输入、改善保护屏障和钠离子稳态以及维持尿苷含量,进而使得骆驼耐受高盐[43]。对盐胁迫条件下的骆驼肾髓质转录组分析中共发现了22个差异表达的mRNA、2个长链非编码RNA(lncRNA)和31个miRNA;进一步,使用荧光原位杂交和双荧光素酶报告基因分析,发现lncRNA LNC003834可以结合miRNA-34a,从而减轻盐吸收抑制SLC14A1基因的表达[44]。
4.2 骆驼高血糖调节基因研究
血糖水平高、胰岛素不敏感是骆驼的一个重要生理特性。正常状态下,骆驼的血糖水平(7.1±0.3 mmol/L)比其他反刍动物(2.5~3.5 mmol/L)高两倍,比单胃动物(3.5~5.0 mmol/L)高1~1.5倍[45]。而其血液胰岛素含量(5±1 μU/mL)相对于羊(12±2 μU/mL)和马(7±1 μU/mL)较低,且骆驼血液中葡萄糖含量下降也较羊和马慢[46]。然而,在高血糖低胰岛素情况下,骆驼不会出现不适或病变反应,说明其体内存在特殊的糖转运和代谢活力的功能基因。
骆驼全基因组的研究发现,一些明显的快速进化基因富集到了胰岛素信号通路和II型糖尿病代谢通路中,推测这些基因有助于维持骆驼体内高浓度的血糖水平[17]。在禁水条件下,骆驼肾髓质中参与糖酵解的基因、葡萄糖转运相关的功能蛋白等显著上调表达,说明骆驼体内通过以上蛋白/基因的表达来提高葡萄糖的转运效率[2]。在高糖诱导下的双峰驼肾皮质细胞中共发现了458个差异表达基因,其中上调的基因包括钙调素依赖性蛋白激酶IIβ(CAMK2β),aA-晶体蛋白(CRYAA)和泛酰巯基乙胺酶(VNN1);同时,激活了一些参与控制糖尿病和肾病的重要通路,如PI3K-Akt、AGE-RAGE、TGF-β、NF-kB等信号通路[42],为进一步了解双峰驼特殊的糖代谢途径,解释其在极端环境下极强生存能力的分子机制提供参考。
4.3 骆驼免疫基因的研究
骆驼科动物在进化过程中不仅形成了许多适应沙漠极端环境的生理特性,也形成了非常独特的免疫系统。众所周知,哺乳动物的常规IgG抗体都是由两条重链和两条轻链肽段组成的四聚体。但是在1993年,Hamers-Casterman等[47]在骆驼中发现了仅由两条重链组成的二聚体IgG抗体,为重链抗体(heavy-chain antibody)。虽然缺失轻链的抗体在人类的遗传病和小鼠的基因改造中也被获得过,但它们都丧失了抗原结合能力[48]。迄今为止,骆驼科是唯一被发现的可以产生具有生物活性的重链抗体的哺乳动物[49],在美洲驼(如羊驼)血清中的比例仅为10%~25%,而在单峰驼和双峰驼血清中的比例高达50%~80%[50],说明其在骆驼进化过程中受到了较强的自然选择。
对双峰驼抗体编码基因的研究表明,其具有17个重链可变区(VH)、7个多变区(DH)、6个连接区(JH)和10个固定区(CH)。骆驼抗体基因与编码常规抗体的基因有两个明显不同。首先,重链抗体的IGHV基因(称为IGHVH)在FR2区的四个位置发生了标志性的氨基酸替换,大多数替换方式为Val42Phe/Tyr、Gly49Glu、Leu50Arg/Cys和Trp52Gly/Leu[51]。其次,在恒定区基因中,编码重链抗体的IGHG2和IGHG3基因在CH1外显子处发生了剪切位点突变(GT->AT),导致与轻链相连的CH1区域缺失[52]。初步的试验研究表明,双峰驼血清中的IgG主要以重链抗体的形式存在[53],但是双峰驼分子数据的匮乏严重限制了其研究和开发。2012年,骆驼基因组草图首次得到了双峰驼IGHV-D-J-C的部分基因序列,但连续性较差[17]。随后,在连续性较好的基因组中揭示了双峰驼IGHV-D-J-C的完整结构[21]。与羊驼比较,双峰驼IGHD-J-C基因序列都非常保守,但在IGHV区域存在比较大的序列分化。
5 小 结
纵观人类历发展史,骆驼在运输、贸易、战争、农耕、文化交流等方面发挥了不可替代的作用,极大地促进了人类文明的交流与社会的进步。近年来,有关双峰驼品种分类、基因组的研究不断涌现,为保护濒危的野生群体、揭示家养品种种质特性和遗传资源保护具有重大意义。本文概括了世界主要的双峰驼品种特性与分布,介绍了骆驼全基因组特性、起源驯化历程,并从功能基因组层面挖掘双峰驼独特的生物学特性。下一步,深入探究双峰驼生产性能相关的基因(如产奶、产肉),并对筛选到的基因进行功能研究将是今后工作的重点,最终为明晰双峰驼的种群特性、提高生产性能奠定理论基础。
