缝隙增强拉曼探针:制备、光学属性和应用
2024-01-17邓斌格林俐叶坚
邓斌格,林俐,叶坚
(上海交通大学生物医学工程学院,上海 200030)
1 表面增强拉曼光谱和缝隙增强拉曼探针的介绍
1.1 表面增强拉曼光谱基本原理
拉曼光谱(又称为拉曼散射)是光与分子发生作用时产生的非弹性散射效应,其与分子的转动、振动模式紧密相关,具有高特异性,被称为分子的指纹光谱,可用于分子结构的分析和鉴定。然而,一般的拉曼散射信号很微弱,为了获得足够的信号,增强成了必不可少的手段。表面增强拉曼光谱(Surface-enhanced Raman spectroscopy, SERS)是指由于表面等离激元的激发以及表面化学效应使得吸附在贵金属纳米结构表面的分子的拉曼散射产生极大的增强效应,其最大增强因子可达1010-1011[1-4]。此外,拉曼光谱特有的指纹光谱使其具有超高的特异性,超窄的半宽峰有利于多指标检测和成像[1,2,5-7]。
1.2 传统表面增强拉曼探针与缝隙增强拉曼探针的结构
目前SERS技术的应用主要通过标记和非标记的方法来实现。非标记的方法是指利用贵金属纳米结构直接对目标分子的拉曼光谱实现增强,而标记的方法是指通过SERS探针来实现对目标分子信号的放大。SERS探针通常包括贵金属纳米颗粒、拉曼报告分子、保护层、修饰层等四个部分(见图1)[1]。贵金属纳米颗粒主要作为增强基底,通过电磁场增强机制或(和)化学增强对拉曼报告分子进行增强。拉曼报告分子是产生拉曼信号的来源,通常具有较大的拉曼截面,并通过自组装或静电作用吸附到纳米颗粒表面。保护层可以提高纳米探针的稳定性和生物相容性,常常由聚合物或二氧化硅等组成。修饰层主要通过修饰靶向分子(如核酸、抗体和适配体)使纳米探针能够以高特异性和亲和力与目标物(例如肿瘤细胞表面过度表达的标志物)结合。
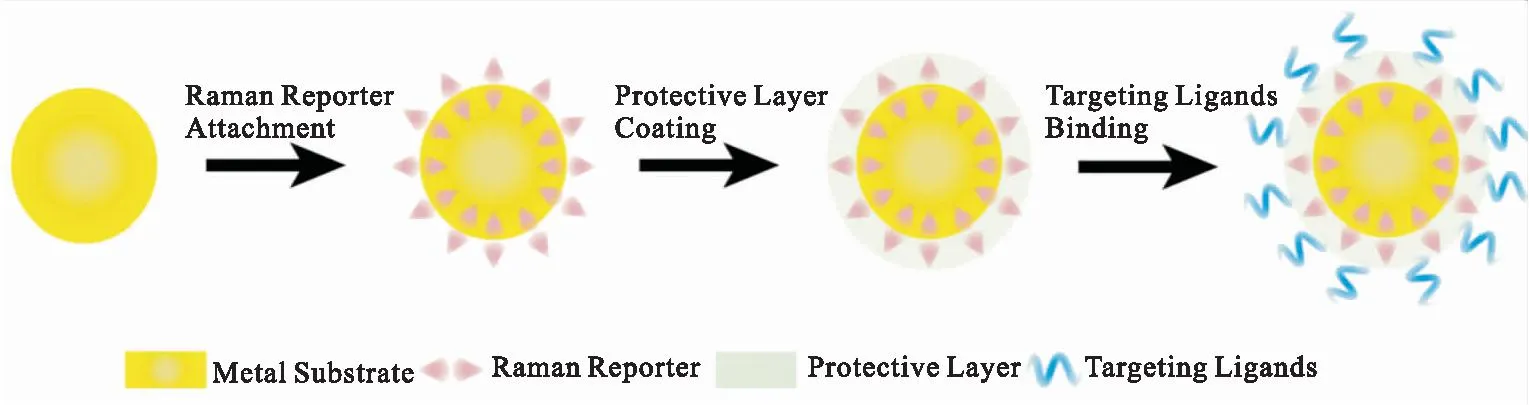
图1 SERS探针的制备过程[1]Fig.1 Illustration of SERS nanotag fabrication[1]
传统SERS探针主要是在贵金属基底的表面吸附报告分子,但可能会有增强因子不足、分子易解吸附、分子受溶液环境影响等缺陷。与传统SERS探针的结构不同,缝隙增强拉曼探针(Gap-enhanced Raman tags, GERTs)是一种具有内部纳米缝隙结构的核壳SERS探针(如图2所示)[8, 9],将拉曼报告分子包埋在金属核壳之间的缝隙中。GERTs在结构设计与调控、拉曼报告子、表面修改和功能化等多个方面表现出极大的灵活性,并展现出了多种独特的光学属性,包括极大的电磁场和拉曼增强、超高的光稳定性和材料稳定性。近年来GERTs作为一种性能优异的纳米探针,在信息安全[10-13]、体外检测[11,14-19]、活体检测和成像[6,8,20-26]、多功能诊疗[27-31]等领域得到了广泛的应用。本文主要介绍近年来本课题组针对GERTs的制备[19, 20]、光学属性[32, 33]以及在多个领域应用的研究进展。
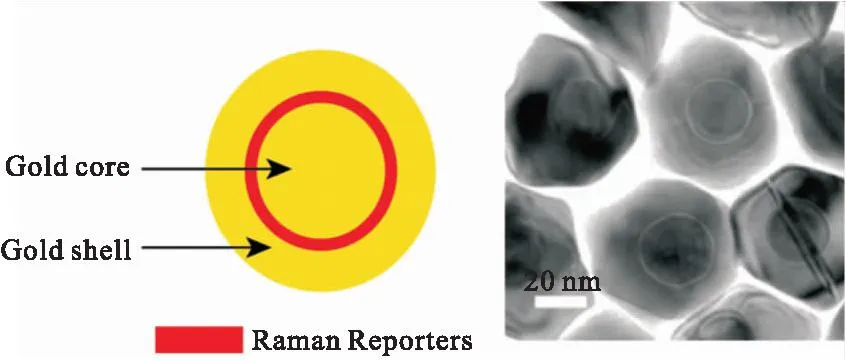
图2 缝隙增强拉曼探针的示意图及对应的透射电镜图。红色表示包埋在内部纳米间隙中的拉曼报告分子[8,9]Fig.2 Schematic structures and the corresponding representative TEM images of GERTs; Red part indicates Raman reporters in the internal nanogaps[8,9]
2 缝隙增强拉曼探针的制备
2.1 探针结构设计和调控
GERTs颗粒内部的嵌入式“热点”和拉曼信号分子极大提高了颗粒的SERS强度、重复性和稳定性,使其成为性能可靠的SERS探针。为了制备具有高灵敏度、特异性、稳定性的GERTs,需要精心设计其内部缝隙结构、选择合适的拉曼报告分子、基底材料及调控其颗粒形貌[1, 2]。
2.1.1缝隙大小及调控
GERTs内部“缝隙”的尺寸大小决定了金属核壳之间等离激元耦合的程度以及缝隙结构内的近场增强。文献已报道过多种制备内部超小缝隙结构的不同方法,可以分成两大类:一类是借助金银之间的置换反应获得中空的缝隙结构,即在生长金壳的同时刻蚀银内核而形成缝隙,但反应可控性较差,缝隙结构的均一性往往不高、很难稳定缩小到近亚纳米[34]。第二类方法,也是目前应用更广泛的方法,是首先制备金属内核,将特定的具有拉曼活性的分隔层包裹在金属内核上,形成薄的中间层,再进一步生长金外壳,在核壳之间形成缝隙结构。已报道的拉曼活性分隔层包括:表面修饰拉曼报告分子的薄二氧化硅层、修饰有荧光分子的特制核酸链、芳香环聚合物链、有机芳香族小分子等[35]。这些中间层同时具有拉曼信号,是整个颗粒的拉曼信号来源。
但是,采用薄二氧化硅层作为中间层材料,需额外修饰拉曼信号分子、制备工艺繁琐,硅层厚度不易控制、且很难缩小至亚纳米级别;而修饰有荧光分子的特制核酸链、芳香环聚合物链等中间层材料受限于成本或易得性,不容易开展大批量制备。与前三种材料相比,有机芳香族分子来源广泛、材料成本低,同时,具有巯基、氨基或羧基的有机小分子具有较好的金属亲和力,可以直接修饰在金属结构表面,合成简便。因此,我们课题组广泛研究了基于第三类拉曼报告分子(有机芳香族分子)的GERTs结构。
在此,我们以内嵌1,4-苯二硫醇(1,4-Benzenedithiol, 1,4-BDT)的GERTs为例,采用高分辨扫描电镜表征了其内部缝隙结构。研究发现内嵌的拉曼报告分子层是缝隙结构形成的关键因素,分子层的厚度直接决定了缝隙的宽度。这为调控并制备不同尺寸的缝隙结构提供了基础[32]。由于化学合成手段的限制,精确调控缝隙的尺寸是一个挑战。我们利用1,4-BDT具有两个巯基的特点,即1,4-BDT分子之间能够形成二硫键,当1,4-BDT与纳米金核的混合时间足够长时,分子可以在金核表面形成自组装多层结构。因此我们可以通过控制1,4-BDT分子和金核混合时长,从而获得不同厚度的表面分子层;再生长金壳后,即可获得具有不同缝隙尺寸的GERTs(如图3所示)。简言之,通过优化合成的缝隙尺寸参数,为制备具有更优拉曼性能的GERTs提供了策略[36]。

图3 GERTs缝隙大小的调控。(a)纳米金核表面修饰不同厚度 1,4-BDT 分子层的示意图。(b)纳米金核与50 μM 1,4-BDT分子混合不同时间制备的GERTs的电镜图片。图像标尺为20 nm[36]Fig.3 Research on the gap size of GERTs and its regulation method. (a) Schematic molecular packing structure on Au core surface with different packing densities and numbers of molecular layers. (b) TEM images of GERTs with different gap sizes prepared by incubation time from 0.5 to 96 h for Au cores and 50 μM 1,4-BDT. All scale bars are 20 nm[36]
2.1.2GERTs内嵌的拉曼报告分子
拉曼报告分子吸附于金属核壳结构之间,是GERTs探针信号的来源。拉曼报告分子通常具有足够大的散射截面,以保证强的拉曼信号;同时其特征峰简单可归属,从而最大程度避免与其他拉曼报告分子谱带的重叠。根据拉曼报告分子与金属的吸附方式可以分为共价吸附和静电吸附两种。通过共价吸附的分子通常具有巯基[13, 26],比如与金形成金-硫键牢固吸附在金属表面,而通过静电吸附的报告分子(如氨基、羧基等基团)通常是与金属核或者金属核的稳定剂具有异种电荷[25]。当拉曼报告分子的吸收波长与激发波长接近时,报告分子的信号能得到更大的增强,即表面增强共振拉曼效应,而这一类能与激光共振的拉曼报告分子称为共振拉曼报告分子[25]。尽管共振拉曼报告分子的引入能进一步提高GERTs的灵敏度,但是共振拉曼报告分子在与激光共振时通常会产生很强的荧光背景,从而影响生物检测和成像。为解决该问题,我们最近报道了一种新型的近红外二区无荧光共振拉曼报告分子,在最大化提升共振拉曼信号的同时,还可以避免荧光背景的干扰,从而更好地满足生物医学成像的应用[37]。
生物分子的拉曼信号错综复杂,且主要分布在指纹区(即200-1800 cm-1)内。如果使用信号位于指纹区的拉曼探针,其拉曼峰容易与生物分子拉曼峰重叠,从而会影响其精准定量检测与成像,因此指纹区的报告分子选择就受到了限制。与之相对的,1800-2800 cm-1波数段内,生物组织通常没有特征拉曼光谱信号,故该波数段被称为“生物静默区”。为了解决以上问题,如图4a所示,我们引入了生物静默区的拉曼报告分子构建了正交缝隙增强拉曼探针(Orthogonal GERTs, O-GERTs),与传统的SERS(Conventional SERS, C-SERS)探针相比,O-GERTs的报告分子通常具有炔基、氰基、叠氮基等基团的振动模式,在1800-2800 cm-1波数段具有特征拉曼峰。在肿瘤成像的过程中根据静默区分子的特征拉曼信号可以实现更为精准的检测,不受组织背景信号的干扰[22](图4b-d)。

图4 正交缝隙增强拉曼探针及其在肿瘤成像中的应用。(a)正交GERTs,传统GERTs以及肿瘤组织的拉曼光谱。(b)O-GERTs用于肿瘤成像的示意图。(c)基于O-GERTs生物静默区特征峰(2196 cm-1)的拉曼成像结果。(d)对应位置的代表拉曼光谱Fig.4 Orthogonal GERTs and its application in tumor imaging. (a) Schematic diagram of Raman spectra of O-GERTs, conventional SERS (C-SERS) tags and tumor tissue. (b) Schematic illustration of O-GERTs for tumor imaging. (c) Raman imaging based on the characteristic peak (2196 cm-1) in the silent region of O-GERTs. (d) Representative Raman spectra of the corresponding positions in panel c
2.1.3GERTs基底材料
SERS增强效应依赖于SERS活性基底为报告分子提供电磁场的“热点”,使吸附在表面的分子信号得到数量级的增强,而基底的材质和光学性能决定了其增强能力。常见的SERS活性基底通常包括贵金属、半导体纳米材料以及两者的结合。由于贵金属在可见光-近红外区域内强烈的等离激元共振效应以及该波段内激光器的高适配性,使得其成为基础研究和实际应用中最为常见的增强基底材料。比如,金具有突出的化学稳定性、生物安全性以及可调控的等离激元共振光学性质,因此是生物医学检测和成像的首选SERS活性基底。银具有更好的SERS增强能力和更低的成本,也使得其成为SERS领域优异的候选材料。
随着对等离激元金属材料研究的深入,越来越多的课题组致力于调控多金属纳米微观构型的组分和结构,从而最大程度上发挥不同金属间的协同耦合,实现SERS增强性能的最大化。由金和银组成的复合纳米增强基底是最为常见的活性基底,其结合了金突出的稳定性和银优越的SERS活性。我们曾报道了新型的金银复合GERTs(Au-Ag GERTs),将花瓣状金纳米颗粒作为内核,为拉曼报告分子提供更多的“热点”,包裹银外壳,进一步提高探针的灵敏度。该Au-Ag GERTs比Au-Au GERTs的亮度提高1-2个数量级以上,溶胶的检测限低至10 fM,甚至可达到单颗粒检测水平[21, 25]。
(3)有一部分副词具有关联性作用,有的可以独用,有可以合用,有的二者都可以,有的还可以和连词配合使用。
2.1.4GERTs探针形貌的调控
由于不同形貌的贵金属纳米结构呈现出不同的SERS增强能力,因此合理设计贵金属的形貌可以有效优化其SERS性能。除了常见的纳米球和纳米棒外[38],越来越多的研究者致力于开发不同形貌的SERS基底,以最优化SERS增强性能,如纳米星、纳米笼、纳米花、纳米线等[39, 40]。通过在纳米颗粒表面稳定构建尖锐的点、峰亦或者内部缝隙,能够产生更多的“热点”,从而实现拉曼信号数量级的增加。因此,调控设计等离激元贵金属的形貌对于获得高活性的SERS 基底具有十分重要的意义。如图5(a-c)所示,我们课题组常年来致力于开发不同内核形貌的超高增强性能GERTs,包括基于纳米笼、纳米棒以及纳米三角片的GERTs等。相较于传统形貌的GERTs探针而言,得益于花瓣状的多枝化结构(图5 d和e),为拉曼报告分子提供了更多的“热点”。花瓣之间的缝隙结构(图5 f),为报告分子带来了更大更稳定的电磁场增强效果,无论是模拟计算还是拉曼光谱检测,都证明了花瓣状GERTs具有更高的灵敏度[8]。

图5 不同内核形状的GERTs[8]:(a)纳米笼。比例尺为 50 nm。(b)纳米棒。比例尺为50 nm。(c)纳米三角片。比例尺为20 nm。(d)花瓣状外壳GERTs的示意图。(e)花瓣状GERTs的低分辨率TEM图像。比例尺为50 nm。(f)花瓣状GERTs的高分辨率TEM图像。比例尺为10 nm。图c中的红色和黄色箭头分别表示花瓣状GERTs内核与外壳之间的内部缝隙以及外壳上花瓣状结构之间的外部纳米间隙Fig.5 GERTs from metallic cores with different shapes[8]:(a) nanocage (scale bar is 50 nm), (b) nanorods (scale bar is 50 nm), and (c) nanotriangular sheets (scale bar is 20 nm). (d) Schematic diagrams of GERTs with a petal-like shell (P-GERTs). (e) Representative low-resolution TEM image of Petal-GERTs. (f) The high-resolution TEM images of Petal-GERTs. The red and yellow arrows in panel c indicate the internal gap between the core and shell of Petal-GERTs and the external nanogap between the petal-like structures on the shell, respectively
2.2 探针的修饰及功能化
为了提高SERS探针的稳定性和生物相容性,通常会对其进行表面修饰。同时,表面涂层也可以缓解存在大量蛋白质的生物环境中SERS探针被蛋白质包覆而形成蛋白冠的问题。当前,常见SERS探针的保护层有二氧化硅和聚合物等。在生物医学应用中,为了实现SERS探针与待测目标物的特异性识别,通常根据表面受体或蛋白的表达水平选择对应的特异性抗体、短肽等对SERS探针进行功能化,从而实现精准靶向。如图6所示,我们首先在GERTs外修饰了介孔二氧化硅层,来提高探针的稳定性和生物安全性。在进行氨基化以及钆(Gd)负载后,进一步连接叶酸(FA)小分子和依鲁替尼(Ibrutinib)分别来实现肿瘤细胞的靶向和治疗。最终基于功能化的GERTs实现了肿瘤的CT/MR/SERS多模态成像和诊疗一体化。此外,体内生物分布和长期毒性研究表明,Gd-GERT具有良好的生物相容性和生物安全性。因此,Gd-GERT作为一种多功能纳米平台,在术前精确的CT/MRI诊断和术中拉曼成像指导癌症切除方面具有巨大的潜力[27]。

图6 FA-Gd-GERTs@Ibrutinib的合成过程和多模态成像[27]。基于化学/光热疗法的肿瘤物理屏障破坏和微环境重建,以实现肿瘤中CAR-T浸润增强Fig.6 The synthesis process of FA-Gd-GERTs@Ibrutinib and schematic illustrations of multi-modal imaging and the chemo/photothermal-therapy-based destruction of physical tumor barriers and the reconstruction of the microenvironment to achieve enhanced CAR-T infiltration in tumors[27]
3 缝隙增强拉曼探针的光学属性
3.1 远场和近场光学属性
根据经典电磁理论,极窄的金属缝隙结构可以使金属核与金属外壳产生强的等离激元耦合作用,因此在缝隙中产生很高的电磁场增强效应。然而,金属间的缝隙不能无限变窄,已有研究发现,当缝隙结构宽度减至亚纳米级别时,一些量子效应(比如电子隧穿效应)可能产生显著影响,它会以与经典理论完全不同的方式改变金属纳米缝隙结构的光学特性,影响该结构的远场和近场光学响应,导致电场增强被削弱,但又可能带来额外的化学增强效应。含时密度泛函理论(Time-dependent density functional theory, TDDFT)证明,对于核壳缝隙宽度低于0.4 nm的核壳金属颗粒,纳米间隙结构内会发生明显的隧穿效应,并显著改变核壳颗粒的吸收截面和局部电场增强[36]。
因此我们专门探究了GERTs内部缝隙结构尺寸与其光学特性之间的关系。通过量子校正模型(quantum-corrected model,QCM)模拟计算的消光光谱与实验测定的吸收光谱非常吻合,而传统电磁理论模型计算结果与实验结果不符合,可能意味着GERTs内部同样存在电子隧穿效应的影响。我们通过控制报告分子1,4-BDT在纳米金核上的吸附行为,精确调控了GERTs的缝隙结构宽度,以进一步研究GERT的远场和近场光学性质。远场光谱中共振峰的变宽和SERS光谱都证明了GERTs缝隙结构中存在电子传输现象,并影响了颗粒的近场光学响应,表现为SERS信号强度发生变化。我们研究表明SERS最强时的缝隙宽度值为约1.4 nm(785 nm激发时)或1.8 nm(633 nm激发时)。该研究结果在一定程度上颠覆了传统认知——即认为在金属颗粒表面吸附尽可能多的拉曼分子、或缩小等离激元结构中的间隙一定可提高SERS性能。同时,该研究还证实GERT可以用来研究纳米分子层间隙引起的电荷传输、及其对增强拉曼信号的影响,使得研究者能够以SERS测试为手段,研究金核-纳米缝隙(1,4-BDT分子层)-金壳GERTs的近场光学特性的变化,证实颗粒的拉曼增强信号的最高值受限于缝隙结构内的电子传输效应。
3.2 单颗粒检测灵敏度
GERTs探针在高精度检测和超灵敏生物医学成像领域具有很大的前景。基于前期对GERTs内部缝隙大小、拉曼报告分子、基底材料、探针形貌等参数的调控和优化,可实现SERS性能的最大化,目前已能达到单颗粒的检测灵敏度。我们前期使用显微拉曼结合原子力显微镜或扫描电子显微镜进一步研究了GERTs在固态下的单颗粒SERS特性。如图7所示,在通过原子力显微镜(图7 a-b)或者扫描电子显微镜(图7 d-e)确定单个GERT颗粒后,进行拉曼光谱采集,均能检测到信噪比极好的特征拉曼光谱(图7 c和f),证明了GERTs的单颗粒检测能力[8, 25]。
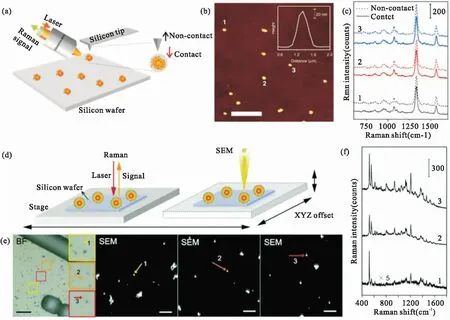
图7 GERTs单颗粒检测[8, 25] (a)原子力显微镜结合拉曼光谱仪进行GERTs的单颗粒检测示意图。(b)硅片上GERTs的原子力显微成像。标尺为5 μm。插图显示了单个GERT的横截面轮廓。(c)图b中三个GERT(颗粒1、2和3)在接触和非接触模式下的SERS光谱。所有光谱测量采用633 nm激光,110 μW功率,10 s采集时间,×100物镜。(d)拉曼成像和扫描电镜进行GERTs的单颗粒检测示意图。(e)硅片上GERTs的明场图像和三个GERT相应的扫描电镜图(SEM,如箭头表示)。BF图像比例尺为20 μm,SEM图像比例尺为1 μm。(f)图e中三个GERT(颗粒1、2和3)的SERS光谱。拉曼光谱测量采用785 nm激光,1 mW功率,20 s采集时间,×100物镜Fig.7 Single-nanoparticle Raman analysis of GERTs. (a) Schematic illustration of AFM-correlated Raman spectroscopy[8, 25]. (b) A representative AFM image of GERTs on silicon wafer. The scale bar is 5 μm. The inset shows a typical cross-section profile of a single GERT. (c) SERS spectra of three single GERT (particle 1, 2, and 3) indicated in panel b measured in contact and non-contact modes. All measurements were performed with a 633 nm laser, 110 μW power, 10 s acquisition time, and ×100 objective lens. (d) Schematic illustration of the Raman imaging and scanning electron microscopy (RISE) system. (e) A representative bright-field (BF) image of GERTs on a silicon wafer and the corresponding scanning electron microscopy (SEM) images of three selected single GERT (indicated by arrows). Scale bars are 20 μm for the BF image and 1 μm for SEM images. (f) SERS spectra of three single GERT (particle 1, 2 and 3) indicated in panel (e). Raman measurements were performed using a 785 nm laser, 1 mW power, 20 s acquisition time, and ×100 objective lens
3.3 稳定性
SERS探针的稳定性包括其在各种环境中的材料稳定性以及在光连续激发的情况下仍保持较好拉曼信号的光学稳定性。GERTs的拉曼报告子由于位于金属颗粒内部,金属外壳有效地将拉曼报告分子与外界的水分、空气和环境隔绝,避免了可能发生的光化学反应,这将极大地提升探针的材料稳定性,所以GERTs特别适合应用于各种生物环境中的检测和成像[9]。
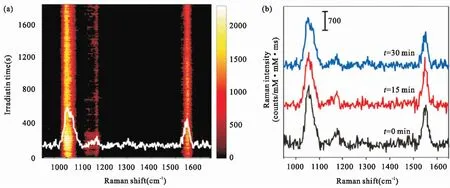
图8 GERTs的光稳定性测试[9]。(a)硅片上固态GERTs以4.71×105 W/cm2激光连续照射30 min的时间分辨光谱。(b)不同时间点的代表性SERS光谱Fig.8 Photostability of GERTs[9]. (a) Photostability measurement of time-resolved SERS spectra of solid GERTs on a silicon wafer during continuous irradiation for 30 min at a power density of 4.71×105 W/cm2. (b) Three representative SERS spectra at selected irradiation times in panel a
4 缝隙增强拉曼探针的应用
4.1 光学信息安全
防伪标签是目前解决假冒商品最经济和有效的方案之一,其安全性取决于目前制备工艺的技术壁垒和控制获取加工材料的有限途径,缺乏严格意义上的安全性。基于物理不可克隆函数(physical unclonable functions, PUF)的防伪标签由于其固有的随机性、易于生成却难以复制等优点,是目前防伪领域的研究热点。GERTs由于具有超强的拉曼信号、较窄拉曼半峰宽带来的超大编码能力以及探针的超稳定性,特别适用于PUF标签。最近我们课题组制备了一种基于GERTs的PUF标签(如图9a),该标签通过简单地直接滴加GERTs溶液到基底上来制备,由于纳米颗粒在基底上的随机分布及产生的随机图案使得无法通过任何手段伪造。使用共焦拉曼系统进行高速读取,将每个像素上的拉曼信号进行数字化,实现了基于探针空间位置、探针种类、探针拉曼强度的超高编码容量。由10种不同类型的GERTs组成的PUF标签,采用2500像素的扫描分辨率,每个像素的拉曼强度水平为四进制编码,可以实现超过3 × 1015051的三维编码容量(图9b)。验证实验保证了PUF系统的鲁棒性和安全性,并证明了其实用可行性[13]。通过引入在1800-2800 cm-1波段具有特征拉曼信号的正交报告分子构建正交拉曼探针(orthogonal GERTs,O-GERT),将O-GERT随机分布到聚合物中,可形成基于探针频率、强度和三维空间等共五维信息的超大编码容量(~105852)和超高信息密度(~105844Tbit cm-3)的PUF编码。聚合物基体可以为标签提供很好的机械保护,同时又不会干扰其静默区的拉曼信号编码。我们进一步结合微流控滑动芯片技术可以快速(约10分钟)和高通量(每次可生产数万个)地大规模生产这些标签,并结合微图案化与二维QR码进行集成,提供多层信息防伪[10, 11]。
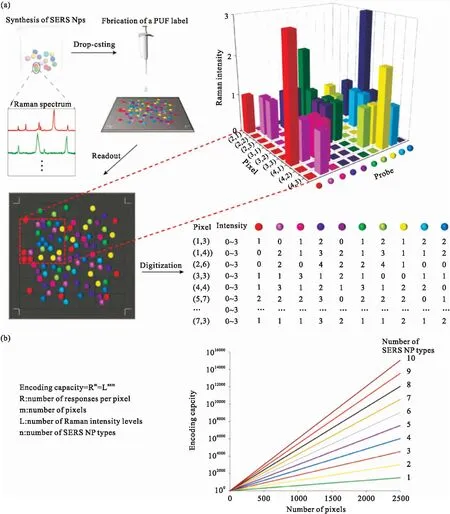
图9 基于GERTs的物理不可克隆(physical unclonable functions, PUF)防伪标签[13]。(a)基于拉曼信号的物理不可克隆函数标签制备过程包括:制备含有不同报告分子的GERTs探针,不同种GERTs随机形成二维(2D)图案,以及PUF标签的读出。(b)基于GERTs探针的PUF标签编码容量。10种GERTs探针可以实现410×2500 (3.2×1015051)的编码容量Fig.9 Physical unclonable functions (PUF) anti-counterfeiting labels based on GERTs[13]. (a) The preparation process of PUF labels based on Raman signals includes: synthesis of GERTs probes containing different Raman reporters, random formation of two-dimensional (2D) patterns by different kinds of GERTs, and readout of PUF tags. (b) Calculation of the encoding capacity of a Raman PUF label. The encoding capacity of 10 different GERTs will be 410×2500 (3.2×1015051)
隐写术是另一种提供信息传输安全的方法。它是指将要传输的信息隐藏在另一媒介(视频、音频、图像、文本等)中。隐写术隐藏了信息的存在,故不会引起别人的怀疑,保证了信息的安全。我们曾报道开发了一种基于GERTs的拉曼墨水用于隐写术。通过将两种不同的GERTs掺入普通墨水,得到两种具有不同拉曼信号的拉曼墨水用于多色隐写[6]。在785 nm非共振激发下,GERTs墨水能够产生显著的特征拉曼信号,同时墨水的背景干扰很低,证明其用于信息编码的优越性。不同的拉曼墨水能够同时用一种波长激发,有效缩短了成像时间。同时,GERTs墨水具有好的光稳定性和长期稳定性,保证了书写文本的长效性。实验中用两种制得的GERTs墨水和普通墨水进行多色隐写,总共能提取出七种不同的信息组合。拉曼墨水出色的多指标编码能力保证了隐写系统的安全性和可靠性,因而在信息安全领域具有广阔的应用前景。
4.2 体外检测
胆固醇是人体许多过程的重要分子,通过监测细胞内胆固醇水平,可以在早期发现许多疾病,如高血压、冠心病、动脉粥样硬化和脂质代谢功能障碍。如图10a所示,我们设计了内嵌有标准拉曼内标分子1,4-BDT的金银核壳GERTs,用于H2O2和胆固醇的无损检测。经典的最小二乘(Classic Least Square, CLS)光谱拟合方法使我们能够从复用的光谱中准确地提取内标物(1,4-BDT)和目标分子4-巯基苯硼酸(4-MPBA)和4-羟基苯硫酚(4-HBT)的拉曼信号。嵌入的内标分子可用于校准获得的拉曼信号,消除由不同的测量条件和纳米颗粒的局部状态(如聚集)引起的波动。因此,SERS信号的再现性得到了极大地改善,并且在检测的工作曲线中得到了更好的线性关系。进一步使用这些GERTs,我们在单细胞水平上对溶液和活细胞内的H2O2和胆固醇实现了定量检测[14]。
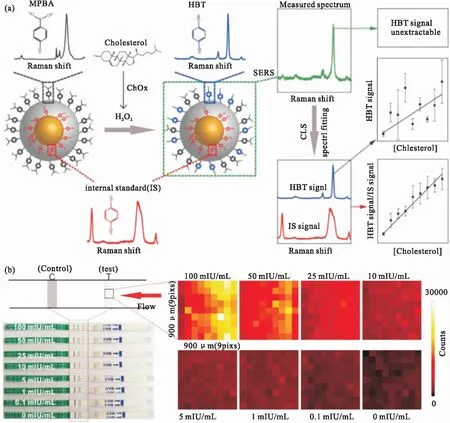
图10 基于GERTs纳米探针的体外检测。(a)胆固醇的定量检测[14]。(b)与侧流免疫分析结合实现人绒毛膜促性腺激素的定量检测[41]Fig.10 In vitro detection based on GERTs. (a) Schematic illustration of SERS nanoprobes with the embedded internal standard for quantitative detection of cholesterol via the Raman spectral fitting method[14]. (b) Quantitative detection of human chorionic gonadotropin combined with lateral flow immunoassay[41]
得益于GERTs核壳结构的特质,内部拉曼报告分子具有良好的光稳定性和信号重复性,即使在团聚状态下也可以保持线性的信号响应,非常适合定量和高灵敏的体外检测。因此,我们将GERTs进行抗原抗体修饰后,用于侧流免疫分析(Lateral Flow Immunoassay, LFIA)(见图10b),测定人绒毛膜促性腺激素实验室样本的检测极限低至0.7 mIU/mL(0.077 ng/mL)[41],远高于传统肉眼检测、非定量试纸的检测限(通常为10 mIU/mL以上)。
4.3 体内检测和成像
前哨淋巴结活检作为研究恶性肿瘤淋巴转移的方法,在临床应用广泛。术中准确定位前哨淋巴结(SLN)是前哨淋巴结活检的重要前提,因此,合适的SLN示踪剂尤为重要。目前临床常用的SLN示踪剂是蓝色染料(如亚甲蓝)、放射性同位素、近红外荧光染料(如吲哚菁绿)。但是,蓝染法和荧光染料法所使用的小分子染料的主要问题是,由于小分子染料示踪剂在淋巴管中扩散速度快,很快从SLN迁移到二站淋巴结(2ndLN),手术窗口很短,且容易引起误判和过多切除。
我们曾报道将GERTs作为新型示踪剂用于SLN的术中定位和成像。得益于GERTs合适的粒径,它在SLN内能够停留较长时间(数小时),为医生提供足够的手术时间窗口。利用小鼠及新西兰兔模型对GERTs作为SLN示踪剂的可行性进行了验证。在小鼠模型前哨淋巴结的结果表明GERTs能够在SLN停留24小时以上[26]。在新西兰兔模型上我们开展了更详细的研究(如图11所示),表明GERTs能够在10分钟内到达SLN,4小时内在2ndLN以多种方式(拉曼成像法以及原子吸收光谱法)均没有探针信号的检出,这为外科医生提供长时间窗口来区分SLN和二站淋巴结。此外,超高灵敏度的GERTs(检测极限为0.5 pM)使得在术前能够检测到标记的SLN,从而为微创手术提供位置信息。我们已根据食品和药物管理局(CFDA)和国际标准组织(ISO)对于纳米材料的生物安全性要求,对GERTs进行了详尽的生物安全性评估。评估结果表明,各项指标均显示GERTs无显著毒性。这为GERTs的临床应用转化提供了有利的机遇,使其可用于准确识别乳腺癌患者腋窝部位的SLN[23, 26]。

图11 基于GERTs的术中SLN准确定位和微创手术[23]。GERTs在术前乳头皮下注射,按摩后迁移到SLN。通过手持式拉曼探针,可以在10分钟内可以根据GERTs的独特拉曼信号定位SLN,同时4 h内未在二站淋巴结检测到信号,从而为手术提供了合适的时间窗口,避免了不必要的淋巴结清扫Fig.11 Schematic illustration of SLNs detection using Raman nanotags of GERTs[23]. GERTs are injected subcutaneously before the surgery and migrate to SLNs after a gentle massage. SLNs can be in vivo identified from the unique Raman signal of GERTs within 10 min by a hand-held Raman probe. GERTs only reach the 2nd LNs after 4 h, which provides a suitable time window for surgery and avoids excessive resection of the LNs
基于对SLN定位的精确性,我们进一步提出了“双探针比值法”。该方法运用了两种GERTs:即具有叶酸功能的靶向和非靶向GERTs。当两种探针到达前哨淋巴结后,前者可以特异性靶向淋巴结中的肿瘤细胞,而后者只是被动停留在淋巴结内或被该处的巨噬细胞吞噬,因此两者在淋巴结中的含量可能不同。我们将两种探针注射到动物模型,对SLN进行拉曼成像扫描,结合经典最小二乘数据处理方法,实现了在手术中判断SLN是否发生转移的诊断。这一方法在SLN转移的诊断方面可能优于目前的组织病理学评估方法,并且有望在未来指导外科手术的决策[28]。
4.4 多功能成像和治疗
晚期卵巢癌患者通常会出现腹部粟粒性播散和转移。目前,细胞减灭术(CRS)结合温热腹腔化疗(HIPEC)是治疗晚期卵巢癌的标准方法。然而,由于手术难以完全切除微小肿瘤,大多数患者的CRS效果并不理想。虽然HIPEC可以改善预后,但其治疗效果缺乏针对性,可能导致健康器官损伤和并发症。因此,亟需新的多功能(multi-functional)策略来精确检测和无副作用地根除播散性微肿瘤。我们曾报道开发了顺铂负载的GERTs,专门用于术中检测和根除难以切除的播散性晚期卵巢肿瘤(图12)[31]。GERTs具有独特且高灵敏度的拉曼信号、良好的生物相容性、优越的等离子体光热转换性能以及药物负载能力。这使得它们可以高效检测到直径为1毫米的微肿瘤进而通过化学光热协同的方式特异性杀灭肿瘤细胞,以达到最小副作用,并显著延长小鼠的生存期。结果表明,GERTs引导的化学光热协同治疗可以有效控制小鼠播散性肿瘤的扩散,有望成为治疗晚期卵巢癌的安全有效方法,提升患者的生存率和生活质量[31]。此外,基于相同策略,GERTs探针同样实现了前列腺癌残余微肿瘤的检测和根除[30]。因此,GERTs引导的手术不仅有效预防了癌症的局部复发,而且实现了残余微肿瘤的精确检测和去除,扩展了GERTs探针在治疗性精确医学领域的应用前景。

图12 基于负载顺铂的GERTs对腹部播散性微肿瘤进行拉曼检测和化疗-光热协同治疗。肠道上的肿瘤代表晚期播散性卵巢微小肿瘤[31]Fig.12 Raman-guided detection and chemo-photothermal synergistic therapy of abdominal disseminated microtumors with cisplatin-loaded gap-enhanced Raman tags (C-GERTs). The tumors on the intestine represent advanced disseminated ovarian microtumors[31]
5 总结与展望
本文综述了近年来我们课题组有关GERTs探针的制备方法以及其在信息安全和生物医学领域的最新研究进展。GERTs作为一种具备高灵敏度和广泛应用前景的纳米材料,在近年来引起了广泛的研究兴趣。其出色的性能不仅得益于高性能的拉曼增强效应,还源于其优越的物理化学稳定性,这为GERTs在多个领域中的应用提供了坚实的基础。在GERTs制备方面,我们已经开发出多种方法来合成高质量的GERTs,这些方法不仅能够有效地控制GERTs的形貌和结构,还能够实现大规模产业化生产。这为实际应用提供了可行性,同时也为进一步的研究和优化提供了平台。
尽管GERTs在众多领域中取得了显著的应用,然而仍然存在一些亟待解决的问题。这些问题主要体现在以下几个方面,需要进一步的深入研究和探索:(1)GERTs在生物医学领域具有巨大的潜力,但其在实际应用中还需要考虑其生物相容性和毒性等问题。我们需要收集更多的数据和进行系统性的研究,以评估GERTs在生物体内的长期影响和安全性,从而确保其在生物医学领域的可靠应用。此外,针对探针与生物体相互作用的机制,还需要进行更深入的在分子水平的研究,以揭示其在生物环境中的行为和效应。(2)作为一种光谱技术,生物组织的穿透能力是制约其真正临床应用的另一个关键问题。光在生物组织中的吸收和散射会降低信号强度,从而限制了成像深度和分辨率。因此,研究者们需要探索新的成像方法和技术,以克服这一限制,如将GERTs与深穿透拉曼技术结合,从而实现更深层次的检测和成像。(3)组织对于近红外二区的光子的吸收和散射效应进一步减弱,这为将GERTs应用推向近红外二区提供了契机。这不仅能提高成像的安全性,降低对生物体的损伤,同时还有望提高成像的分辨率和信号强度,从而更好地满足临床和研究的需求。随着不断的深入研究和技术发展,新型、稳定、高亮度的GERTs有望成为一种重要的纳米材料,为实际应用和科学研究提供更为广阔的可能性。通过不断的创新和合作,我们相信GERTs将来可以克服以上的挑战,进一步推动相关领域的发展和进步。
