血管网光声成像的机器学习抗散射仿真研究
2024-01-17廖江南高雅徐文逸解维娅程茜
廖江南,高雅,徐文逸,解维娅,程茜
(同济大学物理科学与工程学院声学研究所,上海 200092)
0 引言
乳腺癌已成为全球女性发病率最高的肿瘤疾病,乳腺癌的微血管成像对乳腺癌的治疗方案和预后有重要意义。乳腺癌的发生往往伴随着血管的病变,如病理组织周围血管在形态和数目上的变化,如果能通过检测血管变化实现对疾病的早期检测,对乳腺癌的在体诊断和治疗具有重要意义。
生物医学光声是近年来发展起来的一种无创的新型医学检测技术。激光脉冲照射到生物组织中时,组织中的生物分子产生基于热弹效应的超声波,我们称该超声信号为光声信号[1]。它结合了高对比度光学成像和高分辨率超声成像在深层生物组织中的优势[2],由于血液中的血红蛋白与周围组织间的高光吸收对比度[3],血红蛋白在血管网的光声成像中可作为良好的光声源,目前,光声层析成像术(Photoacoustic Tomography,PAT)已广泛用于血管检测[4-6]。Wang 等首次将光声断层扫描技术应用于小鼠脑成像,成功地获得了小鼠脑血管的结构图像[5]。Treeby等利用吸收补偿算法实现了小鼠腹部血管网的重建[6]。黄靖等把纳米探针和光声成像结合起来,实现了小鼠在体的肿瘤靶向光声成像[7]。殷杰提出了一种在随机散射介质中的格林函数重构方法,并与时间反转相结合,实现了声波的动态聚焦和单换能器的光声成像,改善了散射介质中的光声成像效果[8]。
最近,深度学习的兴起为提高光声成像质量提供了新的方法。深度学习首先在解决光学成像[9]和超声成像[10]中的散射问题方面有许多突破,证明了神经网络能够在高质量数据的基础上自主挖掘并利用数据中隐藏的物理规律统计不变性。在光声成像中,由于脉冲光声信号的超宽带特性,其面临的散射问题比传统窄带超声成像和光学成像更为复杂。目前已有少量利用深度学习解决光声散射问题的研究。Gao等利用改进后的U-Net网络实现了模拟经颅脑血管的高质量光声重建图像成功克服了颅骨对光声波的强散射,与传统光声成像方法相比具有更好的性能和更清晰的成像结果,也证明了神经网络可以解决光声成像中的声散射问题[11]。
本文基于用于血管分割的数字图像(Digital Retinal Images for Vessel Extraction,DRIVE)的数据集以及可调参数的颗粒散射层,在k-wave 中建立了不同颗粒散射条件下的微血管网光声成像仿真模型,并计算获得光声散斑图像数据集;为了提升抗散射网络的鲁棒性和迁移能力,使之广泛应用不同患者和乳腺癌不同分期,设置了多组具有不同散射颗粒密度和层数的散射层;根据光声的宽带特征,采用逐层带有归一化模块的U 型卷积神经网络(Unet)来学习提取血管网络光声散斑图像中隐藏的有效光声信息,并重建出高质量的血管网光声图像。上述基于深度学习网络的光声图像抗散射重建研究验证了从散斑中重建高清光声微血管网的可行性。
1 光声信号的数值模拟仿真与分析
1.1 血管网散射模型
本文使用了DRIVE 数据集,将数据集中的图片进行分割处理后作为光声源进行散射影响下的血管网光声图像重建及抗散射研究。该数据集共包含40张视网膜血管图像。使用滑动窗口对每个图像进行分割,最终得到4 000张血管长度、直径、弯曲度、分支模式和角度各不相同的血管网图像数据集。将处理后得到的4 000张血管分割图像作为本研究的光声源,血管直径分布在150~900 µm之间。代表性样品血管网分割图像示例如图1所示。
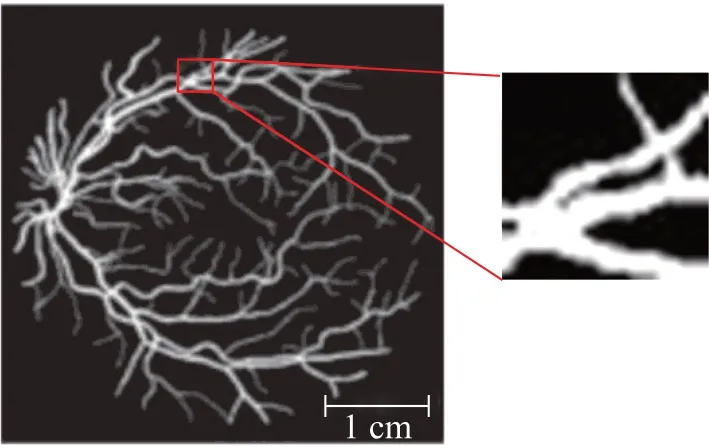
图1 血管网分割图像示例Fig.1 The sample of segmented vascular network
不失一般性,在每个图像外围设置了由散射颗粒围成的环形散射层。为了研究肿瘤组织内部的异质微结构及钙化点的疏密对光声信号散射的影响,以及提升深度学习网络的鲁棒性和迁移能力,本文通过改变散射颗粒的层数和密度,设计了6种不同的散射层模型,如图2所示。图2中白色圆点代表散射体,中心的白色血管状图案为二值化后的血管网分割图像,黑色部分代表耦合介质(水),颗粒直径取900 μm,即颗粒/血管直径比保持在1~6。
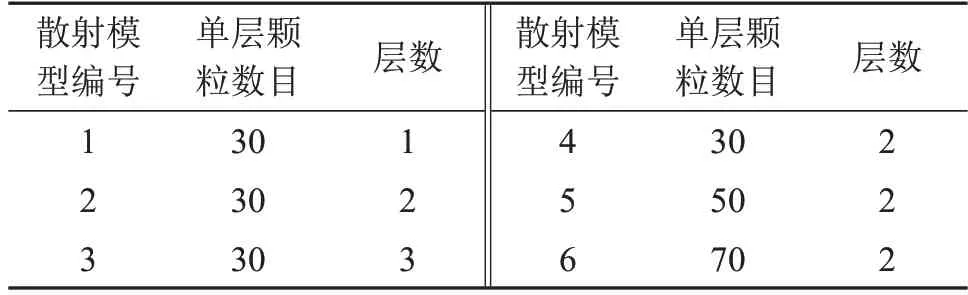
表1 不同散射模型参数设置Table 1 Parameter settings of different scattering models
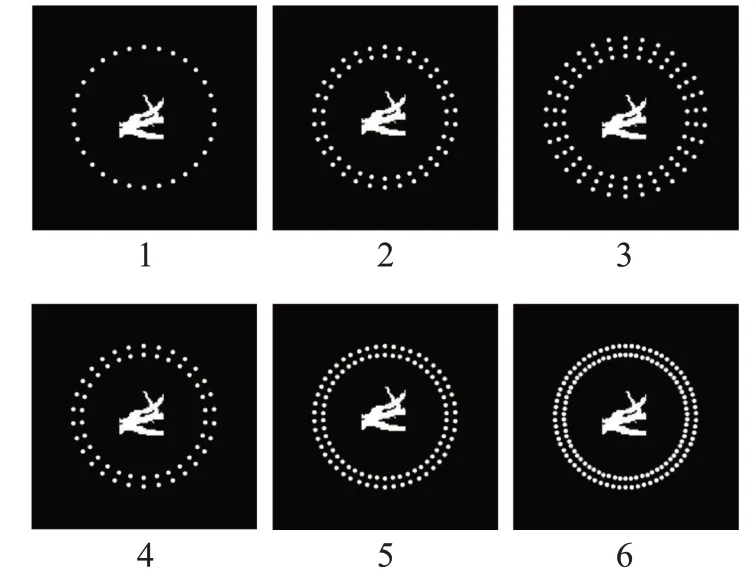
图2 6种不同散射层模型Fig.2 Six different scattering models set in this study
1.2 光声信号的模拟
在本研究中的光声信号重建过程中,声散射对图像质量的影响远远大于光散射。因为在图像重建的过程中,直接为图像重建提供信息的是散射后光声信号的振幅与相位信息;其中,振幅由血红蛋白吸收光能决定,受散射影响较小;而本研究中的散射颗粒尺寸与光声波的波长相近,其相位会受到较大影响。因此,本文不考虑光散射,而是聚焦于声散射。
本文将二值化处理后的分割血管图像作为模拟光声源,并布置相同大小的圆形颗粒环绕在其周围作为模拟散射层。使用Matlab(R2021b)软件的kwave 工具包模拟血管网光声信号在散射介质中的传播。通过周向均布的水听器间隔5°接收经散射介质传播的光声信号。血管网的模拟光声信号传播如图3所示。最后利用延时求和算法对检测到的光声信号进行图像重建。
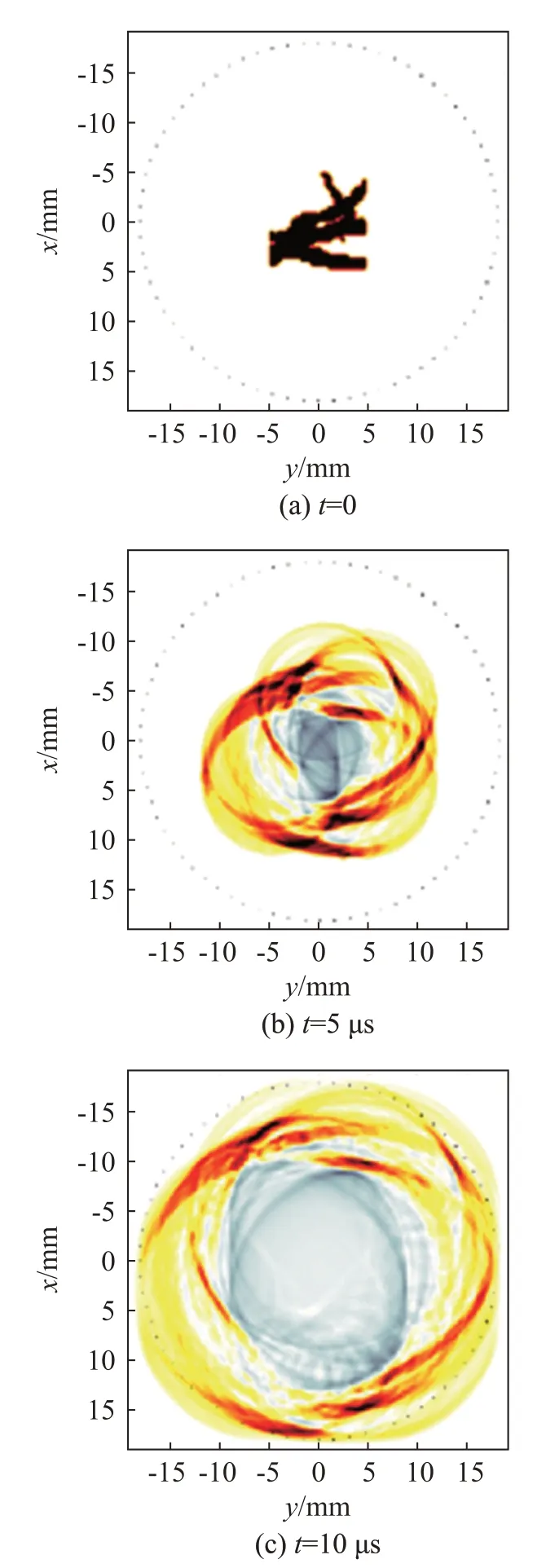
图3 模拟光声信号的传播过程Fig.3 Simulation of the PA signal propagations
1.3 仿真参数设置
对仿真中的具体参数进行设置,具体的参数为:散射颗粒(黑色部分)的声速为4 100 m·s-1、密度为1 500 kg·m-3[12-13]、其余部分(白色区域)声速为1 500 m·s-1、密度为1 000 kg·m-3的软组织。k-wave设置的计算区域为38.4 mm×38.4 mm,采样间隔为3 ns,总采样时间为20 µs。传感器元件共72 个,每隔5°围绕带散射层的光声源呈环形排列,用于记录光声源的光声场分布。传感器设置在距离光声源中心21 mm处。
1.4 重建算法
本研究中图像重建使用的是k-wave 工具箱里自带的最基本的时间反转(Time Reversal,TR)算法。该算法最早由Fink 提出。根据先收先发,后收后发的原理,将接收到的超声信号进行反投影、叠加,最后确定信号叠加的最大值处为声源位置[14]。但是,该基本算法忽略了信号的指向性和传感器阵列的稀疏性,重建图像的边缘较为模糊,产生了一定的背景噪声。重建图像示例如图4所示。图4(a)为数据集中的分割图像的光声信号模拟,图4(b)为模拟信号经内置TR 重建算法处理后的重建图像。

图4 k-wave工具箱中TR算法图像重建示例Fig.4 Example of TR algorithm image reconstruction in kwave toolbox
在存在散射的情况下,经TR算法重建出的图像既包含了算法造成的图像模糊与背景噪声,又包含了因散射造成的图像模糊。在存在散射的情况下,图像产生伪影不仅是由于上文所述的算法本身忽略了传感器阵列稀疏性和指向性产生的伪影;同时由于散射层本身对声信号造成的散射,相比于无散射情况下,接收到的光声信号含有大量的散射信号,同时信号的相位、幅度也受到了影响,这会对图像重建造成进一步干扰,加重了重建图像的伪影。
2 机器学习抗散射原理及网络构建
2.1 卷积神经网络的构建
对于本文中的声散射过程,可以将血管的图像信息视为测量对象X,将接收到的光声信号的直接重建图像视为测量分布Y,将从X到Y的过程视为光声信号通过散射层的传播过程。这个传播过程可以看作一个映射函数F。因此可以尝试建立一个神经网络来解决映射函数F相关的最小化问题。并通过设计输入和输出函数的结构风险最小化问题,将这个最小化问题设计成系统的目标函数,求训练样本损失函数的最小值。
本文建立了一个卷积神经网络(Convolutional Neural Networks,CNN)来训练关于模糊图像和无散射图像的映射关系。CNN网络总体结构遵循U-Net架构[15],其网络结构如图5所示。

图5 CNN网络结构Fig.5 The networks structure of CNN
U-Net网络是在全卷积神经网络的基础上改进后的网络,该网络使用了编码器-解码器结构,因为结构呈完全对称的U 型被称为U-Net。U-Net 的浅层包含图像精细特征的高分辨率信息,深层包含目标和环境之间特征的语义信息[16]。本研究中选用U-Net结构研究散射介质光声成像有两个原因:(1)本研究中的光声成像的散射属于Mie散射,研究中接收到的是宽带光声信号;由于散射点的对光声信号的散射和叠加,光声信号场的空间分布较为复杂。而U-Net的浅层和深层分布从图像中获取高频和低频信息,通过跳跃链接(skip connections)可以同时保留高低频的信息。(2)医学成像问题相对于其他自然图像成像问题,其成像目标和结果相对固定。U-Net 可以重建具有自相似性的空间结构[17],在医学成像领域表现良好。
本研究使用的网络结构在U-Net架构的基础上进行了一些修改:由于U-Net架构对于高频空间频率信息的敏感性相对较低[18],同时本研究中使用的血管网图像有粗有细,如果只使用U-Net重建,对于较为细小的血管重建会产生偏差。因此,本文在每个下采样卷积层之后添加了批量归一化(Batch Normalization,BN)模块[19],以克服这个问题。BN模块通过重新定心和缩放来有效地规范每一批输入,以缓解内部协变量偏移的问题。卷积层内的激活函数选用ReLU函数。
2.2 CNN网络的参数选择
在本文的研究过程中,CNN 网络使用参数如下:训练周期数为100,处理尺寸为32,训练集大小为3 200,测试集大小为800。使用的优化器为Adam,损失函数为交叉熵损失函数(binary_cros‐sentropy)。选取该函数作为损失函数,是因为本文中使用的图像黑色背景(负样本)占大部分,正样本数据比例太小,对于常用的平均绝对误差(Mean Absolute Error,MAE)函数,均方误差(Mean Square Error,MSE)函数而言,有效数据量不足,可能出现图像全黑的情况。而交叉熵损失函数常用于二分类,本文中所使用的眼底血管图像分割图为黑白二值图像,本质上为将图像构成的Numpy 数组中的黑白像素点进行分类,可以避免上述可能出现的问题。
3 仿真结果分析
为了测试机器学习抗散射的准确性,本文从测试集中随机选择了5组图像,并将它们输入到训练过的CNN 中进行测试。数据集中的源图像(ground truth)如图6(a)所示。将该图像作为光声源对其进行散射影响下的光声场模拟,之后通过时间反转算法进行重建得到的光声散斑图像如图6(b)所示。将图6(b)的散斑图像作为输入数据,经神经网络训练后输出的重建图像如图6(c)所示。可以看出与源图像(ground truth)相比,直接重建的光声图像由于强声散射和光声信号的声阻抗失配,导致了严重的斑点、伪影、细节信息丢失和血管边缘模糊,严重降低了光声重建图像的质量。而经过CNN 网络训练后的重建图像,有效重建了目标的重要特征和细节,并且边缘清晰,对比度高。
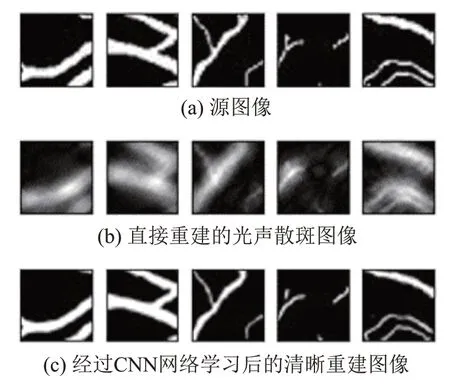
图6 CNN网络图像重建结果Fig.6 CNN network image reconstruction results
此外,本文还进行了6种不同散射情况下的对比测试,包括多层散射介质,不同颗粒密度的散射介质。使用上述同一个神经网络对以上6个数据集分别进行训练,训练结果如图7、8所示。在图8的训练中,三个模型的颗粒分布面积相同,通过改变颗粒数来改变颗粒密度。将训练后的重建图像与源图像进行比较。散射影响下的直接重建图像呈现出强烈伪影和背景噪声。经过CNN 训练后的重建图像恢复了血管网络的结构和丢失的细节,同时背景噪声也大大降低。

图7 不同层数时神经网络的学习结果Fig.7 The learning result of neural network with different layers

图8 不同颗粒数时神经网络的学习结果Fig.8 The learning result of neural network with different particle numbers
图9为对以上6组学习结果的评价指标,评价函数采用MAE。由图9 可见,经过约30 个训练周期的波动后,学习结果在60 个训练周期后趋向收敛。

图9 机器学习结果评价Fig.9 Evaluation of machine-learning results
4 结论
在血管网光声成像的抗散射研究中,本文提出了一种基于U-Net的CNN来学习散射介质下血管网的光声图像散斑图与清晰的目标图像间的映射关系。结果表明,该方法能够同时克服散射问题和重建算法缺点,从高度模糊的散斑图中提取有效信息,降低伪影和噪声,快速重建目标图像,得到的图像血管边缘清晰,细节清晰,对比度高。结果验证了将机器学习用于散射介质下血管网光声图像重建的可行性。该方法为提高散射影响下光声成像质量提供了有效的工具,同时也为进一步在体深度光声成像提供了可能,并为乳腺癌的微血管网和病理组织的检测以及早期诊断提供了一定的理论基础。但是本文中的机器学习方法和其他机器学习方法一样,所提出的方法仅限于训练中的数据集。同时仿真条件的设置和实际在体实验中乳腺癌的检测情况还有一定差距。在未来的研究中,我们考虑将CNN 和物理模型相结合,进行动物和人体实验,验证深度学习方法在光声成像抗散射研究中的更多可能。
