EGFR罕见突变非小细胞肺癌患者的临床病理特征及治疗效果
2024-01-17孙文佳岳君秋王满香
孙文佳,岳君秋,王满香
0 引言
表皮生长因子受体(epidermal growth factor receptor, EGFR)突变是我国非小细胞肺癌(NSCLC)最常见的致癌驱动事件,阳性率达45%~55%[1],其中常见的突变类型为21号外显子L858R突变(exon 21L858R, ex21 L858R)和19号外显子缺失(exon 19 deletions, ex19del),约占所有EGFR突变的85%[2],对EGFR-酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitors, EGFR-TKIs)治疗敏感,被称为EGFR经典突变或敏感突变;其他EGFR突变类型发生率低,统称为EGFR罕见突变。尽管突变率低,但我国肺癌的总体患病率高,每年约超过30 000例新诊断的NSCLC患者具有EGFR罕见突变[3],精准检测出EGFR的突变类型有助于为患者的精准治疗提供指导。尽管大样本研究已经明确EGFR的整体突变率,但是有关EGFR罕见突变的发生率还有待进一步评估。本研究回顾性分析了我院674例NSCLC患者的临床病理资料,统计EGFR罕见突变的发生率,并分析相应的临床病理特征,为临床检测及研究提供参考依据。
1 资料与方法
1.1 资料
回顾性分析2022年1月—2022年12月华中科技大学同济医学院附属湖北肿瘤医院病理科确诊的674例NSCLC患者标本及病历资料,其中男399例,女275例;年龄31~94岁,中位年龄64岁;肿瘤分期:Ⅰ期92例,Ⅱ期23例,Ⅲ期160例,Ⅳ期399例;病理类型:腺癌548例,非腺癌126例(鳞状细胞癌94例;NSCLC,NOS17例;腺鳞癌7例;肉瘤样癌5例;黏液表皮样癌2例;大细胞神经内分泌癌1例)。肿瘤分期参照第8版国际肺癌TNM分期标准,病理类型根据第5版WHO肺肿瘤组织学分型。本研究经华中科技大学同济医学院附属湖北肿瘤医院伦理委员会批准(LLHBCH2023YN-016),所有标本的患者在检测前均签署知情同意书。患者随访资料通过电话咨询获取。
1.2 核酸提取及基因突变检测
所有样本肿瘤含量均符合检测要求,德国QIAGEN公司石蜡包埋组织DNA提取试剂盒(商品号:56404)提取样本DNA,严格按照说明书操作。基因突变检测采用厦门艾德公司的人类EGFR基因突变检测试剂盒(商品号:8.01.0131)或人多种基因突变检测试剂盒(商品号:8.01.0192),均能检测EGFR18号外显子G719A/S/C(G719X)、ex19del(包括28种缺失类型,但不能具体区分)、20号外显子T790M、20号外显子插入(exon 20 insertion, ex20ins)(包括23种插入类型,但不能具体区分)、20号外显子S768I、21号外显子L858R及L861Q突变。在Cobas z480荧光定量PCR仪(Roche公司)上进行PCR扩增反应。反应结束后根据样本突变Ct值进行结果判读,当样本Ct值≥阴性临界值时,则该样本结果判为阴性,当样本Ct值<强阳性临界值,或者介于阴性、强阳性临界值之间但ΔCt值<相对应的ΔCt截断值时,均判为阳性。所有试验均设阴、阳性对照。
1.3 统计学方法
采用SPSS20.0软件进行统计学分析,相关性分析采用χ2检验或连续校正的χ2检验或Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
2.1 EGFR罕见突变的突变率
674例NSCLC患者中EGFR经典突变288例(42.73%),占EGFR突变总数的89.16%。EGFR罕见突变35例(5.19%),包括11例ex18G719X突变(1.63%)、7例ex20ins突变(1.04%)、5例ex-21L861Q突变(0.74%)、12例复合突变(1.78%)(6例L858R+原发性T790M、1例ex19del+原发性T790M、2例G719X+S768I、1例ex19del+L858R、1例L861Q+G719X、1例L861Q+ex19del),见图1。

图1 674例NSCLC EGFR基因突变分布情况Figure 1 Distribution of EGFR mutations in 674 NSCLC cases
2.2 EGFR罕见突变与临床病理特征的相关性
与EGFR野生型相比,EGFR罕见突变中女性、无吸烟史、腺癌患者占比更高(65.71%vs.18.52%,P<0.001; 71.43%vs.34.19%,P<0.001;100%vs.66.67%,P<0.001),且以高/中分化(腺泡型、乳头状型、贴壁型)腺癌更多见(51.61%vs.29.22%,P=0.012),脑、骨转移率更高(25.71%vs.12.25%,P=0.049; 34.29%vs.19.94%,P=0.048);与经典突变相比,二者各临床病理特征及肝、骨、脑的转移率差异均无统计学意义(P>0.05),见表1。
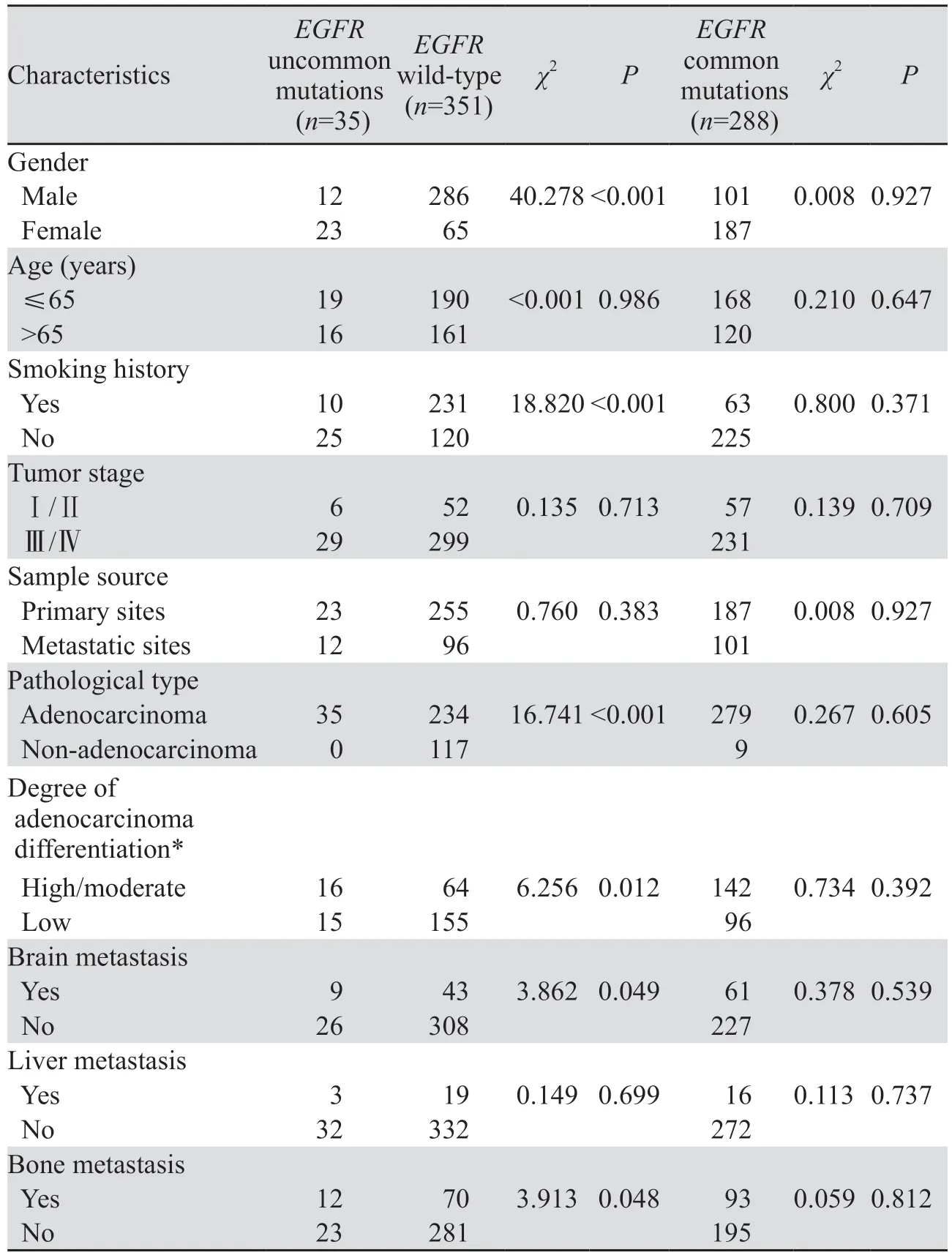
表1 EGFR罕见突变与EGFR野生型、EGFR经典突变NSCLC患者临床病理特征比较Table 1 Clinicopathological features comparation of patients with NSCLC and uncommon EGFR mutations, wildtype EGFR or common EGFR mutation
各EGFR罕见突变类型与临床病理特征的相关性具有差异性,见表2,与EGFR野生型相比,G719X突变以女性、无吸烟史、腺癌更多见(P<0.001;P=0.021;P=0.045),复合突变亦如此(P<0.001;P<0.001;P=0.034);ex20ins突变在女性中的突变率明显高于男性(5.80%vs.1.04%,P=0.037),且腺癌分化程度以高/中分化更多见(P=0.006),而与吸烟史、病理类型等相关性不明显(P>0.05);L861Q与各临床病理特征的相关性均不明显(P>0.05)。
2.3 EGFR罕见突变NSCLC患者治疗及随访
31例EGFR罕见突变患者获得随访资料,中位随访时间10个月(1~32个月)。5例ⅠA期患者中,1例肺段切除、4例肺叶切除;1例ⅠB期患者行肺段切除并术后培美曲塞+卡铂化疗;2例ⅢA期患者均行肺叶切除,其中1例术后培美曲塞+卡铂化疗。此8例患者随访期间(5~11个月)均无复发或转移。其余23例为晚期(ⅢB期及以上)不可手术患者,具体治疗及随访情况见表3。
3 讨论
EGFR属于具有酪氨酸激酶活性的膜受体ERBB/HER家族中的一员,当与配体结合后,EGFR发生二聚化,导致酪氨酸激酶活化,进而激活下游PI3K/AKT、RAS/MAPK、JAK/STAT信号通路,调节细胞增殖、凋亡和血管生成[4]。EGFR基因位于第七号染色体短臂(7p12-14)上,在NSCLC中,EGFR突变通常位于编码酪氨酸激酶结构域的18~21号外显子中,当发生点突变、缺失和插入突变时会导致不依赖配体的受体激酶活性增加,所以EGFR基因突变常被称为EGFR激活突变[5]。EGFR-TKIs可以通过与EGFR结合区的竞争性结合,抑制EGFR自磷酸化激活及其下游信号通路。EGFR-TKIs是晚期EGFR突变NSCLC患者一线治疗的标准模式,能显著改善其预后。一代TKI包括吉非替尼、厄洛替尼、埃克替尼,与EGFR可逆性结合,比标准化疗大大提高了EGFR阳性NSCLC患者的PFS。然而,获得性耐药是一个不可避免的过程,通常在治疗10~12个月后出现,最常见的机制是20号外显子T790M突变;二代TKI包括阿法替尼、达可替尼,以共价键的方式与EGFR不可逆结合,仍然没有克服T790M耐药突变;三代TKI包括阿美替尼、伏美替尼、奥希替尼,克服了T790M耐药突变,并具有控制脑转移的优势[6]。
EGFRex20ins是最常见的罕见突变,在EGFR突变的NSCLC中发生率为4%~10%,好发于不吸烟的女性肺腺癌患者[7]。本研究采用PCR的方法检出的ex20ins突变率为1.04%,占EGFR突变的2.17%,并非最常见的罕见突变(本组病例中G719X最常见),原因可能为EGFRex20ins突变的异质性高,常规PCR检测方法仅能检测有限的插入类型,因此,针对此种突变类型,PCR检测存在漏检风险,应该首选NGS进行检测。本组中ex20ins与吸烟史、病理类型相关性不明显,也可能与检出阳性病例数太少有关。此外,我们发现ex20ins腺癌中以高/中分化更多见。目前,以铂类为基础的化疗仍是EGFRex20ins非小细胞肺癌患者最常用的一线治疗方案,现有EGFR-TKIs的疗效并不理想,EGFRex20ins有不同的突变亚型,目前研究发现大多数亚型对一代和二代TKIs有原发抗性,仅少数亚型如A763_Y764insFQEA突变对厄洛替尼敏感[8]。对于EGFRex20ins突变,多种新药正在开发中,目前已知的相对成熟的药物包括莫博替尼(TAK-788)、埃万妥单抗(JNJ372)、波齐替尼和伏美替尼,其中莫博替尼、埃万妥单抗已获美国食品药品监督管理局(FDA)批准用于既往化疗后出现进展的晚期EGFRex20ins突变NSCLC的患者[7]。本组中2例晚期EGFRex20ins患者一线均为含铂类化疗,其中1例二线使用JMT101(一种EGFR单克隆抗体)+奥西替尼治疗5个月,疾病部分缓解,其长远疗效令人期待。
G719X、L861Q、S768I分别占NSCLC中所有EGFR突变的3%、1%和1%[9]。本组中G719X是最常见的罕见突变,占EGFR突变的3.41%,L861Q占EGFR突变的1.55%,与文献报道相差不大,本组中未检测到S768I单突变。关于这类罕见突变的临床病理特征研究较少,少量研究显示G719X、L861Q更多见于女性[2]。本研究中G719X突变率不仅与女性相关,而且多见于无吸烟史、腺癌患者,而L861Q与各临床病理特征的相关性均不明显。一项回顾性多中心研究发现,吉非替尼/厄洛替尼对G719X、L861Q、S768I突变患者有效,但治疗效果不如敏感突变患者,78例G719X突变患者中客观缓解率(ORR)为36.8%,中位PFS为6.3个月;58例L861Q突变患者中ORR为39.6%,中位PFS为8.1个月,7例S768I突变患者中ORR为33.3%,而常见突变患者的ORR达66.5%,中位PFS达11.4个月[10]。临床前研究显示,G719X、S768I和L861Q对第二代和第三代TKI比第一代更敏感,有学者建议将阿法替尼或奥西替尼用于这些罕见突变患者的一线治疗[9]。其中阿法替尼在该类突变患者中显示出优越的疗效,是目前唯一被FDA批准用于此类突变晚期NSCLC患者的TKI药物[11]。本组获得随访资料的8例G719X晚期患者,7例一线使用TKI(其中5例为阿法替尼),中位PFS为12个月,1例使用含铂类化疗药,PFS为7个月,低于TKI组。3例L861Q晚期患者一线使用TKI,中位PFS为8个月,其中使用阿法替尼及贝伐珠单抗靶向治疗的患者,随访11个月疾病仍稳定。以上数据提示对于具有G719X、L861Q突变的晚期NSCLC患者,TKI为首选,特别是阿法替尼。
复合突变指同一个肿瘤中存在一个以上的EGFR突变,文献中报道的复合突变发生率差异较大,占总EGFR突变的4%~26%,部分原因为检测方法不同[12],还有可能与种族以及环境因素影响有关[13]。复合突变常见于从不吸烟或轻度吸烟的女性患者;与EGFR单突变相比,复合突变的淋巴结转移率更高、预后更差[14]。本组中复合突变占EGFR突变的3.72%,与女性、无吸烟史、腺癌显著相关。既往研究发现双经典突变、经典突变伴罕见突变的复合突变、仅含罕见突变的复合突变对EGFRTKIs的敏感性依次减弱[5]。吉非替尼和厄洛替尼在罕见突变的复合突变(9例G719X+L861Q和10例G719X+S768I)患者ORR和中位PFS均显著高于罕见单突变(ORR: 68.4%vs.37.8%;中位PFS:11.9个月vs.6.5个月),且效果接近敏感突变患者[10]。本组中1例双经典突变复合的患者一线使用阿美替尼,PFS为7个月,并未显示出其对TKI的敏感性高于其他罕见突变类型;2例具有G719X的复合突变患者分别使用吉非替尼(PFS 7个月+)和阿法替尼(PFS未知),分别随访7、17个月,均带瘤生存。原发T790M突变指未经EGFR-TKIs治疗的样本检测到T790M基因突变,常复合其他EGFR突变,罕见情况下也可为单突变[15]。在EGFR-TKI治疗后出现耐药的患者中,获得性T790M突变率高达63%,未经治疗的肿瘤中原发性T790M突变率为1.3%[2],本组7例伴T790M突变的患者均为复合突变,既往无EGFR-TKI治疗史,突变率为1.04%,与文献报道一致。对于复合突变的患者,有学者推荐阿法替尼用于含有E709X、S768I或G719X的复合突变,奥希替尼用于涉及T790M的复合突变[9]。本组中5例含T790M的复合突变患者使用三代TKI,中位PFS大于10个月,疗效显著。
综上所述,本研究发现,EGFR罕见突变与女性、无吸烟史、腺癌相关,脑、骨转移率更高。各罕见突变类型与临床病理特征的相关性不同。当有吸烟史的男性患者非腺癌样本检测出G719X或复合突变时,分子病理医师签发报告时需谨慎,必要时多平台验证。目前PCR法检测覆盖罕见突变位点的能力有限,检测结果不能代表NSCLC患者EGFR罕见突变的全貌,受检测方法所限,本研究并未纳入其他重要罕见突变,如ex19ins、C797S、E709X等。随着检测技术的进步,越来越多的EGFR罕见突变类型被发现,迫切需要多中心大样本前瞻性临床研究确定各种罕见突变的临床意义,特别是它们对TKIs的敏感性,以指导临床治疗。
利益冲突声明:
所有作者均声明不存在利益冲突。
