吗替麦考酚酯联合甲泼尼龙对系统性红斑狼疮患者免疫功能、β-抑制蛋白质1 水平及临床疗效的影响
2024-01-17李庆娜王晓寒董卫红
李庆娜,王晓寒,董卫红
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫性疾病,通常会累及全身多个脏器。SLE 患者会出现皮疹、发热、淋巴结肿大等症状,若不能及时有效地治疗还可能引起肾脏等重要器官衰竭,严重影响患者的生命健康[1]。SLE 的发病机制尚不明确,但相关研究普遍认为其与T 淋巴细胞数量减少、B 淋巴细胞过度增殖有关[2]。目前,临床主要采用糖皮质激素治疗SLE,但单独使用糖皮质激素产生的药品不良反应较多,且易复发,因此临床治疗时往往给予免疫抑制剂联合治疗[3]。甲泼尼龙属于糖皮质激素药物,在治疗自身免疫性疾病方面具有较好的治疗效果,可抑制炎症因子释放,进而发挥抗炎作用[4]。吗替麦考酚酯为治疗SLE 常用的免疫抑制剂,其水解后可变为霉酚酸,具有较强的免疫调节和抗炎作用,且对肝、肾损伤较小,目前已成为临床治疗SLE 的一线药物[5]。研究显示[6-8],甲泼尼龙或吗替麦考酚酯治疗SLE 均可缓解患者的临床症状,但因该病发病机制较为复杂,单独使用某一种药物的治疗效果不理想,故临床常联合甲泼尼龙、吗替麦考酚酯治疗,以提高患者的临床疗效及抑制SLE进展。β抑制蛋白1(β-arrestin1)是一种可溶性蛋白质,可介导G 蛋白偶联受体(G-proteincoupled receptor,GPCR)的内吞、脱敏及运输,参与SLE 的发生及进展[9]。SLE 可导致免疫功能异常、内皮细胞损伤,致使β-arrestin1 释放入血,β-arrestin1 的水平可反映疾病活动程度,故监测血清β-arrestin1 水平对于评价SLE 活动程度及临床疗效具有积极作用[10]。目前,临床尚缺乏甲泼尼龙联合吗替麦考酚酯治疗对SLE 患者免疫功能及β-arrestin1 水平影响的相关报道。基于此,本研究通过给予SLE 患者吗替麦考酚酯联合甲泼尼龙治疗,评价其对患者免疫功能及β-arrestin1 水平的影响,并探讨其临床疗效,以期为临床治疗SLE 提供参考。现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年4 月~2022 年7 月期间某院收治的74 例SLE 患者作为研究对象,按照随机数字表法分为观察组和对照组,每组37 例。观察组:男性10 例,女性27 例;年龄22~56 岁,平均年龄(32.42±5.67)岁;病程5~11 个月,平均病程(8.45±1.28)个月。对照组:男性11 例,女性26 例;年龄23~55 岁,平均年龄(32.79±6.13)岁;病程6~12 个月,平均病程(8.87±1.34)个月。两组患者一般资料比较无统计学差异(P>0.05),具有可比性。本研究经医院伦理委员会批准(伦理批号2020-03-098),所有患者均知情并签署知情同意书。
纳入标准:①参考《 2019 年欧洲抗风湿病联盟更新系统性红斑狼疮管理指南》[11]中SLE 相关诊断标准确诊为SLE 者。②入组前2 个月未使用糖皮质激素或免疫抑制剂治疗者。③年龄22~56 岁者。
排除标准:①存在恶性肿瘤者。②对本研究所用药物过敏者。③处于妊娠期或哺乳期者。④心、肝、肾功能损伤或患有其他严重疾病者。
1.2 治疗方法
对照组给予甲泼尼龙片(Pfizer Italia Srl,注册证号H20150245,规格4mg)治疗,初始剂量为24mg/次,qd,治疗4 周后酌情减少剂量,维持4~8mg/d,共治疗12 周。观察组在对照组基础上口服吗替麦考酚酯分散片(杭州中美华东制药有限公司,国药准字H20052083,规格0.25g)0.5g/次,bid,共治疗12 周。
1.3 观察指标
(1)免疫功能。分别于治疗前后采集患者空腹静脉血3ml,使用TDL-6M 台式低速冷冻离心机(四川蜀科仪器有限公司,r=10cm),以3000r/min(4℃)离心10min,取血清。采用免疫比浊法检测两组患者血清IgA、IgG、IgM、补体C3 和补体C4 水平。
(2)血常规指标。分别于治疗前后采集患者空腹静脉血3ml,使用TDL-6M 台式低速冷冻离心机,以3000r/min(4 ℃)离心10min,取血清。采用博科BK-1200 全自动生化分析仪(山东博科生物产业有限公司)检测两组患者血清白细胞计数(white blood cell count,WBC)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、血红蛋白(hemoglobin,Hb)、血小板计数(platelet count,PLT)。
(3)肾功能指标。分别于治疗前后采集患者空腹静脉血3ml,使用TDL-6M 台式低速冷冻离心机,以3000r/min(4℃)离心10min,取血清。采用免疫荧光法测定两组患者血清白蛋白水平;采用博科 BK-1200 全自动生化分析仪(山东博科生物产业有限公司)检测两组患者血清血肌酐水平。收集患者24h 尿液标本,采用TD-4N 台式低速多管架尿沉渣分离离心机(濮阳市沪康医疗设备有限公司)检测两组患者24h 尿蛋白。
(4)血清β-arrestin1 水平:分别于治疗前后采集患者空腹静脉血3ml,使用TDL-6M 台式低速冷冻离心机,以3000r/min(4℃)离心10min,取血清。采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测两组患者血清β-arrestin1 水平。β-arrestin1 试剂盒购自上海将来实业股份有限公司。
(5)临床疗效。分别于治疗前后采用系统性红斑狼疮疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)评分表对患者疾病活动度进行评分,根据SLEDAI 评分减分率及症状改善情况评估患者的临床疗效:①显效:SLEDAI评分减分率≥70%,症状有明显改善且病情好转。②有效:50%≤SLEDAI 评分减分率≤69%,症状有所缓解。③无效:SLEDAI 评分减分率<50%,症状未得到缓解甚至加重。总有效率(%)=(显效+有效)病例数/每组总病例数×100%[12]。
(6)不良反应发生情况:观察并记录两组患者治疗过程中恶心呕吐、头晕、疱疹等不良反应的发生情况。
1.4 统计学方法
应用SPSS 25.0 软件分析处理数据。计数资料以n(%)表示,采用χ2检验;计量资料以±s表示,采用t检验。P<0.05 为具有统计学差异。
2 结果
2.1 治疗前后两组患者免疫功能比较
治疗前,两组患者补体和免疫球蛋白水平比较均无统计学差异(P>0.05);治疗后,两组患者补体C3 和补体C4 水平均升高(P<0.05),且观察组高于对照组(P<0.05)(表1)。两组患者IgG、IgA、IgM 水平均降低(P<0.05),且观察组低于对照组(P<0.05)(表2)。
表1 治疗前后两组患者补体水平比较 n=37,±s,g/L

表1 治疗前后两组患者补体水平比较 n=37,±s,g/L
与同组治疗前比较,a:P﹤0.05;与对照组比较,b:P﹤0.05。下同
补体C3补体C4治疗前治疗后治疗前治疗后对照组0.34±0.070.63±0.16a0.16±0.040.25±0.06a观察组0.32±0.050.79±0.21ab0.17±0.050.38±0.08ab t 值1.4143.6960.9507.908 P 值0.162<0.0010.345<0.001组别
表2 治疗前后两组患者免疫球蛋白水平比较 n=37,±s,g/L

表2 治疗前后两组患者免疫球蛋白水平比较 n=37,±s,g/L
IgG:免疫球蛋白G;IgA:免疫球蛋白A;IgM:免疫球蛋白M
IgGIgAIgM治疗前治疗后治疗前治疗后治疗前治疗后对照组20.24±4.1215.62±3.54a3.66±0.963.18±0.84a2.64±0.622.14±0.53a观察组19.35±3.89 13.33±3.22ab3.57±0.872.54±0.75ab2.75±0.561.76±0.48ab t 值0.9552.9110.4233.4570.8013.233 P 值0.3430.0050.6740.0010.4260.002组别
2.2 治疗前后两组患者血常规指标比较
治疗前,两组患者WBC、ESR、Hb、PLT 水平比较均无统计学差异(P>0.05);治疗后,两组患者WBC、Hb、PLT 水平均升高(P<0.05),且观察组高于对照组(P<0.05);两组患者ESR 均降低(P<0.05),且观察组低于对照组(P<0.05)(表3)。
表3 治疗前后两组患者血常规指标比较 n=37,±s

表3 治疗前后两组患者血常规指标比较 n=37,±s
WBC:白细胞计数;ESR:红细胞沉降率;Hb:血红蛋白;PLT:血小板计数
WBC(×109/L)ESR(mm/h)Hb(g/L)PLT(×109/L)治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后对照组3.25±0.21组别3.95±1.04a 50.48±10.63 26.03±4.86a 105.58±8.84 122.34±9.46a 83.42±11.57 175.98±16.63a观察组3.23±0.19 194.35±18.75ab t 值0.4302.7980.4005.0890.4566.3910.2044.459 P 值0.6690.0070.690<0.0010.650<0.0010.839<0.001 4.67±1.17ab 51.51±11.59 20.79±3.95ab 104.65±8.72 137.48±10.87ab 82.88±11.25
2.3 治疗前后两组患者肾功能指标比较
治疗前,两组患者血清白蛋白、血肌酐及24h尿蛋白水平比较均无统计学差异(P>0.05);治疗后,两组患者血清白蛋白水平均升高(P<0.05),且观察组高于对照组(P<0.05);两组患者血清血肌酐和24h 尿蛋白水平均降低(P<0.05),且观察组低于对照组(P<0.05)(表4)。
表4 治疗前后两组患者肾功能指标比较 n=37,±s

表4 治疗前后两组患者肾功能指标比较 n=37,±s
血清白蛋白(g/L)血肌酐(μmol/L)24h 尿蛋白(g/24h)治疗前治疗后治疗前治疗后治疗前治疗后对照组21.11±3.0229.46±4.21a64.36±16.4556.88±13.12a0.37±0.120.19±0.05a观察组21.58±2.8734.55±4.79ab65.23±15.54 49.42±12.36ab0.38±0.130.16±0.04ab t 值0.6864.8550.2332.5170.3442.850 P 值0.495<0.0010.8160.0140.7320.006组别
2.4 治疗前后两组患者SLEDAI 评分和β-arrestin1 水平比较
治疗前,两组患者SLEDAI 评分和β-arrestin1水平比较均无统计学差异(P>0.05);治疗后,两组患者SLEDAI 评分和β-arrestin1 水平均降低(P<0.05),且观察组低于对照组(P<0.05)(表5)。
表5 治疗前后两组患者SLEDAI 评分和β-arrestin1 水平比较 n=37,±s

表5 治疗前后两组患者SLEDAI 评分和β-arrestin1 水平比较 n=37,±s
SLEDAI:系统性红斑狼疮活动指数;β-arrestin1:β-抑制蛋白质1
SLEDAI 评分β-arrestin1(ng/L)治疗前治疗后治疗前治疗后对照组10.14±2.737.64±1.38a0.56±0.120.37±0.08a观察组9.28±2.875.49±1.22ab0.58±0.110.24±0.05ab t 值1.3217.1000.7478.382 P 值0.191<0.0010.457<0.001组别
2.5 两组患者临床疗效比较
观察组患者治疗总有效率(91.89%)高于对照组(72.97%,P<0.05)(表6)。
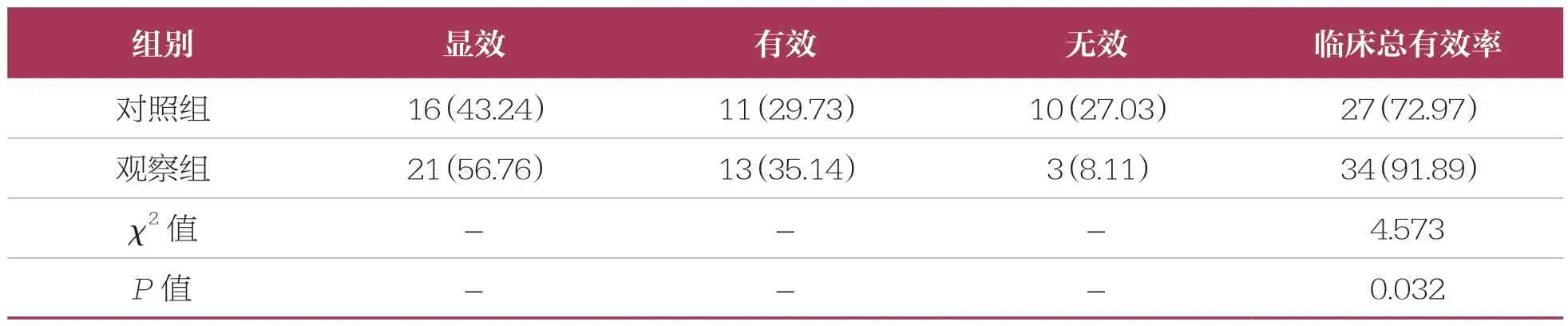
表6 两组患者临床疗效比较 n=37,n(%)
2.6 不良反应发生情况
两组患者治疗过程中均未发生严重的不良反应,且症状较轻。两组患者不良反应总发生率比较无统计学差异(P>0.05)(表7)。

表7 两组患者不良反应发生情况比较 n=37,n(%)
3 讨论
SLE 为多因素诱发的自身免疫性疾病,由于内分泌异常、免疫功能障碍、遗传因素、环境因素等各种因素的相互影响,导致发生针对自身抗原的免疫反应,从而引起患者免疫功能紊乱[13]。由于免疫功能紊乱,SLE 患者体内会产生大量免疫球蛋白,这些自身抗体与相关抗原形成的免疫复合物会逐渐沉积在血管、肾小球等部位,因此有可能引发血管炎以及肾脏疾病,严重危及患者的生命健康[14-15]。糖皮质激素类药物是临床治疗SLE 的主要药物,其具有强大的抗炎作用,可降低机体炎症水平,起到缓解病情的治疗效果。甲泼尼龙为重要的糖皮质激素类药物,可作用于T 淋巴细胞和G0 期细胞,减少组胺类物质的释放,降低毛细血管的通透性,进而减轻炎症反应[16-17]。此外,甲泼尼龙也可调节免疫反应,降低T 细胞活性,并减少免疫活性细胞增殖,从而减轻炎症反应和血管损伤[18]。但由于SLE 患者补体C3、补体C4 水平降低,免疫功能显著下降,因此单独使用甲泼尼龙难以达到有效调节SLE 患者免疫功能、改善临床症状的目的。此外,长期服用甲泼尼龙产生的药品不良反应较多,易出现肠胃不适、高血糖等症状,且停药后易复发[19]。因此,联合用药治疗SLE 已成为临床探索的重点内容。
吗替麦考酚酯为新型免疫抑制剂类药物,在人体内会水解为霉酚酸,发挥抗T 淋巴细胞、B 淋巴细胞增殖的作用,负向调节免疫复合物的生成,降低机体炎症水平并改善血小板减少,有利于缓解SLE 患者的病情[20-21]。此外,吗替麦考酚酯可抑制内皮细胞、血管平滑肌细胞增殖以及结缔组织的合成,延缓肾小球硬化,降低肾脏受损程度,有利于防止肾脏纤维化[22]。本研究联合吗替麦考酚酯、甲泼尼龙治疗SLE,结果显示,观察组患者治疗总有效率(91.89%)高于对照组(72.97%,P<0.05),且两组患者不良反应总发生率比较无统计学差异(P>0.05),提示吗替麦考酚酯联合甲泼尼龙治疗SLE 可有效提高患者的临床疗效,且未增加不良反应的发生风险。
研究证明[23],免疫复合物诱发的变态反应可激活SLE 患者的补体系统,消耗大量补体C3 和补体C4,致使其血清水平降低,难以有效清除凋亡细胞及免疫复合物,从而推动SLE 进展。本研究结果显示,经治疗后,两组患者补体C3 和补体C4 水平均升高(P<0.05),且观察组高于对照组(P<0.05);两组患者IgG、IgA、IgM 水平均降低(P<0.05),且观察组低于对照组(P<0.05),提示吗替麦考酚酯联合甲泼尼龙可显著改善患者的免疫功能,这可能与甲泼尼龙的抗炎作用有关,也可能与吗替麦考酚酯可抑制B 淋巴细胞、T 淋巴细胞的增殖,减少自身Ig 抗体产生,提高补体水平,进而改善SLE患者的免疫功能有关[24]。
SLE 可导致自身免疫性溶血性贫血、骨髓造血功能抑制及肾功能损伤,从而导致WBC、Hb、PLT 水平降低;SLE 还可生成炎症因子,促进红细胞沉降,致使ESR 升高,因此SLE 患者WBC、Hb、PLT 水平降低及ESR 升高预示着疾病活动性增强[25]。本研究中,治疗后两组患者WBC、Hb、PLT 水平均升高(P<0.05),且观察组高于对照组(P<0.05);两组患者ESR 均降低(P<0.05),且观察组低于对照组(P<0.05),提示吗替麦考酚酯联合甲泼尼龙可有效促进患者血常规指标恢复,这可能与两者联用能抑制免疫激活、缓解炎症反应及降低SLE 活动度有关。血清白蛋白、血肌酐及24h 尿蛋白是衡量患者肾功能的重要指标,肾功能异常会导致血清白蛋白水平降低,血肌酐和24h 尿蛋白水平升高[26]。本研究观察了吗替麦考酚酯及甲泼尼龙对患者肾功能的影响,结果显示,治疗后两组患者血清白蛋白水平均升高(P<0.05),且观察组高于对照组(P<0.05);血肌酐和24h 尿蛋白水平均降低(P<0.05),且观察组低于对照组(P<0.05),提示两组患者肾功能均有明显改善,且观察组优于对照组。这与祝传宾等[27]的研究结果相符,提示吗替麦考酚酯联用甲泼尼龙不会增加患者的肾脏负担,安全性较高。
β-arrestin1 为细胞内支架蛋白,对GPCR 具有负向调控作用,可通过调控多种细胞内信号通路参与细胞增殖、免疫应答等过程[28],在SLE 患者血清中呈高表达,可反应疾病活动度[10]。SLEDAI是反映SLE 活动度的重要指标,其评分越高,说明SLE 活动度越高,病情越严重[29]。本研究中,治疗后两组患者SLEDAI 评分和血清β-arrestin1 水平均降低(P<0.05),且观察组低于对照组(P<0.05),提示吗替麦考酚酯联合甲泼尼龙可有效降低SLE 患者的疾病活动度,改善患者的临床症状。然而,本研究仍存在一定的局限性,如纳入样本量较少且为单中心研究,随访时间短,其研究结果可能存在一定偏倚,未来将继续开展大样本、多中心的研究,以证实吗替麦考酚酯联合甲泼尼龙治疗SLE 的有效性及安全性。
综上所述,与单用甲泼尼龙相比,吗替麦考酚酯联合甲泼尼龙治疗可显著改善SLE 患者的免疫功能和肾功能,降低SLE 活动度,且未增加不良反应的发生风险。
