综合运用热力学理论探究氢氧化钙溶解热的测定
2024-01-16尚昊
尚昊
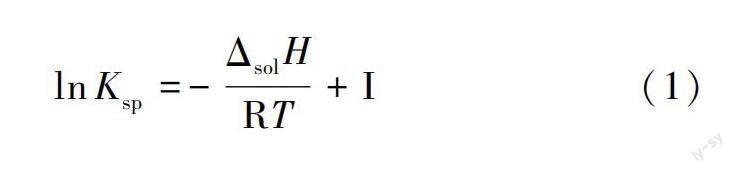


摘要:设计了简洁的方法,求解得到难以直接测定的物质溶解热。通过测定不同温度氢氧化钙饱和溶液的pH,借助相应温度下水的离子积常数Kw,可计算出溶液中氢氧根离子的浓度。进一步可求得各温度下氢氧化钙的溶度积常数Ksp。利用范特霍夫方程中Ksp和绝对温度T的关系式,计算可得氢氧化钙的溶解热ΔsolH。有助于增强学生理解理论对实践的指导作用,同时可以激发学生采用新思路解决化学疑难问题的探索精神。
关键词:氢氧化钙;溶解热;水的离子积常数;范特霍夫方程
文章编号:10056629(2023)12008203
中图分类号:G633.8
文献标识码:B
教育部制定的《普通高中化学课程标准(2017年版2020年修订)》中提出开展以化学实验为主的多种探究活动,激发学生学习化学的兴趣,促进学生学习方式的转变。高中学习反应热时,学生初步了解到一些反应的反应热可以通过量热计直接测定[1]。例如,盐酸与氢氧化钠溶液反应的过程中会放出热量使体系的温度升高,根据测得的体系温度变化和有关物质的比热容等数据可以计算反应热[2]。但如果一个体系放出或者吸收的热量不足以引起明显的温度变化,使用量热计直接测定热量的变化便会产生较大误差。溶解热是溶质和溶剂微粒间相互作用(放热)与拆开溶质微粒间作用(吸热)以及部分溶剂微粒间相互作用(吸热)在能量方面的代数和。因氢氧化钙溶解时产生的热量变化较小,不宜选用量热计直接测定氢氧化钙的溶解热。本文通过引导学生采用测量溶液的pH,最终借助范特霍夫方程间接求得溶解热的方法,为学生解决疑难问题提供了新的思路。
1 实验原理
范特霍夫方程通常是一个用于计算在不同温度下某反应的平衡常数的方程,定量反映恒压下温度对化学平衡常数的影响。因不同温度时,饱和溶液中溶质的溶度积常数Ksp不同。在范特霍夫方程中,Ksp和绝对温度T的关系满足式(1),其中R为气体常数(R=8.314J/mol·K),ΔsolH为溶解热,I为常数。lnKsp与T的倒数呈直线关系[3],从所得直线的斜率即可计算求得相应溶质的ΔsolH。
针对氢氧化钙饱和溶液体系,固相和液相间存在动态平衡,如式(2)所示。式(2)表明,溶液中钙离子浓度为氢氧根离子浓度的一半,在一定温度下,获得溶液中的氢氧根离子浓度[OH-],便可据式(3)求得此温度时氢氧化钙的Ksp。
氢氧根离子浓度可通过溶液中的氢离子浓度间接求得。利用pH计可快速测定溶液的pH,进而计算求得溶液中的氢离子浓度[H+],见式(4)。借助相应温度下水的离子积常数Kw(T),据式(5)即可获得溶液中的[OH-]。
2 实验部分
2.1 实验准备
试剂:氢氧化钙(国药沪试,A.R.),纯水
仪器:恒温水浴锅,pH计,电子天平,移液管,50mL烧杯,250mL烧杯,玻璃棒
2.2 实验过程
(1)氢氧化钙饱和溶液的制备。
① 用电子天平称取1.00g氢氧化钙于250mL烧杯。
② 用100mL移液管量取100mL纯水于上述烧杯中。
③ 將此烧杯置于恒温水浴锅,并用玻璃棒不断搅拌。
(2)pH计校准。
① 将30mL左右pH分别为4.00,6.86和9.18的标准溶液注入三个50mL烧杯。
② 根据pH计校准操作指引,分别使用pH为4.00,6.86和9.18的标准溶液进行校准。
(3)氢氧化钙饱和溶液pH的测量。
① 将pH计玻璃电极浸没于氢氧化钙饱和溶液。
② 记录室温下溶液的温度和pH。
③ 打开恒温水浴锅的开关,温度设置提高3℃,达到设置温度后等待5min使系统平衡。
④ 确认pH计上显示的温度和pH保持稳定,记录此时溶液的温度和pH。
⑤ 重复步骤③和④,直到温度达到40℃左右。
3 结果与讨论
经过pH计校准,采用pH计测试法,测定三组氢氧化钙饱和溶液随温度变化的pH(见表1)。测试数据表明,随温度升高,溶液的pH呈下降趋势。
将测定的pH代入式(4)计算求得溶液中的[H+]。但是,计算相应温度下溶液中的[OH-],需要考虑到Kw(T)随温度而变化的特性。通过对文献中[4]不同温度下水的离子积数据进行多项式拟合,可以获得0℃到100℃间Kw(T)随T变化的经验计算式(式6)。
Kw(T)=4.30×10-21×T4+8.49×10-20×T3+2.71×10-18×T2+1.82×10-16×T+8.98×10-16(6)
图1中圆点为文献中实验数据,实线为多项式拟合结果,R2为1,表明此多项式能够较好描述Kw(T)和T之间的数学关系,可用此多项式计算求得0℃到100℃范围内实测温度下水的离子积。
基于实测温度下水的离子积,据式(5)计算求得相应温度下溶液中的[OH-],如图2所示。图2表明,随温度升高,氢氧根离子浓度逐渐减小。虽然B组数据在测定pH时出现一定偏差,但是数据变化趋势及曲线斜率和其他组数据保持一致,在后续计算溶解热时证明数据有效。根据溶液中氢氧根离子浓度的变化趋势,可以引导学生辅助理解氢氧化钙的溶解度随温度升高而减小的性质。
将氢氧根离子浓度[OH-]代入式(3),计算求得不同温度下氢氧化钙的Ksp,见图3。根据范特霍夫方程中lnKsp和绝对温度T的倒数之间的直线关系,从直线的斜率便可求得氢氧化钙的溶解热ΔsolH。如图4所示,点为实验数据,实线为基于范特霍夫方程的拟合结果。由图看出,虽然A组、B组和C组数据不能完全重合,但是直线的斜率基本保持一致。通过数据拟合,基于三组数据求得氢氧化钙的溶解热分别为-18.29kJ/mol(A组),-17.34kJ/mol(B组)和-19.48kJ/mol(C组)。溶解热平均值为-18.37kJ/mol,与文献中[5]报道的数据(-17.96kJ/mol)接近,说明测试和计算方法有效。
4 结语
理论和实践在真实应用情境下存在着不可分割的相互作用。在实践中,学生发现量热法不适合应用于热效应不明显的溶质溶解热的测定。发现问题后,引导学生采用新的理论方法解决实践中遇到的问题,潜移默化中使学生体会理论对实践的指导作用,以及实践对理论的反馈作用。
教学实施过程中,教师可以设置一些问题来评估学生的学习情况。比如,直接量热法测定氢氧化钙溶解热的缺点是什么?如何求得氢氧化钙的Ksp?用什么方法可以获得溶液中的氢氧根离子浓度?水的离子积是否受温度的影响?通过测试pH计算溶液中的氢氧根离子浓度需要注意什么?除了借助范特霍夫方程外,是否还有其他途径也可以获得氢氧化钙的溶解热?
通过为高中学生创建这一借助热力学理论方法测定氢氧化钙溶解热的课外实验学习项目,使学生从一个全新的途径来获得氢氧化钙的溶解热。同时,实验和求解过程有助于学生理解温度对氢氧化钙溶解度的影响——温度越高氢氧化钙的溶解度越小,溶液中氢氧根离子浓度越小。在计算氢氧根离子浓度時,为了获得更加准确的计算结果,需要认识到水的离子积随温度变化的性质。最终借助范特霍夫方程,获得难以通过实验直接测定的氢氧化钙溶解热。通过引导学生采用新的热力学理论来解决化学疑难问题,可以有效培养学生面对实践问题所应持有的正确态度,深化对理论和实践关系的理解,增强其解决问题的实际能力。
参考文献:
[1]陈瑞芝,申晓莉. 稀溶液与固体反应焓变的测量和校准[J]. 化学教学,2014,(4):48~51.
[2]陈瑞芝,申晓莉. 改进的热滴定法测量酸碱中和热[J]. 化学教学,2014,(7):59~62.
[3]陆根土. 氯化铅溶度积和溶解热的测定[J]. 化学教育,1982,(5):47~49.
[4]Haynes,W. M.. CRC Handbook of Chemistry and Physics[M]. CRC Press:Boca Raton,2017:5~70.
[5]Harry P., Hopkins Jr., Claus A. Wulff. The Solution Thermochemistry of Polyvalent Electrolytes. I. Calcium Hydroxide [J]. The Journal of Physical Chemistry,1965,69(1):6~8.
