硝酸性质实验的补充及其一体化改进
2024-01-16杨小琳何平
杨小琳 何平

摘要:为了完善硝酸性质实验和更方便地进行实验操作,在硝酸与铜反应的基础上,利用H型试管设计可普遍适用的“四区”反应装置,探究浓硝酸的分解、稀硝酸与活泼金属的反应原理。改进实验优点明显,可实现包括硝酸的强氧化性、不稳定性等多个性质实验的一体化,且试剂微量、操作简便、反应可控、教学增效。
关键词:硝酸性质实验;试剂微量化;实验一体化
文章编号:10056629(2023)12006803
中图分类号:G633.8
文献标识码:B
1 问题的提出
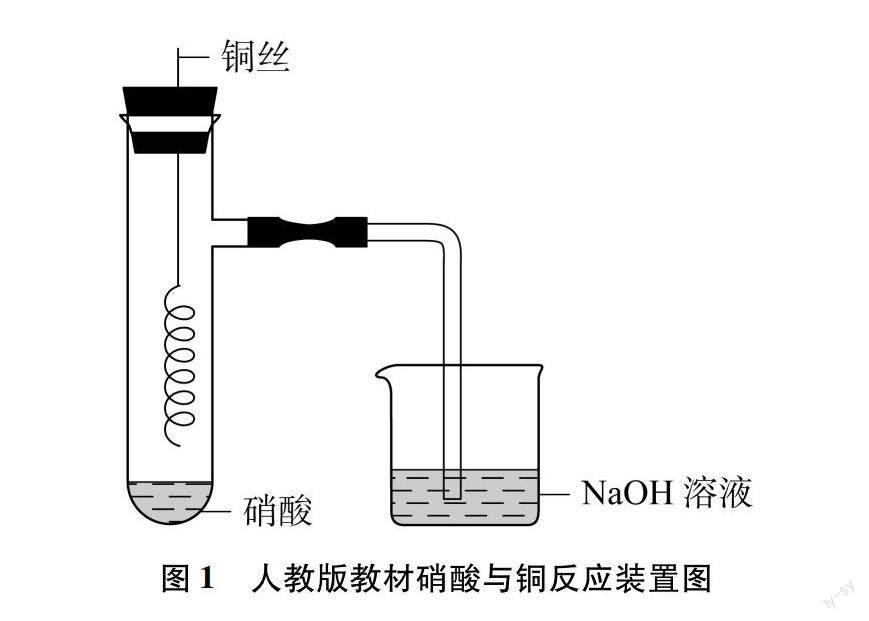
硝酸具有不稳定性、强氧化性、腐蚀性和酸性,学生容易通过类比硫酸性质学习硝酸的腐蚀性和酸性,但对其不稳定性和强氧化性难有全面直观的认识,且随着硝酸浓度的变化,其性质呈现较大的差异,因此硝酸的强氧化性是教学的重点和难点。人教版高中化学教材通过演示硝酸与不活泼金属(铜)的反应呈现其强氧化性。教材实验的演示装置见图1,向两支具支试管中分别加入2mL浓硝酸和稀硝酸,通过抽拉铜丝控制反应发生,用氢氧化钠溶液进行尾气处理,该实验存在几个明显的不足之处:(1)需要两套相同装置,且稀硝酸的制取需要用浓硝酸进行稀释;(2)反应产生的有毒气体通过导管后被氢氧化钠溶液吸收时压强减小,会出现倒吸情况;(3)未能解释铜与浓硝酸反应后溶液呈深绿色的原因;(4)没有对铜与稀硝酸反应生成的无色气体进行验证,且一氧化氮是不成盐氧化物不能被氢氧化钠溶液直接吸收,会释放到空气中,对环境造成污染。此外,教材中没有浓硝酸不稳定性的演示实验,学生理解起来较为抽象。基于此,我们在改进教材实验的基础上,补充了浓硝酸受热分解及稀硝酸与活泼金属(铁)的反应,并对反应的产物进行验证。
2 相关文献评析
为了解硝酸性质实验研究的进展与现状,我们查阅了相关的文献资料,发现对铜与浓、稀硝酸反应的研究较多,且主要是对实验装置的改进,如马东老师[1]设计的新型密闭装置“三通玻璃管”,利用压强差把水吸入小玻璃瓶中生成稀硝酸,可集铜与浓、稀硝酸反应和氮氧化物转化等多个实验于一体,且试剂微量化、产物绿色化,但美中不足在于该装置不能很好地控制反应的发生与停止;施雄飞老师[2]用倒转输液袋的方式使铜丝与硝酸分离,从而使反应停止,但为了观察到明显现象,硝酸用量较多;王瑾等[3]利用U形管进行改进,将生成的二氧化氮气体通过橡胶管进入另一侧加水生成稀硝酸,从而对比观察铜和浓、稀硝酸的反应,现象明显,药品用量少,但不足之处在于实验过程中需要借助针筒和止水夹调节装置内的压强,操作繁琐;还有一些教师则是针对其中一种氮氧化物的制备和性质检验进行微型化、定量化的创新设计与改进[4]。
综上所述,以上实验新方案均使笔者受益良多,但仍有需作改进的空间:(1)未深入探究硝酸的强氧化性:稀硝酸与活泼金属反应时是否生成氢气?变价金属与硝酸反应时会被氧化为哪种价态?在浓硝酸中滴加紫色石蕊溶液后是否一直呈红色?若无实验加以辅助理解,学生通过稀硫酸的性质类比推理,容易造成认知上的错误。(2)浓硝酸见光或受热分解产生二氧化氮是重要性质,然而在众多方案中没有涉及浓硝酸的不稳定性实验。(3)在现有的实验改进方案中,或多或少都存在些许不足,不能很好地在满足多个性质实验一体化的同时,还能兼顾到试剂微量化、操作简便化、反应可控化和教学增效等优点。基于此,我们利用H型试管设计了可普遍适用的“四区”(投料区、反应区、对照区、收集区)反应装置,再次对硝酸性质实验作了创新改进,进一步完善硝酸的性质实验,同时也有利于学生分组活动,引导学生以发展的眼光看待认知深化的过程,促进批判性思维的形成,培养宏观辨识与微观探析、科学探究与创新意识等化学学科核心素养。
3 实验改进
3.1 实验仪器及药品
仪器:18mm×180mm H型试管1个(中间横管18mm×50mm)、翻盖塞1个、气球1个、注射器4只(带针尖)、铁架台1个、胶头滴管2支、剪刀1把、酒精灯1个药品:浓硝酸(68%)、铜片、铁片、干燥剂(无水CaCl2)、紫色石蕊溶液、紫甘蓝浸出液、氢氧化钠溶液(20%)、硫氰化钾溶液(1mol/L)、蒸馏水
3.2 实验装置
改进后的实验装置见图2。
3.3 实验步骤
(1)将H型试管固定在铁架台上,在左侧试管中加入2mL浓硝酸,右侧试管中放入铁片和2~3滴紫甘蓝浸出液。将铜片剪成2cm×3cm后折叠成三棱柱型,用针尖在铜柱上穿一个小孔,并用线绳绑住,放置横管左侧处,用气球将线绳压住以固定铜柱。在针筒A中加入3mL蒸馏水。
(2)在左侧试管中滴加2~3滴紫色石蕊溶液和1颗干燥剂,盖上翻盖塞后,用酒精灯加热左侧试管。
(3)取下气球,将铜柱放置左侧试管中距离浓硝酸1cm处,右侧试管上端连接气球固定线繩。将H型试管向右倾斜,使铜柱与浓硝酸接触反应,当右侧试管充满气体后,将试管放正使反应停止。
(4)捏瘪气球,将试管向右倾斜一定角度,用注射器1沿试管壁和横管向右侧试管缓慢滴加蒸馏水,使其与右侧试管中的气体充分接触。反应一段时间后,用注射器2向右侧试管中滴加硫氰化钾溶液,用注射器3吸取气球内部的气体后吸入适量空气。
(5)用注射器4向右侧试管中注入适量氢氧化钠溶液,使反应停止。
(6)在左侧试管中加入少量水稀释,使铜柱与稀硝酸接触反应。
(7)尾气处理。用注射器1向H型试管中注入空气,再加氢氧化钠溶液,重复该操作数次,直至试管中的气体不再变为红色。
3.4 实验现象
(1)浓硝酸遇紫色石蕊溶液变为浅红色后很快退去。浓硝酸的漂白作用主要体现其强氧化性,且温度越高退色速度越快[5]。加热浓硝酸时有红棕色气体生成(反应的方程式为:4HNO3△4NO2↑+O2↑+2H2O)。浓硝酸分解实验要加少量干燥剂,因为市售浓硝酸的浓度只有68%,加热会使溶液沸腾产生硝酸蒸气,分解反应较难发生。而“发烟硝酸”很不稳定,在加热条件下极易分解,因此用无水CaCl2提高硝酸的浓度。
(2)铜与浓硝酸反应生成大量红棕色气体,铜柱表面附着蓝色物质,溶液变为深绿色[反应的方程式为:4HNO3(浓)+Cu====Cu(NO3)2+2NO2↑+2H2O]。反应生成的硝酸铜溶液中溶有大量的二氧化氮气体,因此溶液呈深绿色[6]。
(3)随后向右侧试管缓慢加水,可观察到红棕色气体消失,溶液变为橘红色,铁片上有无色气泡生成,加硫氰化钾溶液后变为血红色[反应的方程式依次为:3NO2+H2O====2HNO3+NO;4HNO3(稀)+Fe====Fe(NO3)3+NO↑+2H2O;Fe3++3SCN-====Fe(SCN)3]。用紫甘蓝浸出液检验稀硝酸的生成,是因为其富含花青素,花青素遇酸变红、遇碱变蓝,且变色范围比紫色石蕊溶液大,使实验现象更加明显,是优良的酸碱指示剂。
(4)注射器3中无色气体变为红棕色(反应的方程式为:2NO+O2====2NO2)。
(5)左侧试管的溶液稀释后,从深绿色变为浅蓝色,铜片上有无色气泡生成[反应的方程式为:3NO2+H2O====2HNO3+NO;8HNO3(稀)+3Cu====3Cu(NO3)2+2NO↑+4H2O]。在加水稀释的过程中消耗了溶液中的二氧化氮,转化为无色的稀硝酸,因此对硝酸铜颜色的观察不造成干扰,溶液恢复为浅蓝色。
(6)左侧试管中生成蓝色沉淀,右侧试管中生成红褐色沉淀[反应的方程式分别为:Cu2++2OH-====Cu(OH)2↓;Fe3++3OH-====Fe(OH)3↓]。
3.5 实验注意事项
(1)浓硝酸具有强腐蚀性和挥发性,在实验过程中要带橡胶手套小心操作,注意通风处理。
(2)铜柱尾端需折叠一定角度,才能更好地将铜柱放入横管左侧;浓硝酸分解实验时,观察到有红棕色气体产生即停止加热,防止其对铜与浓硝酸的反应现象造成干扰。
(3)为使铜柱表面附着蓝色物质从而验证铜离子的生成,需将铜片折叠成棱柱的形状,使其一侧与浓硝酸反应,铜离子附着在未反应的另一侧铜柱上。
(4)向右侧试管加水时要少量且缓慢操作,使水与二氧化氮充分接触,从而提高生成的稀硝酸浓度;铁与稀硝酸反应速率较慢,可用酒精灯短时间加热以保证合适的反应速率,以免溶液沸腾溢出,操作不安全。
4 实验改进的优点
(1)装置一体化。该装置集硝酸与不活泼金属(Cu)和活泼金属(Fe)的反应、氮氧化物的制备、检验、转化和尾气处理、浓硝酸受热分解等多个性质实验于一体,较全面地呈现了包括硝酸的强氧化性和不稳定性等性质。
(2)试剂微量化。浓硝酸有强腐蚀性,在保证实验安全和节约的原则下,本改进方案仅用2mL浓硝酸即可完成上述所有实验。
(3)反应可控。设计新的固液反应模型,通过倾斜和正放试管使固体与溶液接触和分离,从而控制反应的发生与停止。
(4)操作简便。利用H型试管设计可普遍适用的“四区”反应装置。该装置原理简单、实操性强,借助注射器加入所需试剂就可完成实验,可用于气体制备及其性质检验和对比实验,如探究浓硫酸性质实验、吸热反应与放热反应实验等,为教师课堂演示或学生分组实验提供了便利性。
(5)教学增效。一线教师可借助该实验加强学生学习元素化合物的一般方法,培养学生基于物质的分类、价类二维观、宏微符三重表征多维度的实验探究能力。
参考文献:
[1]马东,张贤金. 硝酸性质实验的一体化设计[J]. 化学教学,2017,(7):60~63.
[2]施雄飛. 铜与硝酸反应实验改进[J]. 中学化学教学参考,2022,(2):63~64.
[3]王瑾,王海红,梁素艳. 浓、稀硝酸与铜反应的绿色化、一体化实验改进研究[J]. 教育与装备研究,2020,(4):58~60.
[4]潘祥泰. NO的制备和性质实验的改进与创新[J]. 化学教学,2014,(2):44~45.
[5]夏立先,吴思杰. 对浓硝酸几种性质的实验探究[J]. 化学教学,2010,(10):9~10.
[6]谭圣涛,刘东哲,吴佳怡. 铜和浓硝酸反应所得溶液呈绿色的原因探究[J]. 中学化学教学参考,2016,(8):53~54.
