MR-T2 刀锋伪影校正技术联合扩散加权成像对局灶性机化性肺炎与周围型肺癌的鉴别诊断
2024-01-16党珊段海峰郭炎兵陈媛媛于勇于楠
党珊,段海峰,郭炎兵,陈媛媛,于勇,2,于楠,2*
1.陕西中医药大学附属医院医学影像科,陕西 咸阳 712000;2.陕西中医药大学,陕西 咸阳 712046;*通信作者 于楠yunan0512@sina.com
肺癌是我国发病率及病死率最高的癌症[1],早期准确诊断至关重要。机化性肺炎又称闭塞性细支气管炎机化性肺炎,是肺实质对各种病理条件(如感染或肿瘤)及各种物理和化学刺激的一种常见反应形式,发病率约1.96/10万[2]。局灶性机化性肺炎(focal organizational pneumonia,FOP)占机化性肺炎的10%~15%[3],表现为孤立的局灶性病变[4],其CT表现与周围型肺癌(peripheral lung cancer,PLC)有重叠。MRI可用于鉴别肺结节/肿块的良、恶性,并评估FOP的影像学特征[5]。刀锋伪影校正技术(BLADE)能有效抑制运动伪影;T2 BLADE序列具有中心k空间过采样的优点,可有效地降低呼吸运动和血管搏动伪影[6];且T2WI能定量评估病变内水含量,既往使用T2WI鉴别多部位肿瘤,但肺结节/肿块相关研究较少。此外,Fleischner协会立场文件指出,扩散加权成像(DWI)可用来鉴别肺结节的良、恶性,甚至在诊断肺结节方面优于FDG PET/CT[7];但机化性肺炎病变内脓肿与肺癌实性成分DWI均表现为高信号、表观扩散系数(ADC)低信号,而T2WI脓肿为明显高信号,联合DWI与T2WI可很好地鉴别两者。因此,本研究拟探索DWI联合T2对比度比(T2 contrast ratio,T2 CR)对FOP与PLC的鉴别诊断价值。
1 资料与方法
1.1 研究对象 回顾性收集陕西中医药大学附属医院2016年11月—2021年12月的FOP患者MRI图像。所有患者在活检前48 h行MRI检查。排除标准:①MRI检查禁忌证(心脏起搏器、铁磁植入物、幽闭恐惧症等);②MRI图像质量差。最终纳入36例FOP患者。FOP患者最常见的症状是咳嗽、咳痰、胸痛、发热、咯血、无症状、气短、乏力、高血糖。男27例,女9例,年龄39~80岁,其中单发病灶32例(1例有颌下腺癌病史),多发病灶4例(1例胃癌术后,1例直肠癌术后,1例无肿瘤史;1例为多处穿刺,其中一处为腺癌,有脓腔的病灶为FOP)。所有FOP患者均经CT引导下经皮穿刺活检证实,其中8例患者进行随访,CT示病灶减少或消失。
从253例经病理确诊的肺癌患者中选择36例年龄、性别及最大径与FOP组相匹配的PLC患者,男23例,女13例,年龄48~83岁。31例PLC患者经CT引导下穿刺活检证实,5例经外科手术切除。本组PLC中,腺癌22例,鳞状细胞癌5例,小细胞癌7例,巨细胞癌1例,腺鳞癌1例。本研究经陕西中医药大学附属医院伦理委员会批准(SZFYIEC-YJ-2019第[19]号),豁免患者知情同意。
1.2 仪器与方法
1.2.1 CT检查 使用GE Discovery CT 750 HD多层螺旋CT扫描仪,在吸气末屏气扫描。扫描参数:管电压80/140 kV,瞬时开关,管电流260 mA,旋转时间0.5 s/rot,矩阵512×512。使用层厚1.2 mm进行轴位图像重建。
1.2.2 MRI检查 使用Siemens MAGNETOM Skyra 3.0T MR扫描仪,18通道体线圈。扫描序列包括轴位radial VIBE、T2 BLADE及DWI,扫描范围自胸廓入口至肝顶平面。轴位radial VIBE:TR 2.79 ms,TE 1.39 ms,体素大小1.2 mm×1.2 mm×1.2 mm,翻转角5°,激励次数(NEX)1,矩阵320×320,视野380 mm×380 mm,扫描时间5 min 30 s;轴位T2 BLADE序列:TR 2 200 ms,TE 89 ms,层厚4 mm,翻转角103°,NEX 1,矩阵320×320,扫描时间2 min 55 s(具体扫描时间视患者呼吸状态决定);自由呼吸DWI(b=50、800 s/mm2):TR 7 100 ms,TE 58 ms,体素大小1.6 mm×1.6 mm×5.0 mm,翻转角5°;NEX 1(b=50 s/mm2)、4(b=800 s/mm2),矩阵400×320,视野380 mm×306 mm,扫描时间2 min 43 s。
1.3 图像分析 T2CR即肺结节/肿块的T2信号强度值与右侧菱形肌的T2信号强度值比值:对比度比(contrast ratio,CR)=肺结节信号强度(signal intensity,SI)/菱形肌SI[8]。由1名有21年经验的副主任医师和1名有10年经验的主治医师采用盲法测量T2CR及ADC值;测量时将尽可能大的感兴趣区放在病灶实性区域(DWI高信号、ADC低信号、T2WI非坏死区),避开坏死与血管,在不同层面测量3次取平均值。肺外周分布定义为:病变主要位于肺外1/3、肺尖或膈上的肺基底。
1.4 统计学分析 使用SPSS 24.0和GraphPad Prism 8.0.2软件。符合正态分布的计量资料以±s表示,使用独立样本t检验比较。使用组内相关系数(ICC)评估2名医师测量T2CR和ADC值的一致性。计数资料以例数表示,采用χ2检验。使用二元Logistic回归建立联合使用DWI与T2CR值的MR诊断模型,并比较两者单独使用及联合使用对FOP及PLC的鉴别诊断价值;使用受试者工作特征(ROC)曲线评估诊断敏感度、特异度、曲线下面积(AUC)及阈值;使用Delong检验比较单变量与联合变量的诊断效能,并计算假阳性率、假阴性率、真阳性率及真阴性率。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 72例患者病变最大径为1.0~8.4 cm,平均最大径(3.6±1.7)cm。所有患者一般状况见表1。两组间年龄、性别及最大径差异无统计学意义(P>0.05)。78%(28/36)的FOP位于肺外周,两组肺叶分布差异均无统计学意义(P>0.05)。

表1 FOP和PLC患者的一般资料及MRI参数比较
2.2 一致性检验 2名放射科医师对T2CR及ADC值测量的一致性好(ICC=0.951、0.955,P均<0.001)。
2.3 两组T2CR与ADC值的诊断效能 FOP组T2CR和ADC值显著大于PLC组(P均<0.001,表1)。典型FOP与PLC病例见图1、2。ROC曲线见图3,T2CR,ADC值的诊断敏感度、特异度、准确度、假阳性率及假阴性率见表2。ADC值鉴别两者敏感度最高,为91.7%;T2CR诊断两者特异度高,为91.7%。联合T2CR与ADC值(AUC为0.924、诊断准确度86.1%)较单独使用T2CR 可提高AUC 及诊断准确度(Z=3.078,P=0.002),与单独使用ADC相比,差异无统计学意义(P=0.149,Z=1.441)。T2CR及ADC值的阈值分别为2.29、1 048×10-6mm2/s。

图1 男,51岁,FOP。CT示左肺上叶结节,最大径约2.5 cm(A);T2WI示结节呈稍高信号,T2CR=2.86(B);DWI(b=800 s/mm2)示结节扩散受限不显著(C);ADC呈略低信号,ADC值为1 450×10-6 mm2/s(b=0、800 s/mm2,D)

图2 男,65岁,肺腺癌。CT示右肺上叶胸膜下结节伴空泡征(A);T2WI示结节呈较高信号,T2CR=2.19(B);DWI(b=800 s/mm2)示结节呈扩散受限更高信号(C);ADC图呈低信号,ADC值为1 014×10-6 mm2/s(b=0、800 s/mm2,D)

图3 ADC值、T2CR值及两者联合鉴别FOP与PLC的ROC曲线
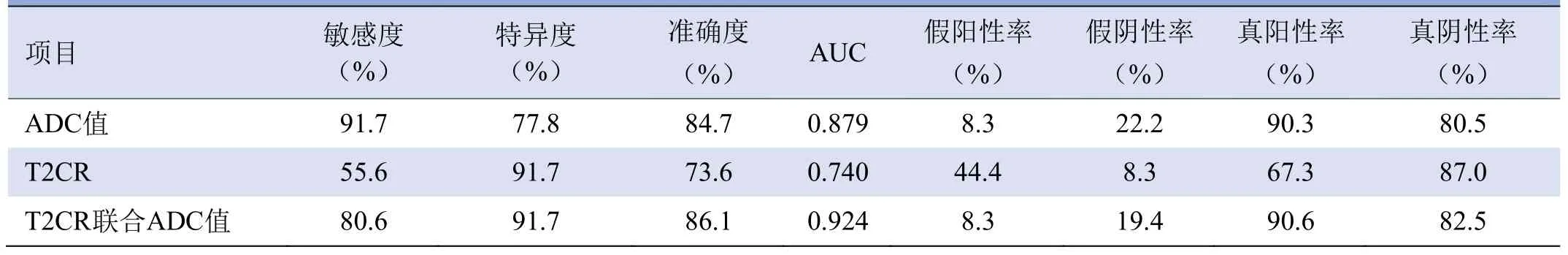
表2 T2CR、ADC对FOP与PLC的诊断敏感度、特异度、AUC及准确度
ADC值正确诊断FOP 33例(33/36,91.7%),PLC 28例(28/33,85.0%);T2CR正确诊断FOP 20例(20/36,56%),PLC 33例(33/36,91.7%)。T2CR联合ADC值正确诊断PLC 29例(29/36,80.6%),FOP 33例(33/36,91.7%)。
3 讨论
3.1 FOP的疾病特征 机化性肺炎的特点是肺泡导管和支气管内息肉样肉芽组织导致肺泡间隔增厚,以及不同程度累及细支气管的慢性炎症[9-10];部分患者无需治疗即可好转,部分患者经类固醇治疗有效。FOP的CT表现为单发结节或肿块,部分病变误诊为感染性病变并给予抗生素治疗,部分病变误诊为恶性肿瘤接受活检或手术切除。因此,早期正确诊断FOP至关重要。CT是评价FOP最常用的影像学方法,但有时很难区分FOP与PLC。本研究使用MRI定量评估FOP,发现更多FOP病灶位于肺外周,与既往研究一致[11-13]。这可能是因为外周肺组织支气管引流不畅,炎症消退缓慢且不完全。
3.2 FOP与PLC的DWI特征 DWI模型假设水分子的微观运动仅受水分子的影响,ADC值代表水分子的扩散情况。恶性肿瘤细胞增殖速度快,细胞排列紧密,水分子扩散受限程度高于良性肿瘤[14-15],故肺癌ADC值低于良性肺肿块及肺不张组织。Usuda等[16]使用MRI对314例肺结节/肿块的良、恶性鉴别诊断研究发现,肺癌ADC值显著低于良性肺结节/肿块,ADC阈值为1.470×10-3mm2/s;本研究中肺癌ADC值显著低于FOP,与其结果一致,但ADC阈值约1 048×10-6mm2/s,与既往研究结果有差异,可能与扫描参数、仪器及纳入病例等因素有关,且本研究FOP病例数量较少。
3.3 FOP与PLC的T2WI特征 T2WI可以很好地显示病灶内部成分信息,对显示囊性成分、坏死、富水区域等有明显优势。Petrillo等[17]研究发现,T2WI可鉴别乳腺肿瘤与良性病变,且乳腺癌T2WI信号强度低于良性病变;T2WI可预测子宫内膜癌的浸润深度[18];前列腺外周带T2低信号取代正常高信号是前列腺癌的特征,且定量T2值可区分前列腺癌和正常腺体组织或前列腺增生结节[19];T2WI信号强度可用于鉴别肾上腺乏脂型腺瘤与转移瘤[20]。本团队前期对365例肺结节/肿块的良、恶性鉴别诊断研究[21]发现,肺癌T2CR值明显低于良性肺结节/肿块,诊断阈值为2.14;该研究结果与本研究结论一致,而本研究诊断阈值约为2.29,可能与纳入病例不同有关,后期将进一步扩大样本量进行研究。本研究中,部分FOP患者形成脓肿,若仅使用DWI,脓肿与肺癌均会出现显著扩散受限,不易鉴别;而脓肿T2信号高,与肺肿瘤实性区域显著不同,故联合T2WI与DWI可以很好地鉴别。
3.4 多模态MRI的诊断效能及临床意义 MRI无辐射,对青少年、育龄期女性及孕妇、碘对比剂过敏等人群是一种安全的检查手段;对CT难以鉴别的孤立性肺结节/肿块,T2WI可额外提供病灶的内部成分信息,DWI可提供病灶内部功能信息。本研究中联合使用DWI与T2WI较单独使用两者可提高对FOP与PLC的鉴别诊断效能,与Usuda等[16]研究结果一致。临床工作中仅依靠放射科医师观察T2WI图像对病变进行判断,主观性较强;本研究定量测量FOP、PLC的T2CR与ADC值可很好地鉴别;较近年流行的影像组学方法临床易于推广,且临床实际工作中医师可通过观察病灶的形态学征象鉴别,进一步提高诊断效能,本研究组在今后的研究中将纳入MRI形态学征象。
3.5 本研究的局限性 首先,FOP组纳入样本量较小,PLC组与之匹配病例也较少,受限于该病本身发病率较低;在今后的工作中将继续搜集病例,扩大样本量;其次,本研究良性组仅纳入FOP,未纳入结节/肿块型肺结核及其他良性病变,今后的研究中将纳入多种良性病变。
总之,T2CR不仅可单独用来鉴别FOP与PLC;联合T2CR及ADC值可提高对两者的鉴别诊断能力,为放射科医师鉴别肺结节/肿块的良恶性提供客观的影像学依据,期待将来肺部MRI能更广泛地应用于该领域。
