基于静息态fMRI 的原发性失眠全脑功能连接密度的改变
2024-01-16任雪会刘瑜琳王金丽高瑞雪杨宏志张斌任小军杨如武常正伟
任雪会,刘瑜琳,王金丽,高瑞雪,杨宏志,张斌,任小军,杨如武,常正伟
1.西电集团医院医学影像科,陕西 西安 710077;2.武警陕西总队医院医学影像科,陕西 西安 710054;3.西安中医脑病医院医学影像科,陕西 西安 710032;*通信作者 常正伟 Changzhengwei000@163.com
原发性失眠是以频发且持久的入睡困难或难以维持睡眠引起的睡眠满意度不足为特征,且不能归因于医学、精神或环境等因素的一种睡眠障碍。长期失眠会导致各种健康问题,如糖尿病、免疫系统功能紊乱及注意力下降、记忆力衰退和执行功能降低等认知损害与情感障碍[1-2]。失眠的认知和生理模型揭示过度觉醒可能是原发性失眠的重要发病机制,脑电研究发现原发性失眠患者在睡眠周期的非快速眼动期大脑皮层觉醒度显著升高。近年来,基于血氧水平依赖的功能磁共振成像(functional magnetic resonance imaging,fMRI)技术的快速发展为神经精神相关疾病的机制研究提供了更多思路。相关研究发现原发性失眠患者左侧梭状回局部一致性明显升高,右侧小脑前叶和双侧扣带回局部一致性显著降低[3];且静息状态下其左前岛叶、右额中回、右额上回及前扣带等区域的低频振荡振幅显著降低,而左梭状回、左内侧颞叶和中央后回等区域的低频振荡振幅显著增加[4-5]。上述研究主要从功能分化角度考察原发性失眠患者局部脑区功能活动的变化,而忽略了大脑是由相互连接的神经元构成的复杂网络发挥作用[6]。在此背景下,本研究利用基于体素水平的图论度量值-功能连接密度(functional connectivity density,FCD)分析方法,拟从功能整合与功能分离两方面探讨原发性失眠患者大脑自发功能活动的改变,以尝试解释失眠发生、发展的病理生理基础及神经机制。
1 资料与方法
1.1 研究对象 依据《精神障碍诊断和统计手册》第5版(DSM-5)[7]的诊断标准,前瞻性收集2020年8月—2021年12月西电集团医院与西安中医脑病医院的原发性失眠患者,并通过网络形式在附近社区招募性别、年龄及受教育程度相匹配的无失眠症状的健康对照者。通过匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)、睡眠状况自评量表(self-rating scale of sleep,SRSS)、失眠严重指数(insomnia severity index,ISI)、焦虑自评量表(self-rating anxiety scale,SAS)及抑郁自评量表(self-rating depression scale,SDS)评估受试者的睡眠情况与精神状态。所有受试者排除幽闭恐惧症、精神类疾病、药物或酒精滥用史及严重器质性疾病等。受试者均无MRI相关禁忌证,常规MRI扫描脑部结构图检查正常,且均为右利手。共纳入原发性失眠患者35例(男19例,女16例),健康对照者35人(男18人,女17人)。本研究经西电集团医院临床试验伦理委员会批准(20210104-01号),受试者均签署知情同意书。
1.2 扫描方法 使用Siemens MAGNETOM Skyra 3.0T超导型MRI仪及8通道头线圈进行静息态脑功能数据采集。受试者采用仰卧位,使用橡胶垫固定头部、专用耳塞减少噪声。在数据采集过程中受试者均保持闭眼状态并禁止进入睡眠状态,尽量避免任何无关的思维活动。扫描参数:采用单次激励自旋平面回波成像序列,轴位扫描层数36,扫描角度平行于与前后联合连线,TE 30 ms,TR 3 000 ms,层厚3.5 mm,无间隔连续扫描,视野240 mm×240 mm,翻转角90°,矩阵64×64。共采集210个时间序列容积图像,总采集时间约7 min。
1.3 数据预处理 使用Matlab2016b软件调用DPABI 4.0(http://rfmri.org/dpabi)工具预处理分析fMRI数据。预处理步骤包括文件格式转化、移除前10个时间序列数据、时间校正、头动校正(剔除空间旋转超过1.5°、空间位移>1.5 mm的数据)、空间标准化、图像重采样(目标空间为3 mm×3 mm×3 mm)、去线性漂移、使用线性回归方法去除运动、白质和脑脊液信号对时间信号的影响及带通滤波(目标带宽为0.01~0.08 Hz)。在数据预处理基础上,利用BRANT(https://brant.brainnetome.org/en/latest/)工具计算FCD值,包括局部功能连接密度(short-range FCD)和全局功能连接密度(long-range FCD)。具体过程:首先利用Pearson相关分析、软件默认的相关阈值与信噪比阈值确定目标体素和其他体素的显著功能连接数,计算FCD图;然后将FCD值除以全脑所有体素的平均FCD值进行均一化处理,得到标准化的FCD图;最后对标准化的FCD图进行空间平滑(8 mm半高全宽高斯平滑)。
1.4 统计学分析 使用SPSS 24.0软件。符合正态分布的计量资料以±s表示,两组比较采用独立样本t检验;计数资料以率或构成比表示,组间比较采用χ2检验。利用统计参数图软件SPM12中的独立样本t检验比较两组受试的FCD值差异,使用FDR方法进行多重比较校正,将得到连续体素个数>20且同时满足经FDR校正后P<0.05的激活簇定义为差异有统计学意义的区域。使用Pearson相关分析对差异区域的FCD值与PSQI、SRSS、ISI、SAS及SDS进行相关性检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般结果 原发性失眠组PSQI、SRSS、SAS及SDS评分高于健康对照组(P<0.001),两组年龄、性别及受教育程度差异无统计学意义(P>0.05),见表1。

表1 原发性失眠组和健康对照组临床资料比较
2.2 两组FCD值比较 与健康对照组相比,原发性失眠组右侧脑岛、双侧前扣带回、左侧眶额中回、左侧背外侧额上回及双侧丘脑的long-range FCD值减少(P<0.05,FDR校正);而双侧颞中回、双侧楔前叶及右侧后扣带回long-range FCD值增加(P<0.05,FDR校正),见图1、表2。

图1 原发性失眠组与健康对照组FCD值存在差异脑区的分布

表2 原发性失眠组与健康对照组long-range FCD值有显著差异的脑区
与健康对照组相比,原发性失眠组右侧脑岛、双侧前扣带回、左侧背外侧额上回、左侧眶额中回、右侧内侧额上回及双侧丘脑的short-range FCD值明显减少(P<0.05,FDR校正);而右侧颞上回、左侧颞中回、双侧楔前叶及左侧后扣带回short-range FCD值明显增加(P<0.05,FDR校正),见图1、表3。
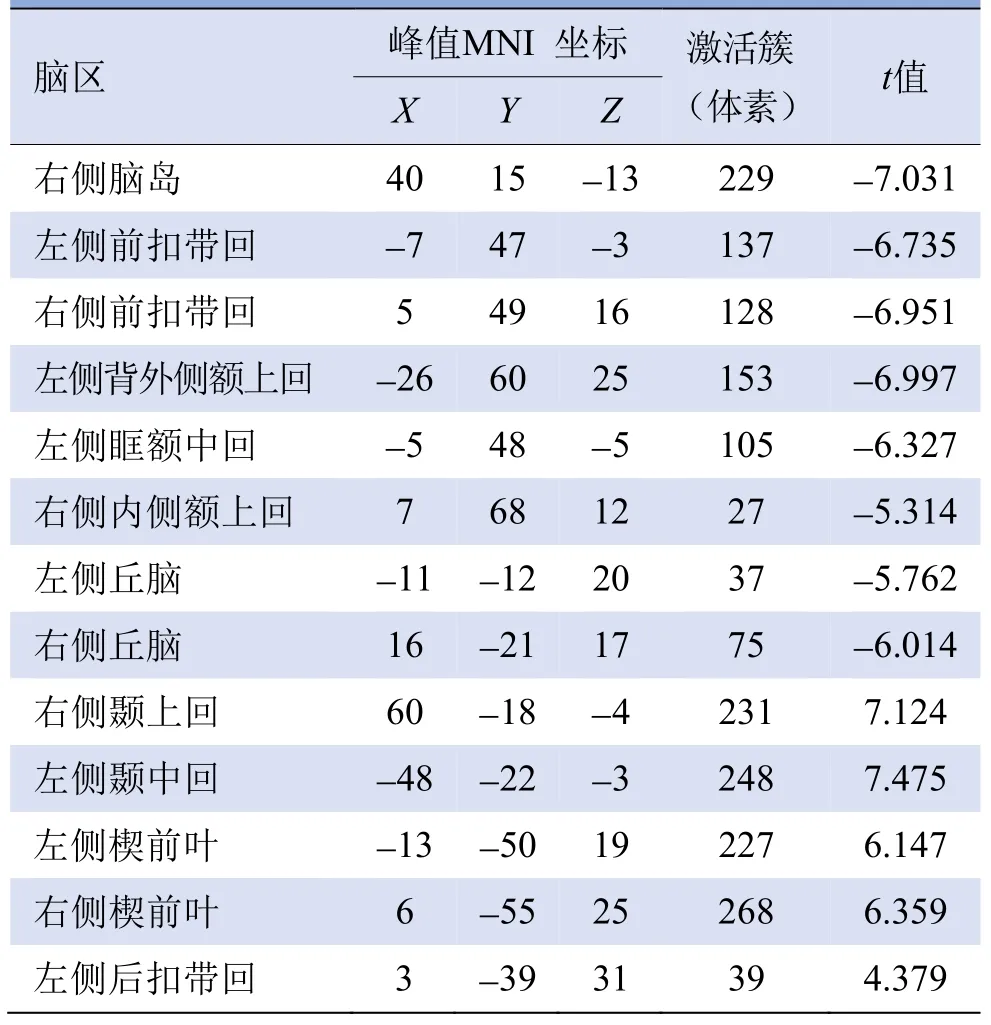
表3 原发性失眠组与健康对照组short-range FCD值有显著差异的脑区
2.3 原发性失眠组差异脑区FCD值与临床数据的相关分析 左侧丘脑(r=-0.620,P<0.001)、右侧丘脑(r=-0.562,P<0.005)、右侧脑岛(r=-0.651,P<0.001)的long-range FCD值与ISI呈显著负相关。其余脑区long-range FCD值、short-range FCD值均与PSQI、SRSS、SAS、SDS及ISI无显著相关,见图2。
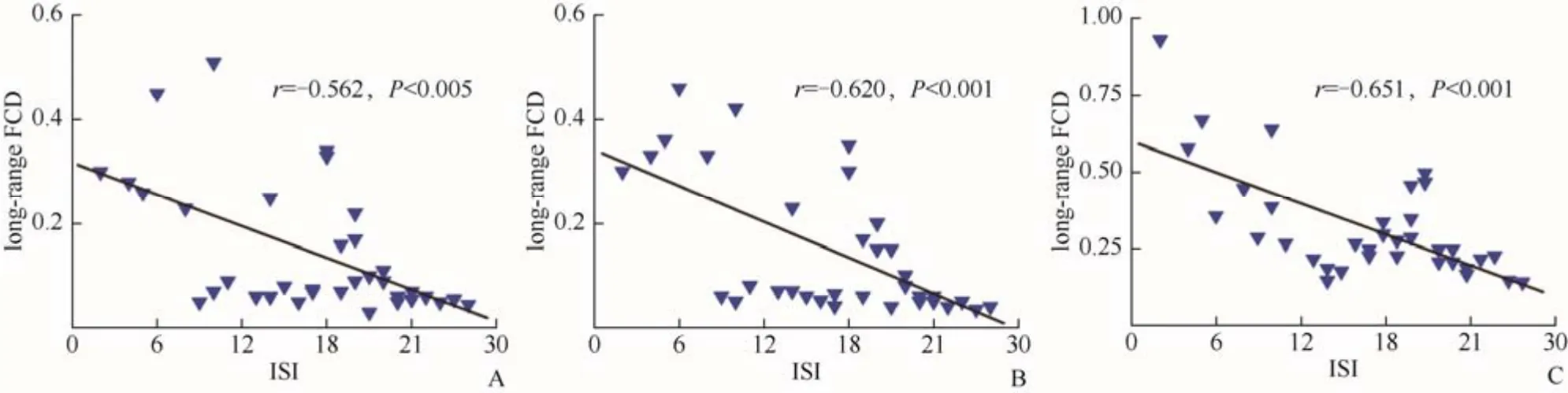
图2 右侧丘脑(A)、左侧丘脑(B)、右侧脑岛(C)FCD值与ISI的相关性
3 讨论
3.1 失眠对大脑自发活动的影响 作为一个复杂高效的信息处理系统,大脑由多个拥有独立功能的区域组成,同时这些区域又作为一个有机整体,相互作用、相互协调,以功能网络形式完成多种任务。既往fMRI研究大部分集中在大脑区域的功能异常或不同脑区间的功能连接变化,而忽略大脑作为一个整体在原发性失眠中可能受到的影响。相关研究表明原发性失眠患者行为、认知及情感功能改变与广泛分布的大脑区域及区域间的网络连接有关[8-11]。FCD值可从图论的角度反映大脑中不同体素的连接关系,可以细分为short-range FCD和long-range FCD,分别从功能分化及功能整合方面反映大脑神经元集群的自发活动[12-13]。因此,本研究借助FCD指标从功能分化与功能整合两方面探索原发性失眠患者大脑自发功能活动的改变。结果发现,与健康对照组相比,原发性失眠患者的FCD值在双侧前扣带皮层、双侧丘脑、右侧脑岛及左侧背外侧额上回等脑区显著降低,而双侧颞中回、双侧楔前叶及右侧后扣带回显著升高。其中,双侧丘脑与右侧脑岛的long-range FCD值与失眠严重程度显著相关。
3.2 丘脑异常激活与失眠的关系 根据过度觉醒理论,失眠患者睡眠状态难以维持或启动的原因在于一个完整睡眠-觉醒周期中机体的皮层和生理觉醒整体异常增加[10]。而丘脑在失眠、睡眠-觉醒节律调节、过度觉醒所起到的重要作用已经被越来越多的研究证实[14-15]。已有神经影像学研究表明,长期失眠或短期睡眠剥夺均可引起丘脑或涉及丘脑神经网络的功能、代谢或结构发生改变[9,16]。Nofzinger等[17]研究发现失眠患者丘脑灰质体积减小、夜间非快速眼动期与清晨清醒状态丘脑的代谢差异减小,Li等[8]研究发现失眠患者纹状体与丘脑的功能连接显著降低。本研究发现失眠患者双侧丘脑FCD值异常降低与失眠严重程度显著相关,提示丘脑作为觉醒系统的关键节点,其活动水平的改变可能影响睡眠的启动或维持。
3.3 失眠影响情绪、认知的中枢机制 岛叶是情感环路的重要组成部分,也是病理性焦虑的潜在生物学标记,并与紧张情绪的预支有关[18]。有研究发现,原发性失眠患者脑岛灰质密度减低[19],也有fMRI研究发现原发性失眠患者脑岛局部一致性明显降低[20]。同时作为情绪环路的重要环节,前扣带回的局部一致性在失眠患者中显著下降[20]。因此,笔者推测本研究发现的脑岛及前扣带回FCD值降低可能提示失眠患者情绪网络调节功能紊乱。而岛叶FCD值与失眠严重程度的相关也进一步验证了失眠对情绪的影响。前额叶是负责警觉性、注意力及高级认知功能的主要脑区。Altena等[21]通过任务态fMRI发现失眠患者在执行文字流畅度与分类任务过程中内侧前额叶、额下回等脑区的活动水平明显降低,而经缓解治疗后这些区域的活动恢复至正常水平。Lu等[22]通过图论分析发现失眠患者左侧额下回的节点效率与节点度值明显下降,且与失眠严重程度呈正相关。因此,本研究中双侧眶额回FCD值下降可能与原发性失眠患者认知功能及持续性注意力下降有关。
3.4 失眠对默认网络活动的影响 楔前叶与后部扣带回通常是默认网络的关键区域。楔前叶的葡萄糖代谢率约占整个默认网络代谢率的35%,是默认网络中最活跃的脑区,主要参与情景记忆、自传体记忆等多种认知功能[23-24]。后扣带回作为默认网络的核心节点,其葡萄糖代谢率比全脑平均代谢率高40%,且与机体的警觉性及注意力维持密切相关[25]。本研究发现原发性失眠患者楔前叶与后部扣带回FCD值异常增高,可能是机体通过代偿性提高静止状态下大脑活动水平,进而达到抑制过度觉醒神经活动的目的。颞叶主要负责大脑中多种感知觉信息的早期加工,与自我意识密切相关,是大脑产生自我意识及内察性意识活动的核心脑区[26]。因此,笔者推测原发性失眠患者颞中回FCD增高,可能是大脑通过增加能量输入增强感知觉信息加工及整合能力,从而维持过度觉醒下机体的清醒与警觉。
3.5 本研究的局限性 样本量较小,当前结果需要进一步在更大规模人群研究中进行验证;所招募受试者年龄段较局限,不能很好地代表广大人群;虽然FCD指标可以从功能分离与功能整合方面反映脑功能活动的变化,但并不是唯一的,其他指标如功能网络的全局与局部属性也可以反映大脑活动的变化,因此在后续分析中可以引入功能网络属性的研究。
原发性失眠患者丘脑FCD值异常降低,楔前叶与后部扣带回FCD值异常增高,可能与失眠患者的过度觉醒状态有关,而脑岛及前扣带回、颞中回FCD值异常增高则可能与情绪网络调节功能紊乱有关。以上发现不仅为理解失眠的病理生理过程提供了更多深入的见解,同时也为开发新的治疗策略提供了线索。
