纳米方钠石的制备及其载药抗菌性能
2024-01-15于亚鑫刘志刚王春梅杨立荣
于亚鑫,刘志刚,2,3,王春梅,2,3,杨立荣,2,3
(1. 华北理工大学材料科学与工程学院,河北 唐山 063210;2. 河北省无机非金属材料重点实验室,河北 唐山 063210;3. 河北省工业固废综合利用技术创新中心, 河北唐山 063210)
沸石是通过[SiO4]和[AlO4]连接形成的多孔框架结构材料,具有丰富的孔道结构及高比表面积。此外,沸石良好的生物相容性和低毒性,使其作为药物载体具有独有的优势[1-4]。与大分子药物载体相比,纳米沸石更易被细胞吸收,比表面积比普通沸石更大,载药量更多,因此更适合做药物载体。方钠石是微孔沸石的一种,是由β笼之间共用四元环或六元环的方式排列的体心立方结构,孔道为六元环,孔径为0.28[5-7],方钠石骨架中Si/Al为1.00左右,与高硅沸石相比具有更强的离子交换能力,但因其孔径小、孔道长,导致其传质速率低,无法充分发挥其较强的离子交换性和吸附性能力,因而应用受到限制。目前多通过方钠石纳米化提高其传质速率。Gilani等人[8]采用一步水热法制备了粒径在40~90 nm的纳米方钠石,可用于吸附去除污染废水中的阳离子染料(CV),具有低成本、去除CV效率高的特点。Kazemimoghadam等人[9]采用水热原位结晶法制备了羟基纳米方钠石膜,在乙醇/水混合物的分离中表现出很好的膜性能。Teow[10]成功合成了平均粒径为40~80 nm的纳米方钠石晶体,该材料具有良好的催化活性,对苯甲醛转化率为92%。
姜黄素是从姜黄根茎中提取的一种天然多酚化合物,有抗炎、抗氧化、抗恶性细胞增殖等作用。但是,姜黄素是疏水的多酚类物质,水溶性极差,因此其口服吸收率低、在体内的生物利用率低且代谢快。针对这些问题,目前大多选择具有较高孔隙率、良好热稳定性和化学稳定性、较高生物相容性和低毒性的沸石材料作为姜黄素载体。Zheng[11]合成纳米ZIF-8负载姜黄素用于抗炎、抗恶性细胞增殖;Karimi[12]用Y型沸石和ZSM-5负载姜黄素用于提高抗氧化性;Ahali[13]用A型沸石负载姜黄素以实现靶向治疗。
现有研究结果均显示,采用纳米沸石负载姜黄素后可以延长药物在人体内的停留时间、增强生物利用率,使得姜黄素活性最大化。但少有将纳米方钠石作为生物医药应用的相关报道。为此,在低温冰浴环境下制备方钠石凝胶前驱体,再经溶剂热法合成纳米方钠石,分析其结构和形貌,探讨载药温度、载药pH值和载药浓度等条件对其载药性能的影响,以确定其适宜的载药条件,并分析其抗菌性能,为其在生物医药领域的应用提供理论指导。
1 实验
1.1 样品制备
1.1.1纳米方钠石的制备
将一定量的NaOH与Al(OH)3溶液混合制备偏铝酸钠溶液,在冰水浴条件下加入正硅酸乙酯(TEOS)制备方钠石凝胶前驱体(NaOH、Al(OH)3和TEOS的摩尔比为4:1:1.2)。将前驱体加入正丁醇与乙醇的混合溶液中,定容为50 mL,将50 mL混合溶液置于100 mL聚四氟乙烯内衬的不锈钢反应釜中,90 ℃保温12 h,反应结束后,去离子水、无水乙醇超声清洗3次,最后,将样品置于50 ℃真空干燥箱干燥至恒重,得到纳米方钠石,标记为“SOD”。
1.1.2纳米方钠石负载姜黄素样品的制备
将0.02 g姜黄素加入10 mL无水乙醇,磁力搅拌10 min,记为A液。0.2g SOD加入90 mL配置好的pH为8.7的磷酸盐缓冲溶液中,磁力搅拌10 min,记为B液。将A液加入B液中搅拌10 min后,分别在20 ℃、35 ℃、50 ℃水浴搅拌6 h,得到不同温度负载姜黄素的纳米方钠石样品,分别标记为SOD-20、SOD-35、SOD-50。
将B液中磷酸盐缓冲溶液的pH分别设定为4.2、6.8和8.7,按照上述实验确定的最优载药温度,采用相同的制备过程合成不同载药pH负载姜黄素的纳米方钠石,分别标记为SOD-4、SOD-6和SOD-8。
1.2 样品载药性能测试
采用上海精密仪器仪表有限公司生产的752G紫外可见分光光度计,测量入射光λ为419 nm处每间隔1 h的上清液中的姜黄素吸光度,采用公式(1)和公式(2)计算各样品的药物包封量Q和包封率L。具体方法如下:
将0.02 g姜黄素药物溶于10 mL乙醇中,再放入90 mL配置好的磷酸盐缓冲溶液中,用紫外分光光度计,在入射光λ为419 nm时测量姜黄素的吸光度a。再将实验中每间隔1 h取到的上清液,用紫外分光光度计,在入射光λ为419 nm时测量纳米方钠石对姜黄素的吸光度b(每克载体中所含药物质量C为1 000 mg/g)。
Q=C×L
(1)
(2)
1.3 样品抗菌性能测试
3 g牛肉浸膏、5 g蛋白胨溶于100 mL去离子水中,用磷酸缓冲溶液调节pH至7.4,制得液体培养基。15 g琼脂粉、3 g牛肉浸膏、5 g蛋白胨溶于100 mL去离子水中,用磷酸缓冲溶液调节培养基pH值至7.4,加热至全部溶解制得固体培养基。在无菌操作台上取4 μL大肠杆菌菌落分别加入到4份100 mL液体培养基中,在37 ℃、120 rpm的摇床内培养48 h,制得细菌培养液。
称取0.2 g载药样品加入20 mL液体培养基中分散均匀,用移液枪取一定量分散均匀的溶液,滴入细菌培养液中制备载药菌液。将灭菌后的固体培养基在凝固前取出置于平板上,在紫外灯下灭菌,待固体培养基冷却凝固后,在每个平板上接种20 μL载药菌液,用涂布棒涂布均匀,测试样品的抗菌性能,采用紫外分光光度计,在入射光λ为419 nm时测定不同载体载药菌液的吸光度,采用公式(3)计算抑菌率:
(3)
式中:
U——样品的抑菌率,%;
a——无样品滴入细菌培养液后12 h的吸光度,nm;
c——载药样品滴入细菌培养液后12 h的吸光度,nm。
1.4 样品结构表征
采用日本Hitachi公司生产的SU8020型扫描电镜(scanning electron microscope,SEM)观察纳米方钠石颗粒的微观形貌;利用美国康塔公司生产的NOVA2000e氮吸附仪(brunaueremmettteller,BET)对样品进行氮气吸附-脱附测试,分析其比表面积和孔结构参数;采用日本岛津公司生产的XRD-7000型X-射线衍射仪(X-ray diffraction,XRD)分析纳米方钠石的晶体结构,辐射源为铜靶(λ=0.154 056 nm),衍射角(2θ)范围为5~90°,扫描速率和步长分别为10°/min和0.02°。采用Scherrer公式(4)计算晶粒尺寸:
(4)
式中:
D——晶粒尺寸, nm;K——常数,取值0.89;λ——X射线波长,取0.154 056 nm;β——衍射峰半高宽,°;θ——衍射角,°。
2 实验结果与讨论
2.1 SOD的结构表征
采用扫描电镜观察SOD样品形貌、通过X-射线衍射测试SOD样品的物相组成、利用多点氮吸附仪分析SOD样品的比表面积和孔结构特征,结果如图1所示。
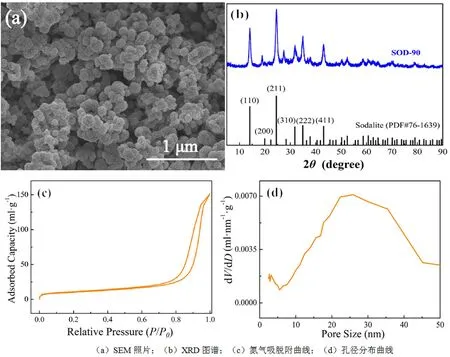
图1 纳米方钠石的结构表征结果
图1(a)显示,溶剂热法制备的SOD样品为由方钠石纳米晶体自组装而成的类球形纳米颗粒,颗粒粒径约为100 nm。XRD测试结果显示,SOD样品的衍射峰与方钠石的特征峰(PDF#76-1639)基本吻合,说明成功合成了纳米方钠石晶体见图1(b),采用公式(4)计算可知SOD样品的晶粒尺寸为13.4 nm。图1(c)为SOD样品的氮气吸附-脱附曲线。由图可知,制备SOD样品的吸附曲线属于V型,具有H3型滞后环。当相对压力P/P0介于0.6~1间时,脱附曲线出现明显的滞后环,说明样品中存在二次介孔结构;中压段(0.6
2.2 SOD的载药性能
2.2.1载药温度对SOD载药性能的影响
以SOD为载体,载药温度分别选择20 ℃、35 ℃和50 ℃,测试不同载药温度下SOD对姜黄素的包封量,结果如图2所示。由图可知,样品的药物包封量随载药时间延长,呈先增加后不变的趋势;载药温度升高,药物包封量增加。当载药温度分别为20 ℃和35 ℃时制备的样品,2 h后药物包封量均不变,最高药物包封量分别为64 mg/g和100 mg/g;载药温度为50 ℃时,5 h后药物包封量不变,最高包封量为367 mg/g。由此可知,载药温度为50 ℃时,纳米方钠石对姜黄素的包封量明显高于其他样品的载药量,主要是因为温度升高,分子热运动加快,利于姜黄素进入SOD孔结构孔隙中,增加了药物的负载量。
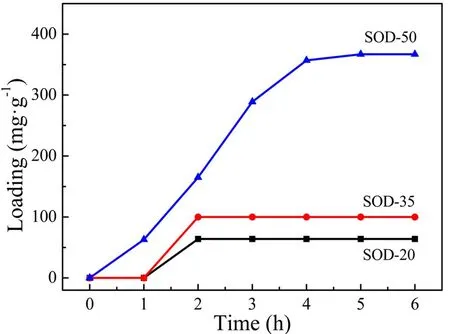
图2 不同载药温度时SOD负载姜黄素样品的包封量
为了探究SOD负载姜黄素药物的位置及载药前后样品孔结构的变化,对不同载药温度制备的SOD负载姜黄素样品进行氮气吸附-脱附测试,结果如表1和图3所示。由表1可以看出,与未载药的SOD样品相比,载药后的SOD-20和SOD-50样品比表面积和孔容都减小。图3(a)显示,SOD-50样品的氮气吸附量低于SOD-20和未载药的SOD样品,表明SOD-50样品的药物吸附量高于SOD-20。孔径分布显示见图3(b),与未载药样品SOD相比,SOD-20和SOD-50样品在20~45 nm的孔径曲线基本持平,说明药物大多吸附于20~45 nm的介孔中。5~15 nm的孔径曲线明显升高,说明药物进入20~45 nm的介孔后,并未完全填充孔道,填充后为5~15 nm的介孔。因此,载药温度为50 ℃时,SOD负载姜黄素的吸附量比20 ℃大,且在20~45 nm的介孔中负载的药物更多。

表1 不同载药温度时SOD负载姜黄素样品的BET测试结果
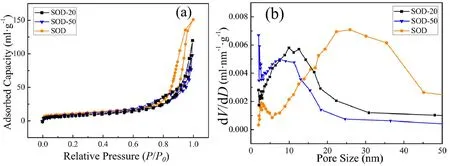
图3 不同载药温度制备样品的氮气吸附-脱附曲线(a)和孔径分布曲线(b)
2.2.2载药pH对SOD载药性能的影响
以SOD为载体,固定载药温度为50 ℃,载药pH分别选择4.2、6.8和8.7,测试不同载药pH下SOD对姜黄素的包封量,结果如图4所示。由图可知,载药时间延长,样品的药物包封量呈先增加后不变的变化趋势,载药pH对样品的药物包封量有较大影响。当pH=6.8时,最高包封量为63 mg/g;pH=8.7时,最高包封量为367 mg/g;而pH=4.2时,最高包封量为857 mg/g,包封率高达86%。这可能是因为纳米方钠石呈电中性,酸性和碱性环境更利于除去孔径中杂质,利于吸附药物。而酸性环境下药物包封量明显高于碱性环境,可能因为纳米方钠石合成液相是碱性的,在制备过程中已经溶出杂质,因此,酸性环境负载药物时更利于进一步溶出大量杂质,使载体负载更多药物。
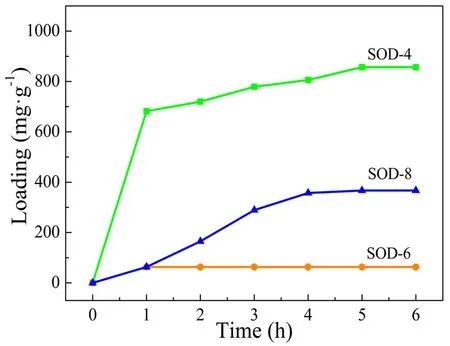
图4 不同载药pH时SOD负载姜黄素样品的包封量
为了进一步探究SOD负载姜黄素药物的位置及载药前后孔结构的变化,对不同载药pH制备的样品进行氮气吸附-脱附测试,结果见表2和图5。由表2可以看出,载药pH为4.2时制备SOD-4样品的比表面积和孔容明显小于SOD-8和未载药样品SOD,平均孔径明显大于SOD-8,说明SOD-4的药物负载量明显大于SOD-8,与图4结果相符。

表2 不同载药pH时SOD负载姜黄素样品的BET数据
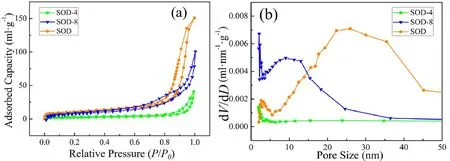
图5 不同载药pH制备样品的氮气吸附-脱附曲线(a)和孔径分布曲线(b)
图5(a)为不同载药pH制备样品的氮气吸附-脱附曲线。由图5(a)可知,pH为4.2时制备SOD-4样品的氮气吸附量远低于SOD-8和未载药的SOD样品,表明SOD-4吸附姜黄素药量远高于SOD-8。图5(b)显示,载药pH为8.7时,与SOD相比,SOD-8样品中的药物大多吸附于15~45 nm的介孔中,而该样品在2~15 nm范围的孔径曲线明显,说明药物进入15~45 nm的介孔但并未完全填充孔道,填充后大多产生2~15 nm的介孔。载药pH为4.2制备的SOD-4样品,药物大多吸附于其2~45 nm的介孔中,吸附药物后孔径曲线持平。上述结果说明,酸性环境比碱性环境更利于纳米方钠石孔结构中的杂质溶出,增加载药孔径范围,与图4的结果一致。
2.2.3载药浓度对SOD载药性能的影响
分别制备浓度为100 mg/L、200 mg/L和300 mg/L的姜黄素溶液,选取载药温度和载药pH分别为50 ℃和4.2,制备不同载药浓度的纳米方钠石负载姜黄素样品,分别标记为SOD-100、SOD-200和SOD-300,测试其对姜黄素的包封量,结果如图6所示。由图可知,载药时间延长,药物包封量呈增加的趋势。SOD-100、SOD-200和SOD-3003个样品的最高包封量分别为845 mg/g、857 mg/g和850 mg/g,包封率分别为85%、86%和85%。由此说明,姜黄素药物浓度对纳米方钠石的载药性能影响较小。
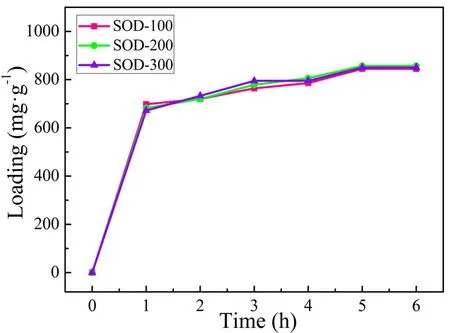
图6 不同药物浓度时SOD负载姜黄素样品的包封量
2.3 SOD的抗菌性能
由上述研究结果可知在载药温度为50 ℃、载药pH为4.2时制备的SOD-4样品对姜黄素的包封量最高,称取0.2 gSOD-4载药样品按照1.4描述过程测试其抗菌性能,结果如图7所示。图7显示,SOD-4样品的培养皿中可以清晰看到样品稀释液,仅存极少个大肠杆菌菌落,而无载药样品的对照样中则存在大量的大肠杆菌菌落,说明SOD-4样品具有较好的抗菌性。按照公式(3)计算得到SOD-4样品的抑菌率为91.4%,证实该样品具有较高的抗菌性,与图7结果相一致。
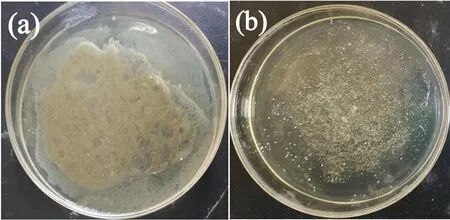
图7 SOD-4(a)和无载药样品(b)的对照样的抗菌性测试结果
3 结论
(1)以正硅酸乙酯为硅源,氢氧化铝为铝源,通过溶剂热法制备了纳米方钠石,以其为药物载体负载姜黄素,考察了载药温度、载药pH、载药浓度等因素对其载药性能的影响,探讨了其抗菌性。
(2)溶剂热法制备纳米方钠石的晶粒粒径大约13.4 nm。作为姜黄素的药物载体,其适宜的载药条件为:载药温度为50 ℃、载药液相pH为4.2,该条件下纳米方钠石显示出较好的载药性能和优异的抗菌性,药物大多吸附于其2~45 nm的介孔中,最高药物包封量可达857 mg/g,包封率为86%,抑菌率高达91.4%。
