拮抗猕猴桃腐败菌酵母的分离与鉴定
2024-01-15刘昂张妤婕董柏余姚秋萍冯瑶朱德全
刘昂 张妤婕 董柏余 姚秋萍 冯瑶 朱德全

基金项目:贵州省教育厅特色领域项目(黔教合KY字(2021)062)。
作者简介:刘昂(2000—),女,山东菏泽人,硕士在读。研究方向:微生物药学。
通信作者:朱德全(1980—),男,贵州遵义人,博士,副教授。研究方向:微生物与发酵工程。E-mail:zdqoliver
@163.com。
摘 要:猕猴桃具有丰富的维生素和生物活性物质,具有较高的食用和药用价值。然而,由于其皮薄多汁,猕猴桃采摘后容易腐败。研究表明,导致猕猴桃腐败的主要病原菌是葡萄坐腔菌(Botryosphaeria dothidea)和间座壳菌(Diaporthe phaseolorum),其次是灰葡萄孢菌(Botrytis cinerea)。酵母菌是较好的果蔬采后生防菌,对引起果蔬采后病害的病原菌具有很好的拮抗作用。本研究从传统发酵食品和水果表面分离纯化酵母菌株,并以灰葡萄孢菌和葡萄坐腔菌为指示菌,采用平板对峙法筛选出对这两种菌具有抑菌活性的酵母菌菌株。一共分离纯化了19株酵母菌,筛选出5株对灰葡萄孢菌和葡萄坐腔菌具有良好抑菌活性的酵母,分別为YMF-a、PJ1、SC、MG、JJ。其中,酵母菌YMF-a表现出最显著的拮抗效果,对葡萄坐腔菌和灰葡萄孢菌的抑制率均超过60%。通过菌体和菌落形态及26S rDNA序列分析鉴定,鉴定YMF-a、PJ1、SC、MG、JJ为文莱毕赤酵母(Pichia bruneiensis)、季也蒙迈耶氏酵母(Meyerozyma guilliermondii)、热带假丝酵母(Candida tropicalis)、文莱毕赤酵母(Pichia bruneiensis)和膜醭毕赤酵母(Pichia membranifaciens)。本研究筛选和分离的拮抗酵母为开发猕猴桃的生物保鲜剂奠定基础。
关键词:猕猴桃;筛选鉴定;拮抗酵母;生物防治
Screening and Identification of Antagonistic Yeast of Kiwi Spoilage
LIU Ang1,2, ZHANG Yujie1,2, DONG Boyu1,2, YAO Qiuping1,2, FENG Yao1,2, ZHU Dequan1,2*
(1.School of Ethnic-Minority Medicine, Guizhou Minzu University, Guiyang 550025, China;
2.Key Laboratory of Guizhou Ethnic Medicine Resource Development and Utilization, Guizhou Minzu University, State Ethnic Affairs Commission, Guiyang 550025, China)
Abstract: Kiwifruit is known for its abundant vitamins and bioactive substances, and has high edible and medicinal value. However, due to its thin and juicy skin, it is prone to decay after harvesting. Studies have shown that the main pathogens causing kiwifruit decay are Botryosphaeria dothidea and Diaporthe phaseolorum, followed by Botrytis cinerea. Yeast is an excellent post-harvest biocontrol agent for fruits and vegetables, with good antagonistic effects on pathogenic microorganisms that cause post-harvest diseases. In this study, yeast strains were isolated and purified from traditional fermented foods and fruit surfaces, and using Botrytis cinerea and Botryosphaeria dothidea as indicator bacteria, and yeast strains with antibacterial activity against Botrytis cinerea and Botryosphaeria dothidea were screened using a plate confrontation method. A total of 19 yeast strains were isolated and purified, and 5 yeast strains with good inhibitory activity against Botrytis cinerea and Botryosphaeria dothidea were selected, namely YMF-a, PJ1, SC, MG, and JJ. Among them, the yeast strain YMF-a showed the most significant antagonistic effect, with inhibition rates against both Botrytis cinerea and Botryosphaeria dothidea exceeding 60%. Through morphological and 26S rDNA sequence analysis, YMF-a, PJ1, SC, MG, and JJ were identified as Pichia bruneiensis, Meyerozyma guilliermondii, Candida tropicalis, Pichia bruneiensis, and Pichia membranifaciens, respectively. The screening and isolation of antagonistic yeast in this study lay the foundation for the development of biological preservation agents for kiwifruit.
Keywords: Kiwi; screening and identification; antagonizes yeast; biocontrol
獼猴桃又称奇异果、狐狸桃等,属于双子叶植物的猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)[1]。猕猴桃属为呼吸跃变型果实,采后容易腐烂软化。在果实生长后期至储运期,常发生猕猴桃软腐病,是影响采后贮藏品质的主要真菌性病害之一,也是导致采后贮运损失的重要因素之一[2]。研究表明,引起猕猴桃腐烂的致腐微生物主要为真菌。李诚等[3]从江西省奉新县猕猴桃中分离鉴定出葡萄座腔菌(Botryosphaeria dothidea)、拟茎点霉菌(Phomopsis sp.)为主要病原菌。雷霁卿等[4]和潘慧等[5]通过调查研究红阳猕猴桃病果,发现导致软腐病的病原菌主要有葡萄座腔菌(Botryosphaeria dothidea)、拟茎点霉菌(Phomopsis sp.)、间座壳菌(Diaporthe sp.)和链格孢菌(Alternaria alternata)等。石浩[6]在软枣猕猴桃中分离鉴定出子囊菌门中主要的优势病原菌为葡萄座腔菌属(Botryosphaeia dothidea)和间座壳菌属(Diaporthe phaseolorum)。杨帅[7]认为猕猴桃中主要的优势病原菌为灰葡萄孢菌(Botrytis cinerea),该菌严重威胁果蔬产量和品质安全。
酵母是指一类可以发酵糖类物质的真核微生物,广泛存在于果实表面、叶片、根部、土壤和海水等环境中。拮抗酵母可通过体外和体内方法进行拮抗菌的筛选与分离[8-9]。大量研究表明,酵母具有很高的拮抗潜力。DA等[10]利用体内和体外筛选方法,从土壤、树叶、花朵和柑橘类水果中分离出对意大利青霉菌具有很高预防和治疗应用潜力的酵母。IGNATOVA等[11]从豆科植物下收集的深色栗子土壤中筛选出了10种可以抑制植物病原真菌生长发育的酵母菌株。朱寒冰等[12]从191株酵母中筛选出17种对腐败菌具有拮抗作用的酵母菌。范先敏[13]通过筛选发现了
5株对猕猴桃软腐病菌生长具有抑制作用的生防菌株。郭虹娜[14]研究发现拮抗酵母挥发物可以抑制灰葡萄孢菌的菌丝生长。
本研究旨在通过体外拮抗实验筛选出具有拮抗猕猴桃腐败菌潜力的酵母菌株,并结合菌株形态特征观察和分子生物学方法进行鉴定。希望为猕猴桃的生物保鲜提供支持,并为开发猕猴桃贮藏保鲜的酵母生防制剂提供一定的参考依据。
1 材料与方法
1.1 实验材料
1.1.1 菌种
(1)供试病原菌:灰葡萄孢菌(Botrytis cinerea)和葡萄坐腔菌(Botryosphaeria dothidea),购于菌种保藏中心。
(2)酵母菌:从醪糟、酸菜、炸肉、泡椒、糟辣椒、玉米面粉发酵面团等各种发酵食品和水果店采购的苹果、草莓、金桔、雪梨、芒果、紫提子等水果以及番茄、南瓜等表面分离酵母菌。
1.1.2 培养基
马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA)、马铃薯葡萄糖肉汤(Potato Dextrose Broth,PDB)、麦芽汁琼脂培养基、麦芽汁培养基,上海博微生物科技有限公司。
1.1.3 仪器与设备
电热恒温培养箱(DH6000BII),天津市泰斯特仪器有限公司;洁净工作台(SW-CJ-2FD),苏州安泰空气技术有限公司;生物显微镜(Motic BA200),重庆奥普光电技术有限公司;立式压力蒸汽灭菌锅(LDZX-50KE),上海申安医疗器械厂;高速冷冻离心机(X1R),赛默飞世尔科技(中国)有限公司;电热恒温鼓风干燥箱(DH-101-2AB),天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 酵母菌分离
将醪糟、酸菜、炸肉、两种泡椒、糟辣椒、玉米面粉发酵面团和自然发酵的雪梨、紫提子、芒果、苹果、番茄、南瓜、金桔、草莓、青提表皮分别取一点放入小烧杯中,经无菌水浸泡后在麦芽汁琼脂培养基上涂布,28 ℃条件下培养2~3 d。随后,分离纯化以获得酵母菌,并编号为LZ-A、LZ-B、SC、ZR、PJ1、PJ2、ZLJ、YMF-a、YMF-b、XL、TZ、MG、PG、FQ、NG、JJ、CM。
1.2.2 酵母菌保藏
将纯化好的酵母菌接种于PDB培养基中培养3~5 d,并且传2~3代,传好代后的菌液振荡、离心,菌体附着在离心管底部,倒掉上清液,加入含30%甘油的麦芽汁培养基,将菌液振荡均匀放置于-80 ℃冰箱保存。
1.2.3 腐败菌活化
将病原菌菌块接种到新的PDA培养基上,使菌丝面与培养基紧密接触,放入预设温度为28 ℃的恒温培养箱培养5~7 d,备用。
1.3 病原菌形态特征观察
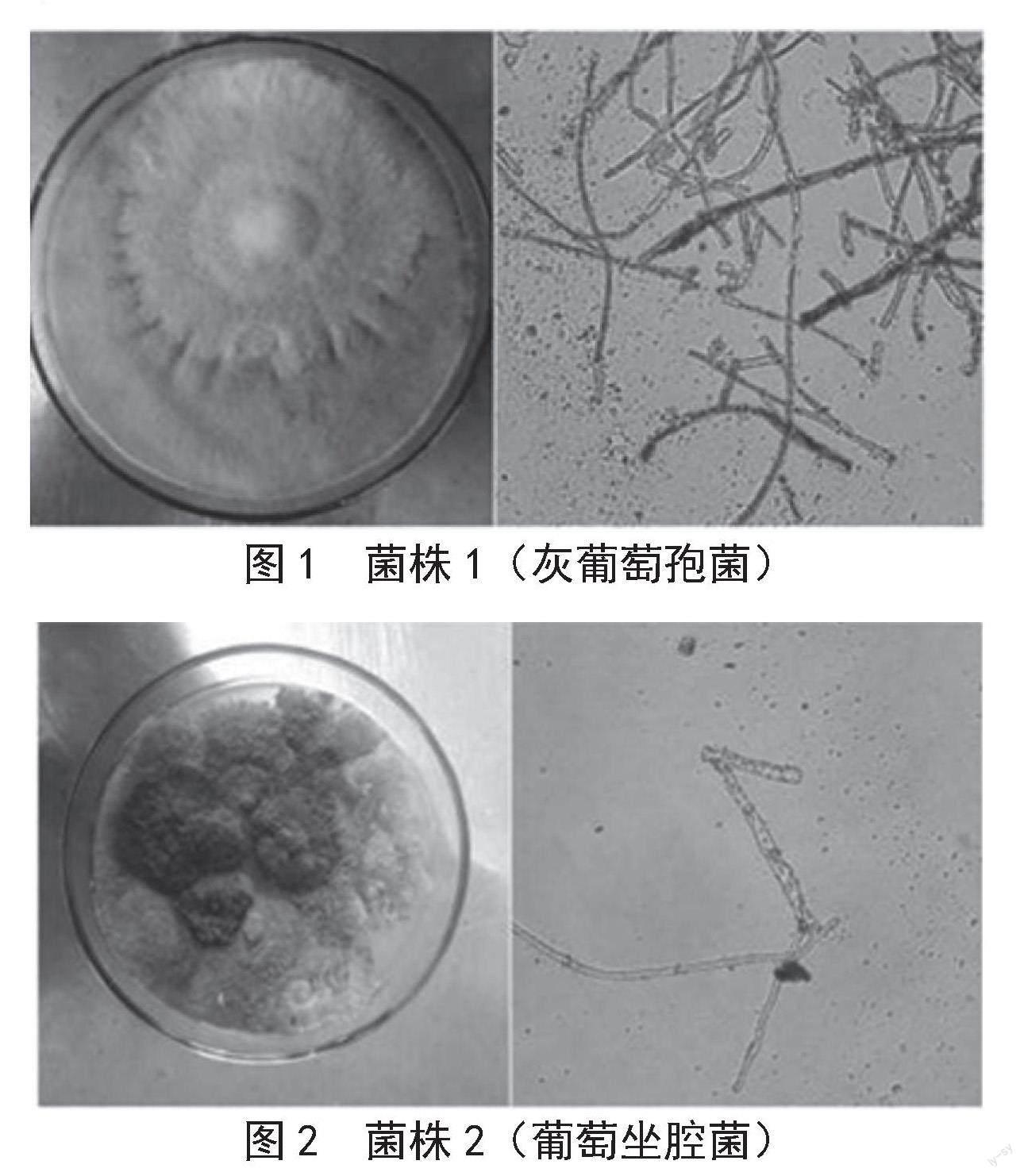
将分离纯化后的病原菌菌株转移至PDA平板,菌株1呈淡淡的淡褐色,菌丝密集,生长蔓延至培养基边缘;菌丝有隔膜,呈分枝状,附着有孢子,符合灰葡萄孢菌性状,见图1。菌株2的菌丝生长稠密,且菌丝生长初期为白色棉絮状,后期为浅灰色或灰黑色的菌丝,并且向平板边缘蔓延生长;菌丝有隔膜,产生分支,培养10 d后产生孢子,符合葡萄坐腔菌性状,见图2。
1.4 拮抗酵母菌的筛选与鉴定
1.4.1 拮抗酵母菌的初筛
利用平板对峙法,将培养5~7 d的灰葡萄孢菌和葡萄坐腔菌分别置于PDA培养基上,在PDA平板的中央接种直径为6 mm的病原菌菌饼,并距离该菌饼2 cm处接种同等直径的酵母菌菌块,在平板底部划线将培养基均匀划分成4块,按照上述操作方法将4种不同来源的酵母接种于培养基上,菌面朝下让酵母菌与培养基紧密接触。操作完成后用封口膜密封平板,28 ℃恒温培养箱培养3~5 d。再对腐败菌有抑制效果的酵母菌进行进一步筛选。
1.4.2 拮抗酵母菌的復筛
利用平板对峙法,将培养5~7 d的灰葡萄孢菌和葡萄坐腔菌菌丝生长边缘打孔制得直径6 mm的菌块,将这些菌块在距离PDA培养基中心2 cm处,菌丝面朝下接种于PDA培养基上。将初步筛选出的酵母菌接种于含有PDA的液体培养基中,28 ℃条件下培养3~5 d。用移液枪吸取100 μL菌悬液,并将其浸泡在无菌、直径为6 mm的滤纸片上,然后将滤纸片接种在距离培养基中心2 cm处,同时使用浸泡无菌水的滤纸片作为对照。接种完毕后用封口膜将平板密封,放入28 ℃的恒温培养箱培养7~10 d。计算酵母对灰葡萄孢菌和葡萄坐腔菌的抑制率,计算公式:相对抑制率=(空白对照组直径-实验组直径)/空白对照组直径×100%。
2 结果与分析
2.1 拮抗酵母菌的初筛
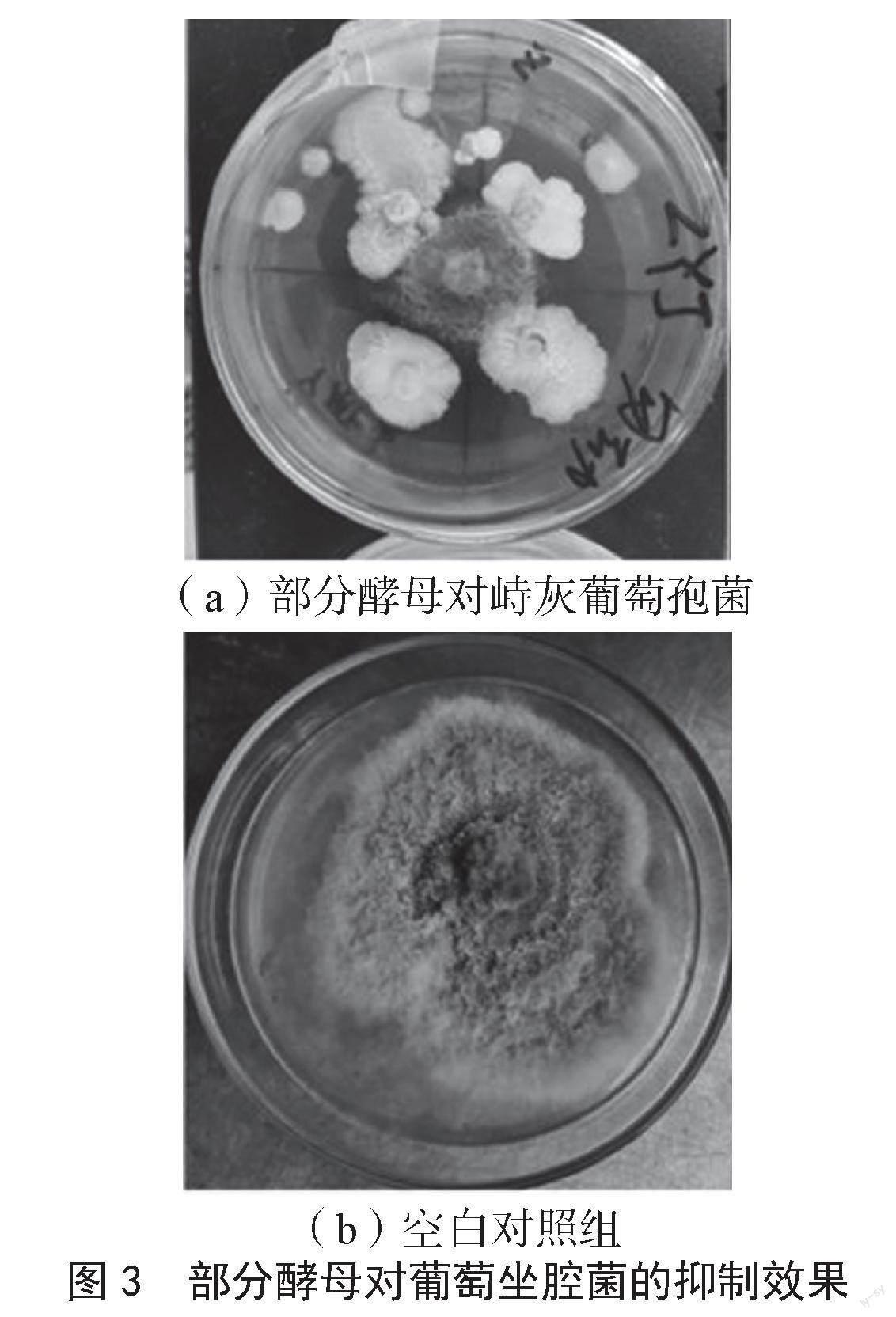
通过拮抗酵母的初筛实验,结果显示分离纯化的各种酵母菌均对灰葡萄孢菌和葡萄坐腔菌有抑制作用(图3)。
2.2 拮抗酵母菌的复筛
对初筛出的酵母菌进行单板对峙复筛,测量并观察两种猕猴桃腐败菌的生长直径,并计算拮抗酵母对每种腐败菌的相对抑制百分比,以评估19种酵母对这两种菌的拮抗活性。结果如表1所示,有18种酵母对灰葡萄孢菌的相对抑制程度大于或等于20%,有16种酵母对葡萄坐腔菌的相对抑制程度大于或等于20%。
2.3 酵母菌的鉴定
2.3.1 酵母菌菌落和细胞形态观察
通过初筛实验,得出以下13株有明显抑制效果的菌株,所以对这13种菌株的菌落形态和细胞形态进行进一步鉴定。将13株真菌进行分类,共分为5类,分别为A类(PJ1、PJ2、CM、MG、JJ、XL)、B类(TZ、SC、YMF-a、FQ)、C类(NG)、D类(ZLJ)、E类(PG)。以上5类酵母菌的形态学特征如表2所示,显微镜观察见图4。
2.3.2 拮抗酵母菌的分子生物学鉴定与分析
通过平板对峙实验,19种酵母中,YMF-a、PJ1、SC、MG、JJ这5株酵母对灰葡萄孢菌和葡萄坐腔菌都有较好的抑制效果(相对抑制程度均≥40%)。根据DNA试剂盒说明书[15]提取5株酵母总DNA,对其26S rRNA区测序,将5株酵母基因序列提交GenBank数据库进行同源序列比对,选取相似度大于99%的同源序列进行分析,鉴定结果见表3。
综上所述,YMF-a菌株鉴定为文莱毕赤酵母(Pichia bruneiensis),PJ1菌株为季也蒙迈耶氏酵母(Meyerozyma guilliermondii),SC菌株为文莱毕赤酵母(Pichia bruneiensis),MG菌株为热带假丝酵母(Candida tropicalis),JJ菌株为膜醭毕赤酵母(Pichia membranifaciens)。
3 结论与讨论
软腐病也称为熟腐病,是一种常见的潜伏性病,发生在猕猴桃采摘后储藏期间,其腐烂率可在50%以上,极大地影响了猕猴桃的品质和经济价值[16]。该病主要由葡萄坐腔菌(Botryosphaeria dothidea)、间座壳菌(Diaporthe phaseolorum)和灰葡萄孢菌(Botrytis cinerea)等病原菌引起。尽管拮抗酵母菌在苹果[17]、芒果[18]、番茄[19]、草莓[12]等果树病害的生物防治中有所应用,并取得了不同程度的抑菌效果,但对于猕猴桃软腐病的防治报道却相对较少。因此,本研究通过体外对峙实验,筛选出了19株酵母,并发现其中5株酵母(YMF-a、PJ1、SC、MG、JJ)对灰葡萄孢菌和葡萄坐腔菌都有较好的抑制效果,其中YMF-a酵母的拮抗效果最好,对于灰葡萄孢菌和葡萄坐腔菌的相对抑制率均超过60%。经过菌落和菌体形态结合26srDNA序列分析鉴定,YMF-a和SC鉴定为文莱毕赤酵母(Pichia bruneiensis)、PJ1为季也蒙迈耶氏酵母(Meyerozyma guilliermondii)、MG为热带假丝酵母(Candida tropicalis)、JJ为膜醭毕赤酵母(Pichia membranifaciens)。此结论与陈莹莹等[20]探究膜醭毕赤酵母(Pichia membranifaciens)对采后灰葡萄孢菌有抑菌效果的结果相一致,与罗玲等[21]从猕猴桃汁发酵液中分离筛选出一株酵母菌株AY1-1为库德毕赤酵母(Pichia kudriavzevii)结果不同。
近年来,天然温和的生物防控方法已成为控制食品中有害微生物污染的主要方式。拮抗酵母具有遗传稳定性高、适应性强、抗菌谱广、生产成本低等特点,在果蔬的采后保鲜方面已被广泛应用[22]。本文旨在探究酵母菌对猕猴桃腐败菌的拮抗作用,为以酵母菌为基础的新型抗菌剂的开发提供参考[23],并期望能够更好地提高食品质量,保障食品安全,在生物防治领域具有巨大的发展前景。
参考文献
[1]李东.猕猴桃采前处理及保鲜技术研究[D].贵阳:贵州大学,2017.
[2]刘晓驰,冯新,路喻丹,等.猕猴桃软腐病发生与防治技术研究进展[J].东南园艺,2022,10(3):213-219.
[3]李诚,蒋喜军,冷建华,等.奉新县猕猴桃果实腐烂病腐败菌分离鉴定[J].江西农业大学学报,2012,34(2):259-263.
[4]雷霁卿,吴文能,刘颖,等.贵州六盘水地区“红阳”猕猴桃软腐病病原菌分离鉴定及致病力差异测定[J].北方园艺,2019(4):31-38.
[5]潘慧,胡秋舲,张胜菊,等.贵州六盘水市猕猴桃病害调查及病原鉴定[J].植物保护,2018,44(4):125-131.
[6]石浩.中药提取物对猕猴桃软腐病菌抑制分析及对果实防腐保鲜效果研究[D].长沙:湖南农业大学,2022.
[7]杨帅.猕猴桃miR160前体基因克隆及其在灰霉病抗性中的作用[D].重庆:重庆三峡学院,2023.
[8]LIU Y,WANG W H,ZHOU Y H,et al.Isolation, identification and in vitro screening of Chongqing orangery yeasts for the biocontrol of Penicillium digitatum on citrus fruit[J].Biological Control,2017,110:18-24.
[9]CHEN P H,CHEN R Y,CHOU J Y.Screening and evaluation of yeast antagonists for biological control of Botrytis cinerea on strawberry fruits[J].Mycobiology,2018,46(1):33-46.
[10]DA C T,FERRAZ L P,WEHR P P,et al.Antifungal activity and action mechanisms of yeasts isolates from citrus against Penicillium italicum[J].International Journal of Food Microbiology,2018,276:20-27.
[11]IGNATOVA L V,BRAZHNIKOVA Y V,BRAZHNIKOVA R Z,et al.Plant growth-promoting and antifungal activity of yeasts from dark chestnut soil[J].Microbiological Research,2015,175:78-83.
[12]朱寒冰,明瑞虎,張媛,等.市售草莓腐败菌的分离鉴定及拮抗酵母的筛选[J].食品工业科技,2020,41(1):
98-104.
[13]范先敏.猕猴桃软腐病拮抗菌筛选及初步拮抗机理研究[D].武汉:华中农业大学,2017.
[14]郭虹娜.葡萄汁有孢汉逊酵母挥发物抑制草莓采后灰霉病生防机理研究[D].南京:南京农业大学,2020.
[15]张鸿凯,杨曼,石登红,等.不同DNA提取方法在猕猴桃属植物中的应用[J].贵阳学院学报(自然科学版),2018,13(1):101-104.
[16]田旭军,廖逊,李荣玉,等.3种中药提取物对猕猴桃葡萄座腔菌的毒力及联合作用[J].山地农业生物学报,2023,42(2):86-89.
[17]陈汝,冉昆,王传增,等.苹果炭疽病菌拮抗酵母菌的筛选与鉴定[J].河北农业科学,2019,23(6):51-54.
[18]许春青.芒果炭疽病菌拮抗酵母的筛选、鉴定及其保护剂的评价[D].武汉:华中农业大学,2013.
[19]周防震.番茄采后病害拮抗酵母菌的筛选和应用[D].武汉:华中农业大学,2004.
[20]陈莹莹,张亚敏,郭红莲.膜醭毕赤酵母挥发性物质对灰葡萄孢菌的抑菌活性及组分分析[J].食品与发酵工业,2023,49(13):64-69.
[21]罗玲,何静,徐丽萍,等.猕猴桃汁中酵母菌的分离鉴定及应用[J].中国酿造,2023,42(8):103-110.
[22]王瑶,姜冬梅,王刘庆,等.拮抗酵母控制果蔬采后真菌病害研究进展[J].食品工业科技,2018,39(8):309-317.
[23]马悦,单嘉宇,蒋耀东,等.酵母菌及其衍生物抗菌功能的研究进展[J/OL].食品科学:1-15[2023-10-04].http://kns.cnki.net/kcms/detail/11.2206.TS.20221230.1700.047.html.
