嗜肺军团菌效应蛋白Lpg1972与CNOT7相互作用研究
2024-01-15刘子赫吴书娴甄向凯
刘子赫,吴书娴,甄向凯
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学南方生物医学研究中心,福建 福州 350117)
嗜肺军团菌(Legionellapneumophila)作为一种带鞭毛的革兰氏阴性胞内致病菌,可以诱发军团菌肺炎,临床特征表现为急性下呼吸道感染症状[1-2]。嗜肺军团菌在1976年美国费城退伍军人大会上爆发的非典型肺炎中被首次分离出来[3]。嗜肺军团菌大多生存在天然及人工水环境,包括空调冷却塔、淋浴器和喷泉等。人们吸入被军团菌污染的气溶胶后感染,引发非典型肺炎[4]。嗜肺军团菌在入侵宿主细胞后,可以通过Ⅳ型分泌系统分泌330多种效应蛋白[5],用来干扰宿主细胞内的各种生命活动,如营养物质运输、自噬、免疫反应等多种生理生化反应,最终导致疾病的产生[6]。宿主细胞通过胞吞作用将周围环境中的嗜肺军团菌内吞进细胞中,在胞质中形成含军团菌的囊泡样吞噬小体(Legionella-containing vacuole,LCV),为军团菌在宿主细胞内大量复制增殖提供生理环境[7-8]。LCV中的嗜肺军团菌通过IVB型(Dot/Icm)分泌系统将效应蛋白转运至宿主细胞内[9],这些效应蛋白间彼此分工协作,调节宿主细胞信号通路,干扰宿主细胞生理进程,包括组蛋白修饰、囊泡运输和基因表达等[10]。
致病菌在与宿主的对抗中不断进化来逃避宿主的免疫防御[11],通过诱导或沉默宿主体内基因来帮助致病菌生存[12]。病原菌进入宿主细胞,会试图通过阻止宿主防御因子转录和翻译来抑制免疫反应或应激反应[13-14]。最近研究表明嗜肺军团菌的效应蛋白lpg1972可以靶向Ccr4-Not复合物中的CNOT7亚基,干扰宿主细胞内mRNA的降解,影响宿主细胞内基因的转录翻译。
真核细胞Ccr4-Not(carbon catabolite repressor 4-negative on TATA)复合物是一种重要的、保守的蛋白质复合物,由至少6个核心亚基组成,以模块化结构排列[15]。Ccr4-Not复合物调控基因表达的许多方面(如染色质重塑、转录、mRNA输出和RNA干扰),其中研究最透彻的作用是用于降解mRNA,发挥去腺苷化酶活性[16-17]。Ccr4-Not复合物以分子质量较大的多结构域蛋白CNOT1为基础[18],通过蛋白中心的MIF4G结构域结合DEDD(Asp-Glu-Asp-Asp)核酸酶模块(哺乳动物细胞中的CNOT7和CNOT8)[19]。CNOT7与CNOT8亚基竞争结合MIF4G结构域,执行相似但不同的催化作用[20]。除了DEDD核酸酶之外,Ccr4-NOT还包含由旁系同源物CNOT6和CNOT6L组成的二级核酸内切酶-核酸外切酶-磷酸酶(EEP)核酸酶模块,它通过与DEDD直接相互作用结合在Ccr4-Not复合物中[21-22]。尽管催化功能相似,每个核酸酶模块调节不同的mRNA亚群,具有特定poly(A)结合偏好[23]。
综上将嗜肺军团菌效应蛋白Lpg1972作为主要研究对象,结合分子生物学及结构生物学手段,探究了Lpg1972与Ccr4-Not复合物中CNOT7亚基的相互作用,对复合物晶体进行了筛选,并基于Alphafold2预测模型,分析它们之间的相互作用位点。
1 实验材料
1.1 分子克隆实验相关材料试剂
分子克隆实验所用试剂:DH5α感受态细胞、2×Taq PCR Mix、KOD-Plus-Neo酶、SspⅠ、BamHⅠ、XhoⅠ、琼脂糖、50×TAE缓冲液、GelStain核酸染料(10 000×)、DNA Marker、DNA上样缓冲液、胶回收试剂盒、质粒提取试剂盒。
1.2 蛋白表达与纯化相关试剂
蛋白表达纯化过程中所用试剂如下。
感受态细胞培养所用试剂:BL21(DE3)感受态、氯化钠、蛋白胨、酵母粉、琼脂粉、氨苄青霉素、卡那霉素、IPTG。
蛋白纯化所用相关试剂:Tris、氯化钠、咪唑、PMSF、Ni-NTA填料、硫酸镍、Glutathione Beads填料、还原型谷胱甘肽。
蛋白质SDS-凝胶电泳所用试剂:Omni-EasyTM一步法PAGE凝胶快速制备试剂盒(12.5%)、十二烷基硫酸钠(SDS)、蛋白 Marker、考马斯亮蓝R-250、考马斯亮蓝G-250。
1.3 蛋白晶体筛选相关试剂
晶体初筛试剂盒信息如表1所示。

表1 晶体初筛试剂盒Tab.1 Crystal primary screening kit
1.4 实验仪器
实验所需仪器:超声破碎仪(美国SONICS 超声波细胞破碎仪)、高压细胞破碎仪(永联生物科技(上海)有限公司)、恒温培养箱(上海知楚仪器有限公司)、MiniQ超纯水仪(默克Millipore)、台式冷冻离心机(赛默飞世尔)、落地式低温高速离心机(Thermo)、电泳仪(Bio-Rad)、PCR仪(Bio-Rad)、AKTApure蛋白纯化系统(GEHealthcare)、Nanodrop(Thermo)、电子分析天平(Sartorius)、金属浴(Coyote)、水浴锅(常州普天仪器)、脱色摇床(Scilogex)、高压灭菌锅(Panasonic)、涡旋混合仪(Kylin-Bell)。
1.5 实验用缓冲液配制
实验用缓冲液配方如表2所示。

表2 缓冲液体系Tab.2 Buffer systems
2 实验方法
2.1 分子克隆
2.1.1 目的基因的获取及引物设计
在NCBI (national center for biotechnology information)数据库中查找Lpg1972和CNOT7蛋白的基因序列,利用SnapGene软件设计引物。
2.1.2 目的片段扩增
用嗜肺军团菌基因组和HEK293T细胞基因组作为模板进行目的片段扩增,PCR反应程序和反应体系如表3和表4所示。

表3 PCR反应程序Tab.3 PCR reaction procedure

表4 PCR反应体系Tab.4 PCR reaction system
2.1.3 目的片段回收
琼脂糖凝胶电泳:PCR产物通过琼脂糖凝胶电泳分离,向扩增结束的目的基因片段中按比例加入6×DNA上样缓冲液,混合均匀后通过电泳迁移分离目的片段。
胶回收:当上样缓冲液中的指示剂条带跑到合适位置时停止电泳,取出琼脂糖凝胶,在DNA Marker的指示下,判断PCR产物长度,切下目的条带,按照琼脂糖凝胶回收试剂盒(Gel Extractionn kit)说明书进行胶回收,回收完成后用Nanodrop仪器测量浓度,用于后续实验。
2.1.4 线性化表达载体制备
将含有空载环状载体质粒的菌株接入5 mL含有抗性的培养基,放置于37 ℃、220 r·min-1恒温摇床过夜培养。使用试剂盒进行质粒提取,所得质粒用Nanodrop仪器测量回收质粒浓度,用于质粒线性化。
质粒线性化:选取合适的酶切位点,将空载环状载体质粒酶切制备线性载体,按体系加入样品,37 ℃酶切反应4 h,反应体系如表5所示。反应结束通过琼脂糖凝胶电泳分离回收线性化载体。

表5 反应体系Tab.5 Reaction system
2.1.5 目的基因与表达载体构建
采用同源重组法,将回收的目的DNA片段构建到表达载体上,参照无缝克隆plus One step PCR Cloning kit试剂盒说明书将线性化载体与目的片段以合适的比例加入离心管中进行重组反应,混合溶液50 ℃金属浴反应10 min,反应体系参考表6。

表6 反应体系Tab.6 Reaction system
2.1.6 转化
取储存在-80 ℃冰箱中的100 μL DH5α感受态置于冰上,待感受态完全融化后将步骤2.1.5中的重组质粒全部加入感受态细胞中。冰上孵育25~30 min 后,42 ℃ 热激90 s,冰上静置2 min。加入500 μL无抗LB培养基,置于37 ℃ 恒温摇床,220 r·min-1培养30 min。培养后将感受态4 000 r·min-1离心3 min,吸取去500 μL上清后,用剩余上清重悬细胞并涂于含有相应抗性的LB固体培养皿中,置于37 ℃ 恒温摇床静置培养14 h。
2.1.7 菌落PCR及测序
由于目的片段与载体连接可能出现假阳性,需对长出的菌落进行鉴定。取灭菌EP管加入含相关抗性的LB培养基,挑取单克隆菌落37 ℃ 培养4 h左右。取1 μL菌液进行菌落PCR,按照步骤2.1.2设置相关程序。将扩增产物进行核酸胶电泳,挑选与目的基因片段大小相同的样品,取200 μL菌液进行测序。
2.2 目的蛋白的表达及纯化
2.2.1 目的蛋白的表达
取阳性质粒转化到大肠杆菌表达型菌株E.coliBL21(DE3)中,分别挑取V7- Lpg1972、pGEX-6P-1-CONT 7以及V7-Lpg1972-CNOT7共表达的单克隆菌落接入100 mL含有氨苄青霉素抗性的LB培养基中,37 ℃摇床220 r·min-1培养6 h。将菌液转接到含有氨苄青霉素抗性的1 L LB培养基中扩大培养,37 ℃摇床220 r·min-1培养2~4 h,分光光度计测量菌液浓度D600 nm=0.8时,加入400 μL 1 mol·L-1IPTG诱导目的蛋白表达,IPTG终浓度为0.4 mmol·L-1,置于18 ℃摇床中继续培养14~16 h。最后以4 000 r·min-1离心收集大肠杆菌细胞,并置于-20 ℃储存。
2.2.2 蛋白质纯化
(1)高压破菌:将收集的菌块按每升菌液收集的细胞加入15~20 mL裂解缓冲液重悬备用,重悬后的菌液用高压破碎仪破碎。破碎结束后,收集溶液并用高速冷冻离心机离心,离心机参数为4 ℃,17 000 r·min-1,离心30 min。
(2)亲和层析:由于重组蛋白N末端具有6×His标签和GST标签,蛋白质纯化使用亲和层析的方法[24]。带有6×His标签的目的蛋白可特异性吸附在Ni填料上,带GST标签的蛋白可以特异性结合谷胱甘肽琼脂糖凝胶,杂蛋白则不结合填料或结合能力较差,从而将目的蛋白与杂蛋白分离,最后用洗脱缓冲液洗脱目的蛋白。
(3)SDS-凝胶电泳:蛋白质在SDS电泳液中变性并带上相同电荷,在电流的作用下迁移,移动速度与蛋白质分子质量相关,通过考马斯亮蓝染色使蛋白质条带显现,与标准分子质量蛋白Marker比较,判断蛋白质样品纯度。
2.2.3 分子排阻层析
分子排阻层析也称为凝胶排阻层析或分子筛,根据样品组分的分子质量进行分离和纯化,主要步骤如下。
(1)蛋白质浓缩:将纯化的蛋白质样品转移到浓缩管中,4 ℃台式离心机4 000 r·min-1离心,浓缩至1 mL。浓缩的蛋白质样品转移到1.5 mL EP管,使用小型离心机(13 000 r·min-1,15 min,4 ℃)离心至无沉淀。
(2)分子筛缓冲液配制:20 mmol·L-1Tris-HCl(pH 8.0),150 mmol·L-1NaCl,用0.22 μm滤膜抽滤去除杂质,超声波超声20 min去除气泡。
(3)层析柱平衡:泵头用ddH2O清洗后放入分子筛缓冲液中,进行泵冲洗和系统清洗。清洗结束后设置系统参数:流速0.4 mL·min-1,压力上限报警2 MPa。层析柱与AKTA连接,用当前参数冲洗1个柱体积。
(4)上样:平衡结束后,重新设置系统参数:流速0.4 mL·min-1,压力上限报警2 MPa,检测紫外(UV)吸收波长A280 nm和A254 nm,当基线平稳后上样。上样前吸取分子筛缓冲液清洗上样环3次,洗净后将蛋白质样品注入上样环,改变系统流路,使上样环中的蛋白质样品流进层析柱。根据分子排阻色谱图评估蛋白质信息并收集样品。
(5)SDS-凝胶电泳:通过SDS-凝胶电泳检测,取状态较好的蛋白质样品浓缩,Nanodrop测量蛋白质浓度,用于后续实验。
2.3 蛋白质pull-down实验
蛋白质Pull-down是通过诱饵蛋白来特异性识别配体蛋白质,是在体外研究蛋白质与蛋白质相互作用的有力工具。将带有亲和标签(如谷胱甘肽转移酶、6×His、生物素)的诱饵蛋白固定在固体基质上,当目标蛋白或细胞、组织抽提液流经时,与诱饵蛋白相互作用的配体蛋白质被捕获,通过改变洗脱条件回收被捕获的蛋白,利用蛋白质印迹或质谱检测这种相互作用关系。
CNOT7蛋白的基因构建到6p-1载体上,使其N末端带GST标签,经过表达、纯化得到的蛋白样品作为诱饵蛋白结合到GST填料上。Lpg1972蛋白的基因构建在V7载体上进行表达纯化,N末端带6×His标签。纯化所得到的Lpg1972蛋白加入带有诱饵蛋白的GST填料中,用缓冲液反复冲洗,直至不再有蛋白洗脱下来。将带有诱饵蛋白的GST填料加入缓冲液,置于金属浴95 ℃加热5 min,使蛋白质变性,从GST填料上脱离下来。取10 μL样品通过SDS-凝胶电泳进行鉴定,分析二者之间是否可能存在相互作用。
2.4 晶体的筛选
蛋白结晶的方法主要包括:气相扩散法(Vapor diffusion)、微量透析法(Crystallization by dialysis)和液-液扩散法(Liquid-liquid diffusion)等。结晶主要原理:蛋白质在沉淀剂作用下,溶解度不断降低;封闭环境下,点晶孔中的溶液通过汽-液交换扩散到池液中,蛋白质浓度缓慢升高而析出,蛋白质分子由无序转变为有序排列,经过成核-生长,最终生成晶体。
初筛常用试剂盒为:PEG-Rx、 PEG-Ion、Index、SaltRx、Crystal Screens、Wizard classic 1/2、Wizard classic 3/4、Core Ⅰ、Core Ⅱ、Core Ⅲ、Core Ⅳ、SaltRx、PACT、Proplex。每种试剂盒中细分96个条件,使用96孔初筛板进行初筛。
3 实验结果
3.1 Lpg1972和CNOT7原核表达
3.1.1 引物设计与表达载体构建
使用SnapGene软件对Lpg1972与CNOT7的基因序列设计引物(表7)。以嗜肺军团菌基因组和HEK293T基因组为模板扩增出目的片段,将两个目的片段分别构建到V7载体和pGEX-6P-1载体上,使目的蛋白分别在N末端带6×His标签或GST标签,通过大肠杆菌原核表达系统BL21(DE3)表达。

表7 引物信息Tab.7 Primer information
3.1.2 Lpg1972蛋白纯化
镍柱亲和层析:将Lpg1972菌破碎并离心得到上清倒入镍柱,待目的蛋白与镍填料充分结合,向裂解缓冲液中分别加入20、50、300 mmol·L-1浓度的咪唑进行梯度洗脱。收集各组分洗脱液样品,进行SDS-凝胶电泳(图1)。电泳泳道从左至右依次为蛋白Marker、沉淀、上清、流穿、20 mmol·L-1IM洗脱样、50 mmol·L-1IM洗脱样、300 mmol·L-1IM洗脱样。结果显示用300 mmol·L-1浓度的咪唑缓冲液洗脱下来的蛋白质样品纯度较好,收集这些样品进行浓缩。
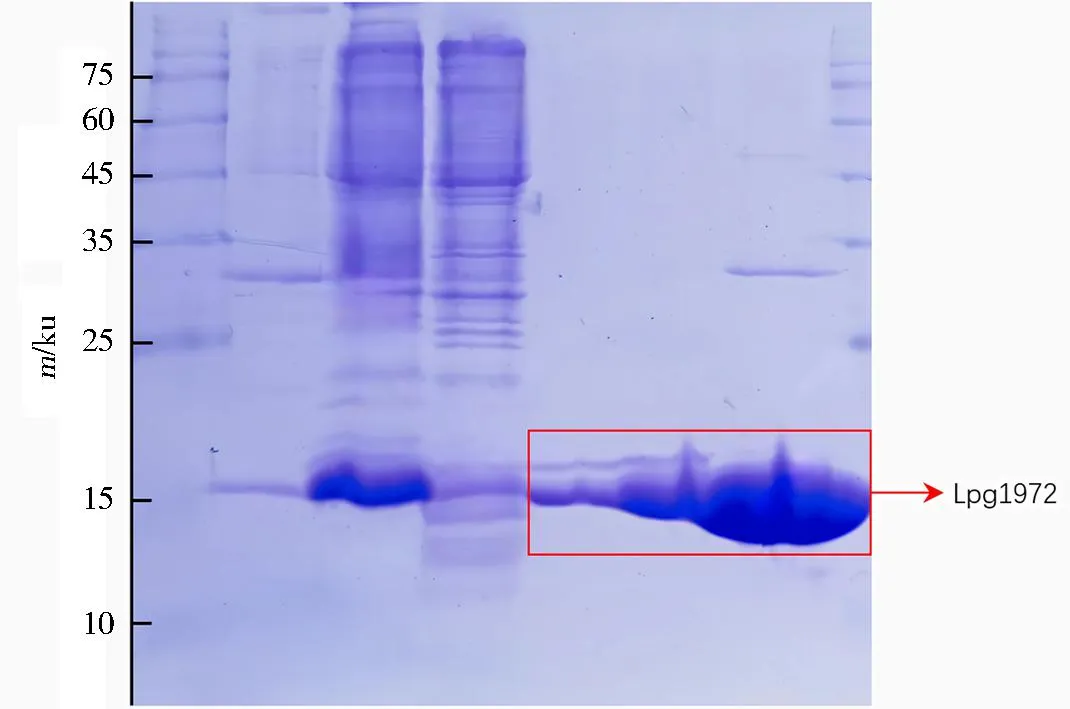
图1 Lpg1972镍柱亲和层析SDS-凝胶电泳结果Fig.1 The SDS-PAGE results for the Lpg1972 nickel column affinity chromatography
分子排阻层析:将蛋白质溶液浓缩至1 mL,质量浓度为20 mg·mL-1,13 000r·min-1离心并去除沉淀。分子排阻层析选用Superdex 200层析柱,具体步骤参照2.2.3,分子排阻层析结果如图2(a)所示,SDS-凝胶电泳结果从左至右依次为:分子筛上样前样品、蛋白 Marker以及峰尖样品,由此判断出峰尖样品纯度较好,如图2(b)。

图2 Lpg1972蛋白分子排阻层析色谱(a)和SDS-凝胶电泳结果(b)Fig.2 Results of size exclusion chromatography(a) and SDS-PAGE(b) for Lpg1972 protein
3.1.3 CNOT7蛋白纯化
将CNOT7的表达菌破碎并离心,将上清与GST柱孵育,待目的蛋白与填料充分结合后进行洗脱,洗脱液为20 mmol·L-1还原型谷胱甘肽。收集洗脱下来的溶液样品,浓缩换液将谷胱甘肽浓度降至0,加入Prescission Protease酶反应4 h切去GST标签,酶切后加入GST柱孵育,切除标签的目的蛋白不与柱料结合,从而与标签分离,取各组分样品进行SDS-凝胶电泳,结果如图3所示。

从左至右依次为沉淀、上清、流穿、20 mmol·L-1谷胱甘肽洗脱样、酶切后流穿样、Prescission Protease酶、酶切后洗脱样(GST标签)、蛋白 Marker。图3 CNOT7亲和层析SDS-凝胶电泳检测结果Fig.3 SDS-PAGE detection results for CNOT7 affinity chromatography
3.1.4 GST pull-down验证二者相互作用
将纯化所得的CNOT7蛋白(带标签)重新结合在GST柱上,并向层析柱中加入纯化所得的Lpg1972蛋白,4 ℃旋转孵育6 h后进行洗脱。收集洗脱下来的溶液样品,经过分子排阻层析纯化后,根据SDS-凝胶电泳判断蛋白质相互作用,结果如图4所示,SDS-凝胶电泳结果从左至右依次为分子筛上样前、蛋白Marker、峰1、峰 2、峰3。由第二个峰处的结果可以判断蛋白之间具有相互作用。
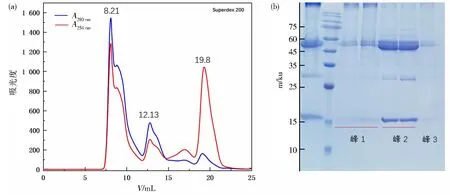
图4 GST pull-down的分子排阻层析色谱(a)和SDS-凝胶电泳检测(b)结果Fig.4 Results of GST pull-down molecular size exclusion chromatography(a) and SDS-PAGE detection(b)
3.2 复合物蛋白纯化
3.2.1 引物设计与共表达载体构建
将CNOT7和Lpg1972序列之间通过一个核糖体结合位点(RBS)连接,并将重组序列连接在V7载体,设计共表达质粒。其中CNOT7蛋白N末端带6×His标签,引物设计如表8。构建方法参考2.1。

表8 引物信息Tab.8 Primer information
3.2.2 复合物蛋白纯化
带6×His标签的CNOT7蛋白可以与Ni填料结合,Lpg1972可以通过结合CNOT7蛋白间接结合在填料上。并通过不同浓度咪唑洗脱复合物蛋白,收集洗脱下来的溶液样品,根据SDS-凝胶电泳判断蛋白质表达及纯化结果如图5(b)。电泳结果从左至右依次为沉淀、上清、流穿、0 mmol·L-1IM洗脱样、20 mmol·L-1IM洗脱样、50 mmol·L-1IM洗脱样、300 mmol·L-1IM洗脱样、蛋白Marker、峰1、峰2。在峰2处可以收集到纯度较好的复合物蛋白。

图5 CNOT7-Lpg1972复合物分子排阻层析色谱(a)和SDS-凝胶电泳(b)结果Fig.5 Results of size exclusion chromatography(a) and SDS-PAGE(b) for the CNOT7-Lpg1972 complex
3.3 结构预测及分析
利用AlphaFold2对Lpg1972进行了三级结构的预测[25-26],如图6所示,Lpg1972主要由5个β折叠及另一侧的α螺旋组成。对Lpg1972的三级结构进行了Dali分析,在PDB数据库中没有发现与它具有相似的结构的同源蛋白。表面电荷分析发现Lpg1972的C末端具有一个明显的带负电荷的区域。
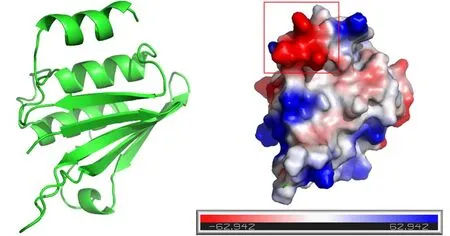
图6 Lpg1972三级结构预测Fig.6 AlphaFold2-generated structural model of Lpg1972
COT7蛋白已经被证实为一种去腺苷化酶,可以在体外降解RNA,它的三级结构如图7所示[27]。通过电荷分析可以看出CNOT7蛋白有2个正电腔,推测可能为Lpg1972的结合位点。

图7 CNOT7蛋白三级结构(PDB:2D5R-A)Fig.7 Three-dimensional structure of CNOT7 protein (PDB:2D5R-A)
通过软件AlphaFold2对CNOT7-Lpg1972复合物蛋白结构进行了预测,来分析它们之间相互作用的方式[28]。CNOT7-Lpg1972复合物的结构如图8(a)所示。根据复合物的三级结构模型分析了二者的相互作用位点,如图8(b),Lpg1972的C末端深入CNOT7的正电荷口袋中,Lpg1972蛋白的Lys124与CNOT7蛋白的Asp40之间可以形成氢键相互作用,同时分析二者的表面电荷发现Lpg1972蛋白的Glu114和Glu117与CNOT蛋白的Arg49可以发生静电相互作用。

图8 复合物结构预测(a)和相互作用位点分析(b)Fig.8 AlphaFold2-generated structural model of the complex(a) and analysis of their interaction sites(b)
4 总结与讨论
嗜肺军团菌效应蛋白数量繁多,功能丰富,通过IVB型分泌系统向宿主细胞内分泌并转运,在致病过程中发挥重要的作用。其中Lpg1972作为一种效应蛋白,可以与Ccr4-Not复合物发生相互作用。Ccr4-Not复合物可以调控真核细胞内mRNA降解,在细胞增殖、凋亡和自噬过程中发挥着重要作用,因此研究效应蛋白Lpg1972与CNOT7亚基的相互作用关系具有重要意义。
本研究通过体外生化实验验证了Lpg1972和CNOT7蛋白的相互作用,并在此基础上利用分子生物学手段构建了共表达重组质粒,在大肠杆菌表达系统中表达,分离纯化了纯度较好的复合物蛋白。因此嗜肺军团菌效应蛋白Lpg1972可以通过相互作用的方式影响Ccr4-Not复合物的生理活性,进而干扰真核细胞内mRNA的降解,影响宿主细胞的正常生理进程。最后通过AlphaFold2软件预测了复合物结构并分析了可能的互作位点,为后续的相关研究奠定了基础。
