一种新型蒸馏收集器测定水中氨氮的方法研究
2024-01-15申慧滢安霖钰陈昌盛
陈 琨 金 梅 申慧滢 安霖钰 陈昌盛
(贵州省生态环境监测中心,贵阳 550081)
氨氮在水中呈游离态,氨氮含量增加对水生物和饮用水有很大危害,并且对水质状况产生不良影响,因此对水质中的氨氮进行监测并有效地处理具有重要的现实意义。氨氮主要的来源是工业废水、生活污水、农业生产废水等,常用于氨氮监测的现代分析技术主要包括了分光光度法、电极法、气相分子吸收法和中和滴定法[1-2]。氨氮样品的前处理方法主要有蒸馏法、絮凝沉淀法和离心法[3]。本实验在标准HJ535-2009的基础上采用一种新型蒸馏收集器作为水质样品的前处理设备,从而评价该新方法的适用性。
1 实验部分
1.1 主要仪器
氨氮蒸馏收集器(长沙湘兰DCS型);721可见分光光度计。新型蒸馏器的装置见图1。
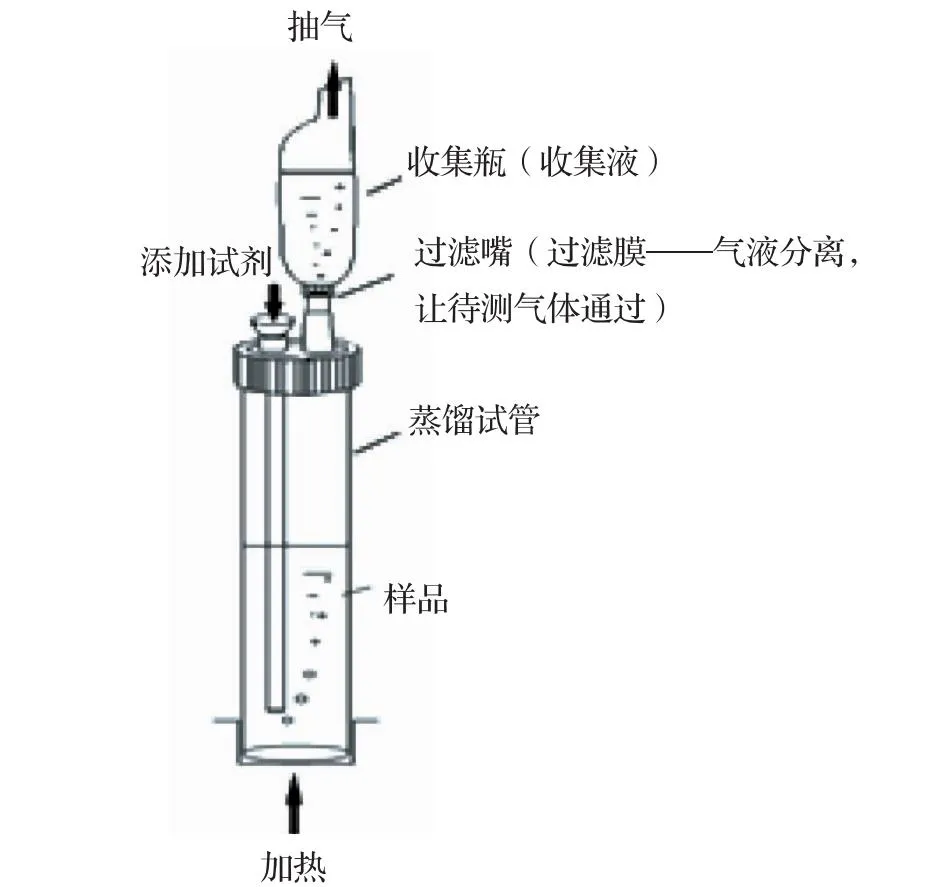
图1 氨氮蒸馏收集器
1.2 主要试剂
氨氮标准溶液:BW20085-20-250(坛墨质检科技股份有限公司),标准质量浓度:20 mg/L,相对扩展不确定度(2%,k = 2)。实验采用的是去离子超纯水,电阻率在25℃时实测值为18 MΩ·cm且TOC<30 ppb。质量浓度为1.19 g/mL的盐酸。氢氧化钠溶液:摩尔浓度为1 mol/L。酒石酸钾钠溶液:质量浓度为500 g/L。溴百里酚蓝指示剂:质量百分比浓度为0.05%,pH为6.0~7.4。硼酸溶液:质量浓度为20g/L。
纳氏试剂(HgCl2-KI-KOH)[4]:
称取15.0 g氢氧化钾(KOH),溶于50 ml水中,冷却至室温。
称取5.0 g碘化钾(KI),溶于 10 ml水中,在搅拌下,将2.50 g二氯化汞(HgCl2)粉末分多次加入碘化钾溶液中,直到溶液呈深黄色或出现淡红色沉淀溶解缓慢时,充分搅拌混合,并改为滴加二氯化汞饱和溶液,当出现少量朱红色沉淀不再溶解时,停止滴加。
在搅拌下,将冷却的氢氧化钾溶液缓慢地加入到上述二氯化汞和碘化钾的混合液中,并稀释至100ml,于暗处静置24h,倾出上清液,贮于聚乙烯瓶内,用橡皮塞或聚乙烯盖子盖紧,存放暗处,可稳定1个月。
1.3 试验方法
1.3.1 蒸馏收集器的原理
在pH值在6.0~7.4介质中,加入适量轻质氧化镁,使水样呈微碱性,蒸馏释放出的氨,通过气泵抽气,氨气气体经过过滤膜被吸收于硼酸溶液中,空气由进气/加料口进入扰动溶液,使反应体系混合均匀。
1.3.2 样品的保存
水样采集在聚乙烯瓶或玻璃瓶内,要尽快分析。如需保存,应加硫酸使水样酸化至pH<2,2~5℃下可保存7 d。
1.3.3 样品的预处理
分取50.0 ml水样,移入玻璃蒸馏试管中,调节水样为中性。可加入2滴溴百里酚蓝指示剂,用1 mol/L的氢氧化钠或者1 mol/L的盐酸调整pH至6.0(指示剂呈黄色)~7.4(指示剂呈蓝色)。若样品中氨氮含量较高,可分取适量并加水至50 ml,使氨氮含量不超过2.0 mg/L。空白实验用实验用水代替水样与试样同步操作。
将装有双口插盖、加液漏斗、加液长管、垫圈的试管帽与蒸馏试管紧密连接。
收集瓶水咀处装好疏水性过滤膜,然后在收集瓶内定量加入硼酸溶液5.0 ml,稀释至刻度(25 ml)。
连接蒸馏试管、收集瓶、抽真空装置(如图1所示)。
开启电源,设置加热炉温于144℃,时间90 min,打开真空泵,档位调至2档,进行气密性检查,检查完成后真空泵档位调至6档(或6档以上),真空压力30 kPa以上,调节微调阀至气泡速率为6~10个/秒。
迅速沿加液漏斗加入1.5 ml硼砂缓冲溶液。
点击待机按键,按键变为加热,仪器开始加热,至蒸馏完毕。此吸收瓶内试样“A”待测。
用实验用水代替样品,按1.3.3操作,得到空白试验试样“B”待测。
1.3.4 校准曲线
在8个50 ml比色管中,分别加入0.00、0.50、1.00、2.00、4.00、6.00、8.00 和10.00 ml氨氮标准工作溶液,其所对应的氨氮含量分别为0.0、5.0、10.0、20.0、40.0、60.0、80.0和100 μg[5],加水至刻度。加入1.0 ml酒石酸钾钠溶液,摇匀,再加入纳氏试剂1.5 ml,摇匀。放置10 min后,在波长420 nm下,用20 mm 比色皿,以水作参比,测量吸光度[6]。
以空白校正后的吸光度为纵坐标,以其对应的氨氮含量(μg)为横坐标,绘制校准曲线。
1.3.5 样品测定
将收集瓶中的硼酸吸收液全部倾入50 ml比色管后,按与标准曲线相同的步骤测量吸光度。若水样中氨氮质量浓度超过2 mg/L,可以从50 ml比色管中适量分取吸收液,再按校准曲线相同的步骤测量吸光度。
1.3.6 结果计算
氨氮浓度按如下公式计算:
式中:A—水样吸光度
A0—空白吸光度
V—试样体积
a—校准曲线截距
b—校准曲线斜率
2 结果与讨论
2.1 不同的前处理方法对比
实验采集了地表水、生活废水和工业废水的水样,分别经蒸馏法和气液分离富集法不同的前处理方法进行预处理,并对样品的氨氮进行测定,每个样品平行测定3次,取平均值。结果见表1、2、3。

表1 不同前处理测定地表水氨氮的结果比较 单位:mg/L

表2 不同前处理测定生活废水氨氮的结果比较 单位:mg/L
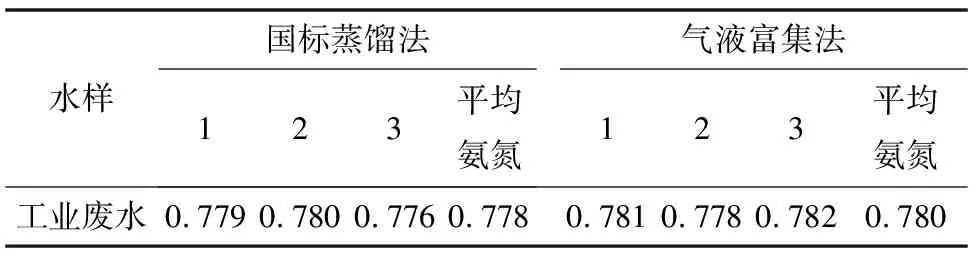
表3 不同前处理测定工业废水氨氮的结果比较 单位:mg/L
由表1、2、3可见,两种前处理方法所得到的样品结果是一样的,说明该富集装置富集效果能够满足分析测定的需要。
2.2 方法正确度验证
对国家有证标准物质浓度高、中和低的水质氨氮标准样品进行6次平行测定,结果见表4,得出相对误差结果均满足分析测定要求。
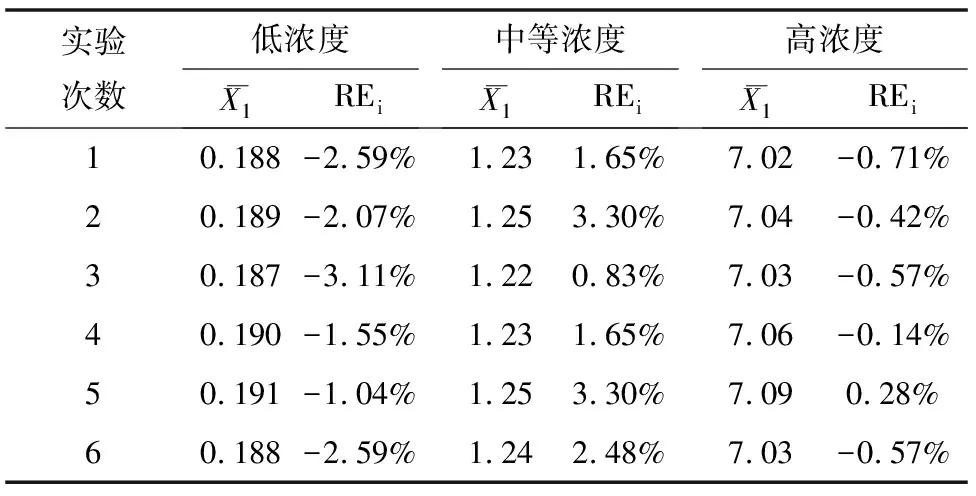
表4 水质中氨氮有证标准物质测试数据表 单位:mg/L
2.3 纳氏试剂的配制对实验结果的影响
配制纳氏试剂,务必控制HgCl2的加入量,HgCl2与KI的用量理论之比约为2.3:5。纳氏试剂放置时间过长会降低显色的灵敏度,并可能导致线性变差。
2.4 干扰物质去除
蒸馏过程中,某些有机物可能与氨同时馏出,对测定有干扰,其中有些物质(如甲醛)可以在蒸馏前在pH<1的条件下煮沸除去。
2.5 蒸馏馏出液的研究
蒸馏时间是影响实验结果的关键因素,从理论上分析,蒸馏时间越长,吸收液对氨氮气体的吸收越充分,越有利于实验进行。但过长的蒸馏时间会影响分析工作的效率。本方法考察了在不同蒸馏时间下:45、60、75、90、105、120 min时,相同水质样品吸光度测定值的变化,实验结果见图2。

图2 蒸馏时间对分析结果的影响
根据实验结果,60 min左右反应已经较为完全,考虑到不同样品基质可能对回收率有影响,实际选用90 min作为本方法的蒸馏时间。
2.6 反应温度的研究
反应温度影响了实验反应速度,低温反应时间长,反应不充分;温度过高则会使水蒸汽量增加,影响半透膜的透气性,从而降低氨气的吸收效率。但在实际分析中,温度可选择的范围并不大,特别是温度达到150℃左右后,水蒸汽明显增多。为了尽可能使反应完全,最终选取144℃作为本方法的反应温度。
2.7 抽气速度的确定
抽气速度主要影响吸收液对氨气的吸收速率,实验表明在较充分的蒸馏时间下,抽气速度对实验结果的影响并不大。分析其原因主要是气体经过半透膜分散比较均匀,同时在经过吸收液时反应速度比较快,因而能够适应较快的抽气速度。据此,在实际分析中选用较快的抽气速度以增加气泡对样品的扰动而提高样品混匀效率。一般保证吸收液中气泡冒出速度为6~8个气泡/秒为宜。
2.8 与行业标准比较
《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535-2009)该行业标准是我们研究的理论依据之一,其原理是以游离态的氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物,在420 nm波长处可对其吸光度进行测量。当水样中含有悬浮物、余氯、钙镁等金属离子、硫化物和有机物时会产生干扰,含有此类物质时要作适当处理,以消除对测定的影响。
该分析方法分为两部分,即样品的制备和样品的分析。其中样品的制备过程使用了蒸馏收集法。按照传统的蒸馏收集方法(HJ 535-2009,图3),操作较繁琐,且气密性很难保证,导致样品处理效率低,且气液分离过程采用冷凝,降低分离效率,操作耗时、耗水、耗试剂、耗人力。

图3 传统的蒸馏收集装置
本研究的主要技术特点在于水的前处理装置的改进和使用。技术原理主要是通过加热使蒸馏试管中的样品沸腾后逸出目标气体,在负压条件下,目标气体通过疏水性多孔滤膜与水蒸汽分离后进入收集瓶,被收集液直接吸收,无需冷凝。其分离原理详见图1。整个气液分离过程稳定可靠,实现了无人值守,操作简单,省电省试剂,无需冷凝水,节省人力物力,解决了传统蒸馏装置存在的问题。
3 结论
从实验结果可以看出,新型蒸馏收集器作为水质样品的前处理装置,可以满足实验室测定各类水质的要求。
