旋毛虫海藻糖酶(TsTRE)蛋白的表达及其间接ELISA抗体检测方法的建立
2024-01-15侯嘉茗张博涵阮入琳张鉴慧陈颢元宋铭忻张子群
侯嘉茗,张博涵,阮入琳,张鉴慧,刘 坤,陈颢元,宋铭忻,张子群
旋毛虫(Trichinellaspiralis,T.spiralis)是一种危害十分严重的食源性人兽共患寄生虫[1],可感染猪、犬、猫和鼠等哺乳动物,有时也会感染人类[2]。旋毛虫的感染主要是以误食或生食含肌幼虫包囊的肌肉,肌肉随宿主的胃液消化,内部的幼虫暴露并钻入十二指肠或空肠前段,雌雄成虫进行交配后产生新生幼虫,新生幼虫随血液循环到达全身肌肉,最终形成肌幼虫并定居于全身的横纹肌内,然后进入下一次循环[3]。旋毛虫对宿主的侵害性主要分为3种方式,分别是剥夺机体营养成分、对机体造成机械损伤和分泌毒素等[4],旋毛虫产生毒素大部分是以旋毛虫排泄分泌抗原(Trichinellaspiralisexcreted secretory antigen,ES)的形式,并且ES抗原可引起宿主全身免疫应答,是十分良好的抗原物质[5]。诊断旋毛虫疾病其目的在于早发现、早预防和早治疗,从源头上解决该病带来的经济损失及人类健康等问题。旋毛虫的诊断方法主要包括病原学诊断、免疫学诊断及分子生物学诊断等。传统病原学诊断方法(压片法和集中消化法)在面对临床大量检测时,存在费时费力、灵敏性低、检测效果不好及对人的创伤较大等多种弊端。分子生物学方法和免疫学方法相对于传统检测方法来说具有较高准确性、敏感性和快速简便等优点。当实际检测旋毛虫时,常常会采取多种检测手段并用的方式。已知在旋毛虫各个发育阶段都含有大量的海藻糖,它在旋毛虫的生长发育和代谢中承担着重要功能。在新生幼虫体内海藻糖含量占虫体干重5.2%,在4 d龄成虫体内其含量占虫体干重4.3%,在7 d龄成虫体内其含量占虫体干重7.2%,在肌幼虫体内其含量占虫体干重8.3%[6]。迄今为止,海藻糖的合成途径含有5种,但除了毕赤酵母外,其余生物均需要海藻糖酶来代谢海藻糖[7]。因此,研究海藻糖酶具有重要的意义,但目前针对旋毛虫海藻糖酶(Trichinellaspiralistrehalase,TsTRE)的研究尚不清晰。本研究全国首次表达rTsTRE蛋白,并证明该蛋白属于ES中一成份,以该蛋白为免疫原建立的间接ELISA抗体检测方法各性能均良好,可为进一步开发旋毛虫诊断试剂盒奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物、虫种及血清 体重为2.5~3.0 kg雌性新西兰大白兔购自哈尔滨医科大学实验动物中心;旋毛虫虫种是从黑龙江省逊克县的黑猪体内分离得到的,并由东北农业大学动物医学学院寄生虫与寄生虫病学教研室保种和传代;20份感染200条肌幼虫42 d小鼠的阳性血清、20份健康小鼠的阴性血清、25份感染其他寄生虫的阳性血清(感染华支睾吸虫的猪血清5份、感染日本血吸虫的小鼠血清5份、感染猪蛔虫的猪血清5份、感染弓形虫的小鼠血清5份和感染弓首蛔虫的犬血清5份)及20份健康猪的阴性血清均由本教研室提供。
1.1.2 主要试剂E.coliBL21和E.coliDH5-α感受态细胞、T3 Super PCR Mix聚合酶均购自北京擎科生物科技有限公司;pMD18-T Vector克隆载体、SacI酶与HindIII限制性内切酶、T4 DNA连接酶、PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒均购自宝生物工程(大连)有限公司;胶回收试剂盒购自AXYGEN公司;Hochest 33342染色液、Trizol试剂、质粒小提试剂盒、Ni-琼脂糖凝胶6FF、TMB单组分显色液和ECL发光液均购自百杰斯生物公司;Goat Anti-rabbit IgG/HRP和Goat anti-mouse IgG/HRP购自北京博奥森生物技术有限公司;pColdI表达载体由本教研提供。
1.2 方法
1.2.1 引物设计与合成 根据TsTRE基因组序列(基因号:XM_003380744.1),设计一对特异性引物,并引入SacI和HindIII酶切位点。该引物由吉林库美生物有限公司完成,上游引物为TRE-SacI:5′-CGAGCTCATGGCATTGCTGTACGATCCGGA-T-3′;下游引物为TRE-HindIII:5′-CCAAGCT-TTCACATGGCATAATTGGGATATGGTC-3′。
1.2.2 构建pColdI-TsTRE表达菌株 应用集中消化法和改良版贝尔曼方法收集旋毛虫肌幼虫,Trizol法提取肌幼虫总RNA基因组,后反转录成cDNA。利用PCR技术以旋毛虫cDNA为模板扩增TsTRE基因,PCR反应体系为:T3 Super PCR Mix聚合酶 19.0 μL,引物 1.0 μL,cDNA模板4.0 μL;PCR反应条件为:95 ℃ 5 min,95 ℃ 30 s,57 ℃ 40 s,72 ℃ 2 min,循环35次,72 ℃ 5 min,4 ℃保存。使用胶回收试剂盒纯化目的基因并与pMD18-T Vector克隆载体连接后转入到E.coliDH5-α感受态细胞中大量扩增,提取纯化克隆质粒进行SacI和Hind II双酶切鉴定,鉴定正确的质粒送往吉林库美生物技术有限公司测序。测序正确的目的基因与pCold I表达载体连接后转入E.coliBL21感受态细胞中表达,再次双酶切鉴定。对酶切正确菌株进行保存,命名为pColdI-TsTRE表达菌株。
1.2.3 蛋白纯化及Western-blot分析 将表达菌株放置在37 ℃条件下重新复苏,待菌液生长到对数生长期时加入浓度为1.0 mmol/L ITPG诱导剂分别在16 ℃条件下培养6 h、10 h、14 h、18 h、20 h和24 h,根据SDS-PAGE电泳筛选出rTsTRE蛋白的最佳ITPG诱导时间;再以最佳诱导时间为条件分别使用浓度为0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L和1.0 mmol/L ITPG诱导剂进行分批诱导,筛选rTsTRE蛋白的最佳ITPG诱导浓度。应用亲和柱层析的原理使用镍柱纯化rTsTRE蛋白,并利用Western-blot技术鉴定rTsTRE蛋白的反应原性、抗原性及特异性(一抗是稀释度为1∶500感染旋毛虫42 d小鼠的阳性血清,二抗是稀释度为1∶5 000 Goat anti-mouse IgG/HRP血清)。
1.2.4 免疫程序 用三通阀按照完全/不完全佐剂与rTsTRE蛋白1∶1的比例皮下多点注射新西兰大白兔,第1次与第2次免疫间隔7 d,第2次与第3次免疫间隔14 d,每次免疫1 mg TsTRE重组蛋白,免疫前和每次免疫后收集一次血清,用于后续试验。
1.2.5 间接免疫荧光方法定位 TsTRE蛋白按1.2.2所述方法获取小鼠腿肌制备冰冻切片,并收集2 000条肌幼虫置于1.5 mL离心管内;1 mL 4%多聚甲醛固定10 min;1mL PBS缓冲液清洗2~3次,每次5 min;1 mL 1% Triton X-100透膜20 min,清洗同上;滴加1 mL即用型山羊血清37 ℃封闭1 h,清洗同上;一抗为rabbit anti-TsTREIgG(1∶500倍稀释)4 ℃孵育过夜,清洗同上;二抗为goat anti-rabbit IgG/AlexaFluor 555(1∶500倍稀释)37 ℃孵育1 h,清洗同上;其中冰冻切片使用Hochest 33342复染,清洗同上;最后滴加适量的抗荧光淬灭剂,使用激光共聚焦显微镜观察玻片,4 ℃避光下保存。
1.2.6 建立间接ELISA旋毛虫抗体检测方法
1.2.6.1 最佳包被抗原浓度和待测血清稀释度的确定 采用矩阵点样法,TsTRE蛋白稀释至1.000 0 ng/μL、0.500 0 ng/μL、0.250 0 ng/μL、0.125 0 ng/μL和0.062 5 ng/μL并包被96孔板,使用血清稀释度为1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000和1∶32 000的兔阴性血清和rabbit anti-TsTREIgG阳性血清进行检测。根据酶标仪在OD450nm处读数,计算P(阳性血清)/N(阴性血清)数值,当P/N≥2.1且为最大数值时,则为最佳条件。
1.2.6.2 最佳抗原包被条件的确定 使用最佳抗原浓度包被96孔板,分别置于4 ℃过夜、37 ℃ 1 h和37 ℃ 2 h条件下包被,对阴/阳血清进行检测,比较P/N数值。
1.2.6.3 最佳封闭液和封闭条件的确定 使用5% BSA溶液、1% BSA溶液、10%脱脂奶粉溶液和5%脱脂奶粉溶液作为封闭液,分别封闭37 ℃ 2 h、37 ℃ 1.5 h和37 ℃ 1 h,对阴/阳血清进行检测,比较P/N数值。
1.2.6.4 最佳酶标二抗稀释度和孵育条件的确定 将goat anti-rabbit IgG/HRP酶标二稀释度设置为1∶7 000、1∶8 000、1∶9 000和1∶10 000,分别孵育37 ℃ 30 min、37 ℃ 45 min和37 ℃ 60 min,对阴/阳血清进行检测,比较P/N数值。
1.2.6.5 最佳TMB反应时间的确定 将TMB反应时间分别设置为37 ℃ 5 min、37 ℃ 10 min、37 ℃ 15 min和37 ℃ 20 min,对阴/阳血清进行检测,比较P/N数值。

1.2.6.7 重复性试验 利用不同批次包被的96孔板和同批次包被的96孔板对20份感染200条旋毛虫42 d小鼠的阳性血清进行检测,每个样品重复3个孔,设置阴性血清对照孔,测量OD450nm处数值,差异系数=(标准差/平均数)×100%。
1.2.6.8 敏感性试验 利用建立的间接ELISA方法分别对不同稀释倍数的感染旋毛虫的小鼠阳性血清进行检测,每个样品重复3个孔,确定该方法的敏感性[8]。
1.2.6.9 特异性试验 利用建立的间接ELISA方法对华支睾吸虫、日本血吸虫、猪蛔虫、弓形虫和弓首蛔虫阳性血清进行检测,每个样品重复3个孔,评价该间接ELISA方法的特异性[9]。
1.2.6.10 临床检出率试验 使用上述建立的方法对20份猪阴性血清进行检测,比较OD450nm处数值与临界值之间的大小,阴性检出率=[(20份猪血清数-阳性血清数)/20份猪血清数]×100%。
2 结 果
2.1 构建pCold I-TsTRE表达质粒的结果 琼脂糖凝胶电泳结果显示,成功克隆TsTRE基因且目的基因条带大小约为1 548 bp(图1A);pMD18T-TsTRE克隆质粒和pCold I-TsTRE表达质粒的酶切条带分别有两条带,分别是1 548 bp和2 692 bp(图1B)及1 548 bp和4 377 bp(图1C)。
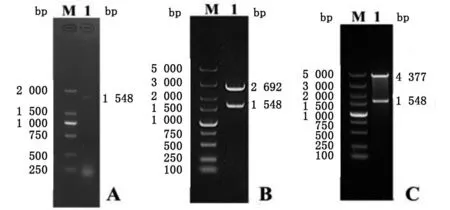
A:PCR扩增产物;B:pMD18-TRE克隆质粒双酶切产物;C:pColdI-TRE表达质粒双酶切产物。
2.2 rTsTRE蛋白表达和纯化的结果 SDS-PAGE结果显示,rTsTRE蛋白的分子量约为60 kDa(图2),rTsTRE蛋白在细胞沉淀中表达量较多(图2A);ITPG诱导最佳时间为24 h(图2B);ITPG诱导最佳浓度为1.0 mmol/L(图2C);纯化后的蛋白显示为较纯条带(图2D)。结果表明,成功重组表达rTsTRE蛋白。

A:可溶性分析.M:蛋白质分子量标准; 1:未诱导上清; 2:未诱导沉淀; 3:诱导上清; 4:诱导沉淀.B:ITPG浓度筛选.M:蛋白质分子量标准; 2-7:分别诱导6 h、10 h、14 h、18 h、20 h和24 h的沉淀.C:ITPG时间筛选; M:蛋白质分子量标准; 2-6:ITPG终浓度分别为0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L和1.0 mmol/L的沉淀.D:rTsTRE蛋白纯化.M:蛋白质分子量标准; 1:未过柱液体; 2:过柱流出液体; 3-5:经wash buffer洗杂流出液; 6-11:经elution buffer洗脱流出液。
2.3 Western-blot分析 根据Western blot结果可知,感染200条肌幼虫42 d小鼠的阳性血清能与rTsTRE蛋白结合,且在60 kDa左右处有一清晰条带(图3)。
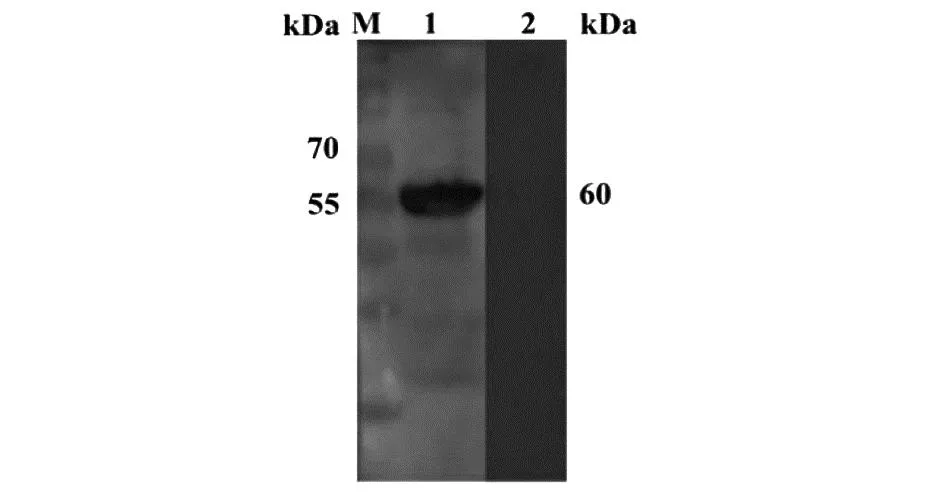
M:蛋白质分子质量标准; 1:小鼠阳性血清; 2:健康小鼠血清。
2.4 间接免疫荧光法定位 TRE蛋白分析根据激光共聚焦显微镜观察可知,红色荧光信号代表旋毛虫TRE蛋白的分布位置,发现在旋毛虫肌幼虫体内含有大量海藻糖酶,主要存在旋毛虫虫体前2/3处的杆状体细胞、尾部的生殖原基处和表皮等部位(图4)。
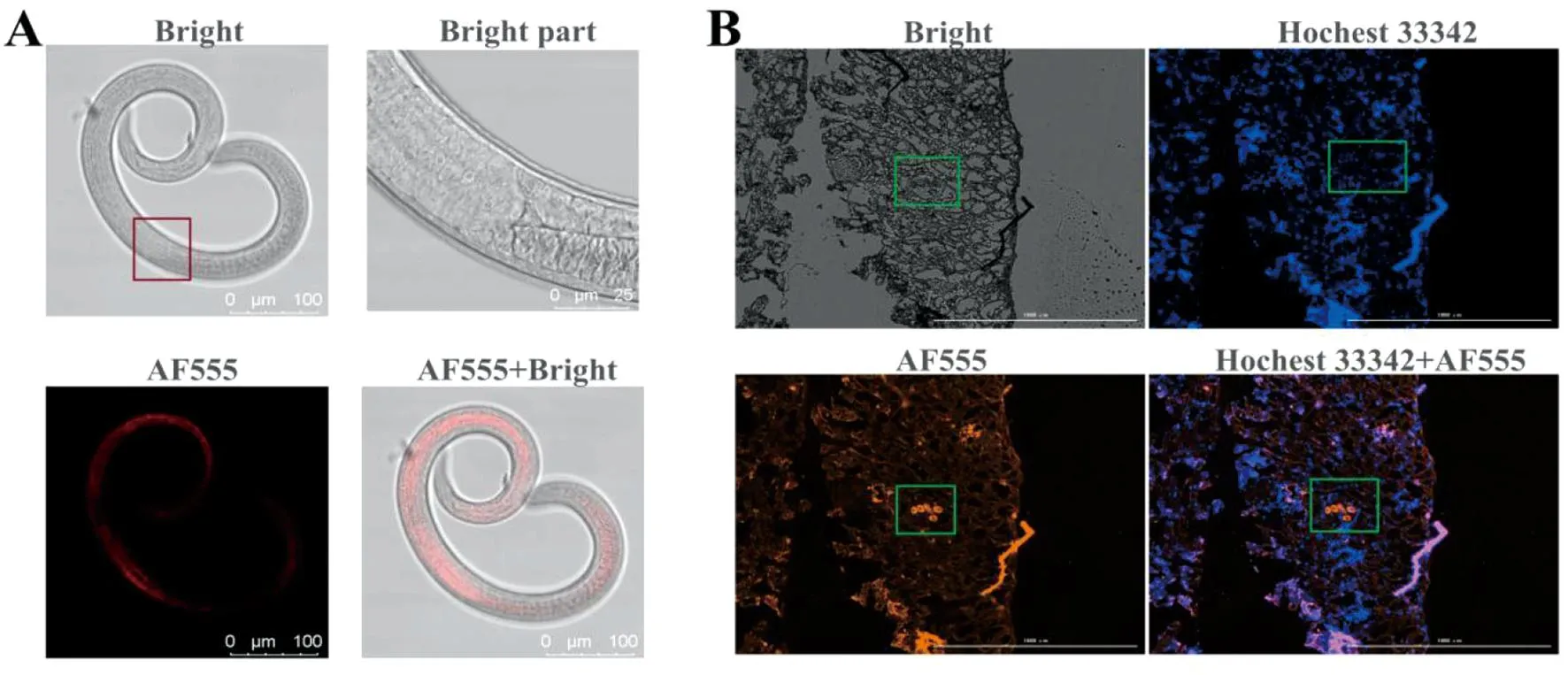
A:旋毛虫肌幼虫; B:小鼠腿肌制备的冰冻片。
2.5 间接ELISA反应条件优化结果 当P/N≥2.1时,实验数据则有意义,即选择最大P/N值,是该方法的最佳反应条件。数据结果显示,确定抗原包被浓度为1.0 ng/μL、血清稀释度为1∶16 000、抗原包被条件为4 ℃过夜、封闭液选择5%BSA且封闭条件为37 ℃封闭2 h、酶标二抗稀释度为1∶10 000且孵育条件为37 ℃孵育2 h、显色时间为10 min及阳性临界值为0.384,见表1。
2.6 重复性试验 使用同批次或不同批次包被的96孔板检测相同20份感染旋毛虫的小鼠阳性血清。通过数据统计结果可知,批内和批间变异系数分别在5.504%~7.630%之间及4.664%~9.929%之间,它们的差异系数均不大于10%,见表2。
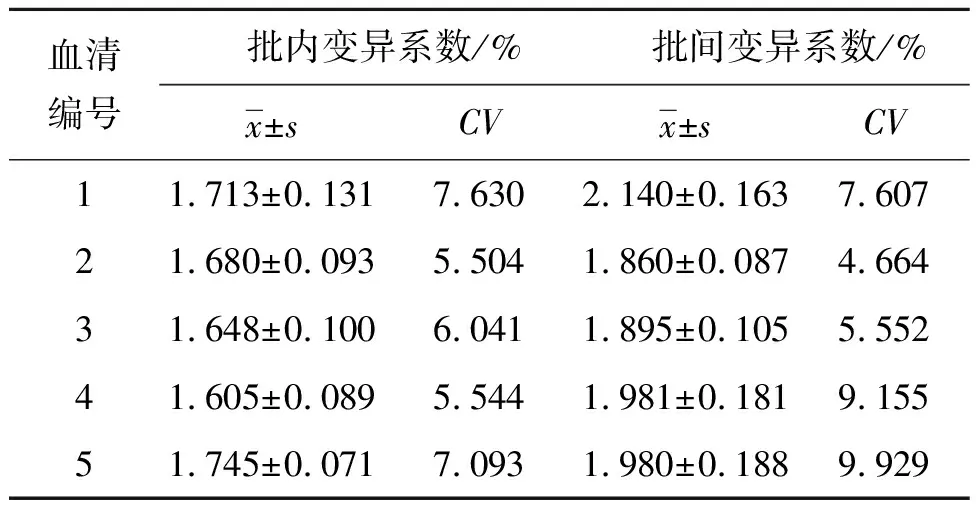
表2 重复性试验
2.7 敏感性试验 将感染旋毛虫的小鼠阳性血清从1∶10开始倍比稀释,用优化好的ELISA方法进行检测,根据检测结果判定阳性血清的最大稀释度。数据结果显示,当阳性血清稀释度为1∶1 280时,检测的OD450处值仍大于0.384且P/N大于2.1,表明该方法的最低检出效价为1∶1 280,见表3。
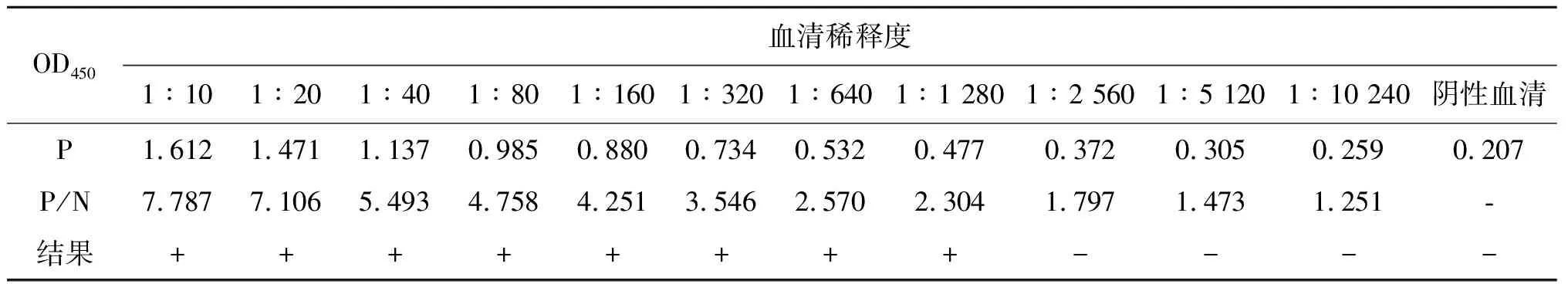
表3 敏感性试验
2.8 特异性试验 使用建立的间接ELISA方法检测感染旋毛虫的小鼠阳性血清为阳性,而检测华支睾吸虫、日本血吸虫、猪蛔虫、弓形虫、弓首蛔虫阳性血清及正常小鼠阴性血清均为阴性,表明该方法均具有良好的特异性,见表4。
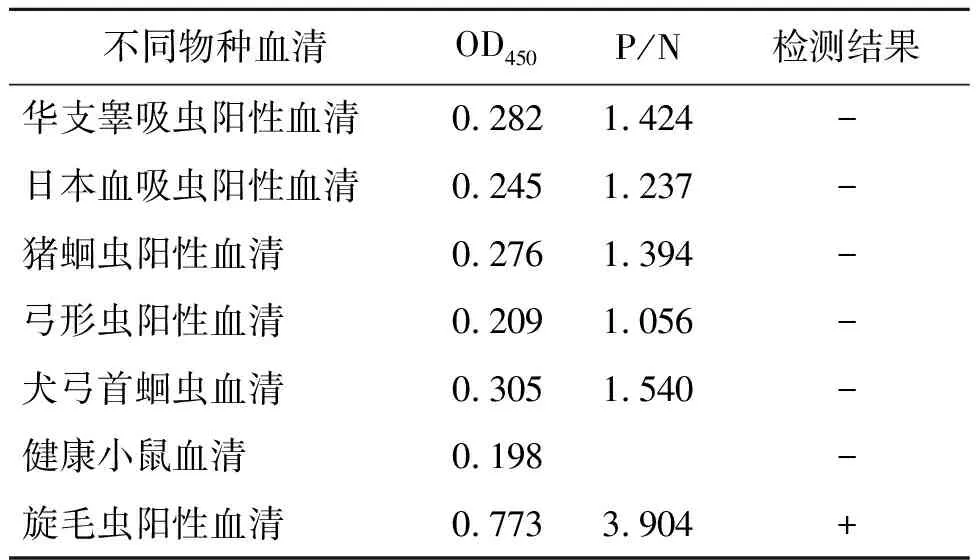
表4 特异性试验
2.9 临床检测性试验 使用建立的间接ELISA方法检测20份阴性猪血清,检测结果全部为阴性。
3 讨 论
由旋毛虫生活史可知,肠道内的肌幼虫发育为成虫后产生的新生幼虫会随血液寄生在宿主肌肉部长达数月或更久,其虫体抗原、表面抗原及ES抗原均会引起宿主的强烈免疫应答,不同抗原产生相应的特异性抗体均会停留在血液中,这为血清学诊断方法提供了理论支撑。20世纪70年代,ELISA方法首次用于检疫猪旋毛虫病[10]。在实验室诊断旋毛虫疾病方法中,肌肉镜检法是最可靠方法,且当每克肌肉中含有3个肌幼虫,则认为感染该病,但其缺点是费事费力;胃液消化法则程序复杂且不能应用于活体检测;皮肤实验方法的假阳性率极高;实时荧光定量PCR方法虽最为准确但成本较高,且假阳性和假阴性的比例也较高[11]。与其他检测方法比较,ELISA方法具有可用于活体动物检测、灵敏度高、特异性好及获取样本简便等优点,因此该方法成为实验室检测手段中最为常见的方法。最初使用ELISA方法检测旋毛虫时,多以旋毛虫的ES抗原为诊断抗原,但是ES抗原具有收集困难、耗费大量虫体样本、回收浓度较低和其成分复杂等缺点。因此,大批量制备重组蛋白则成为当今检测旋毛虫的最佳的选择[12-14]。目前,针对旋毛虫海藻糖酶的研究甚少,但是我们已经得知在旋毛虫发育阶段的各个时期都含有大量海藻糖,但含量大有不同,从新生幼虫发育到具有感染性肌幼虫阶段过程中,虫体内糖原含量提高了22倍,其中仅海藻糖含量就提高了17倍多[6]。因此,旋毛虫海藻糖酶具有重要的意义。2022年马玲玲等人原核表达产气荚膜梭菌毒素β1蛋白并以该蛋白为诊断蛋白建立间接ELISA检测方法,结果表明,当诊断抗原浓度为10 μg/mL时,待测血清的最佳稀释度为1∶16 384[15]。在本试验中,当TsTRE的浓度为1 ng/mL时,待测血清的最佳稀释度为1∶16 000,与旋毛虫GAD、GLS、p49、p53和Serpin等重组蛋白建立的间接ELISA方法相比,其待测血清的稀释倍数更大[16-17]。本试验证明,制备的兔免血清可以识别肌幼虫中的天然TsTRE蛋白,并且该蛋白分布于虫体的杆状体、尾部及表皮等部位。
综上所述,本研究所表达的旋毛虫TRE蛋白具有良好的免疫反应原性。以rTsTRE蛋白建立的间接ELISA抗体检测方法可应用于现场的临床检测,为预防和控制旋毛虫病提供基础数据和方法。
利益冲突:无
