4DCT 与T2 导航项MRI 融合定位对腹部肿瘤放疗的初步观察
2024-01-15林布雷郑宏伟
林布雷 郑宏伟
SBRT 作为一种新型的治疗手段, 在临床中表现出多种优势, 如较高的等效生物剂量、单次剂量及较少的分次等[1]。但需指出的是, 其对于运动的控制以及体位的重复性有着非常高的要求, 所以, 需给予个体化、规范化且标准化的图像引导, 以此来促进照射精度的提升[2]。针对图像引导的精度而言, 通常由精确的肿瘤靶区定位所决定, 而这通常受制于肿瘤运动, 也就是分次内运动与分次间运动[3,4]。当前, 临床多采用锥形束CT 来实施图像引导, 但却存在诸多不足, 最常见的为存在电离辐射以及较低的软组织对比度等[5]。而对于MRI 引导而言, 可以较好地弥补以上不足[6]。在实际操作中, 为了能够将两种模态[即MRI 与锥形束CT(CBCT)]所具有的优势充分结合在一起, 促进腹部肿瘤SBRT 治疗精度与可重复性的提高。本文特选取本院收治的60 例肝癌患者作为研究对象, 探讨了一种以MRI 导航项序列引导为基础的Mav-MRI 流程, 现就其具体效能报告如下。
1 资料与方法
1.1 一般资料 选择2021 年2 月~2022 年12 月本院收治的60 例肝癌患者作为研究对象, 以随机数字表法分为对照组和观察组, 每组30 例。对照组患者年龄40~71 岁, 平均年龄(51.39±7.41)岁;男18 例, 女12 例。观察组患者年龄40~70 岁, 平均年龄(51.36±3.39)岁;男17 例, 女13 例。两组患者一般资料比较差异无统计学意义(P>0.05), 具有可比性。纳入标准:①均经临床检查证实为肝癌;②均行MRI 引导下SBRT 治疗;③没有MRI 扫描禁忌, 且整个治疗流程都能够顺利完成。排除标准:①合并其他部位恶性肿瘤;②患精神疾病或存在脏器衰竭情况;③生存时间<3 个月;④治疗依从性差。
1.2 临床及模体验证 观察组用以导航项为基础的MRI 定位序列定位, 并用导航项与4DCT 各相位配准得到最一致相位CT 制定计划;对照组以常规T2加权序列定位, 用自由呼吸状态3DCT 制定计划。
实验模体:把动态胸腔运动模体系统(CRIS 008Z)当作MRI 环境兼容模体, 对肿瘤运动进行模拟, 其拥有多种运动模式, 可随意调节。针对运动控制软件而言,其能够借助压电电机, 对肿瘤假体三维方向相对应的运动幅度、速度等进行控制, 其他器官不运动。为能够较好地对人体环境进行真实模拟, 模体在器官位置及关系上都比较逼真, 且能够同时显像(CT 与MRI 下)。
1.3 对定位扫描进行模拟 选择美国瓦里安RPM 红外记录系统(型号为PaloAlto, CA), 对呼吸运动曲线进行追踪, 且准确记录, 从中对4DCT 影像进行采集。依据时间不同, 把整个呼吸周期进行若干时间相位的划分(10 个):T0~T90, 其中, T0表示的是吸气末, 而T90代表的是呼气末。
1.3.1 模体实验部分 为了能够更全面且深入地分析流程对各呼吸模式投送剂量与配准误差所产生的影响, 本文选6 种运动模式来实施模拟定位, 具体见表1。在各运动模式下, 都开展有目的性且规范化的4DCT模拟定位扫描。此外, 于自由运动模式下, 对模体的3DCT 进行采集。维持特定的运动模式与模体位置, 于MRI 加速器上开展MRI 模拟定位, 所用序列是T2W 序列(带导航项), 具体参数:采集矩阵172×227, 层厚2.4 mm, 回波时间(TE)247 ms, 重复时间(TR)2100 ms,把扫描图像命名成Nav-MRI。另外, 把所得到的自由呼吸下的T2MR 当作对比试验, 参数:TE 206 ms, TE 2100 ms, 矩阵160×224, 层厚2.4 mm。

表1 6 种运动模式(仿真运动模体)
1.3.2 入组患者部分 全部患者选择同于模体的方式来开展4DCT 模拟定位扫描, 且对自由运动这一状态下模体相对应的3DCT 进行采集。体位与定位模式一致,于MRI 加速器上, 开展规范化的MRI 模拟定位。观察组在模拟定位时, 选择T2W 序列, 参数一致于模体试验部分, 对于所得图像, 命名成Nav-MRI。对照组所得T2WI(自由呼吸状态)当作对照, 参数与模体试验相同。
1.4 制定计划 把以上CT 与MRI 定位数据输入到Monaco5.40.02 计划系统当中。围绕4DCT 数据, 开展最大密度投影重建(MIP)。用计划系统, 且联合互信息配准方法, 将Nav-MRI 配准于4DCT 各相位。依据所得到的配准结果, 获取有着最高配准一致性的相位图像, 将此相位CT 设成CT-Phase, 且于MIP 图像上, 勾画内大体肿瘤体积(IGTV), 并且于CT-Phase 上进行大体肿瘤体积(GTV)1 的勾画, 且融合于MIP 图像。把IGTV 配准于CT-Phase 上进行投影, 最终形成所需要的IGTV1。PTV-model 可通过外扩3 mm(IGTV1 三维方向上)获得, 当作观察组的计划体积。对照组于3DCT(自由呼吸状态下)上, 进行GTV2 的勾画, 且融合于MIP 图像, 把IGTV 配准于3DCT 上进行投影, 最终形成IGTV2。PTV2-model 通过扩展3 mm(IGTV2 三维方向上)而获得, 当作对照组的计划体积。
借助静态调强放射治疗技术制定计划。针对放疗处方, 设成60 Gy/30 次, 勾画危及器官。针对计划优化,用3 mm 剂量网络与蒙特卡罗(1%)对不确定度进行统计。全部计划的优化都与ICRU-62 标准相满足;在加护体积剂量当中, 有95%≥60 Gy, 最大点剂量≤66 Gy。观察组基于CT-Phase 相位图像进行计划的制定;对照组基于3DCT 图像进行计划的制定。
1.5 在线计划 针对在线计划, 选择ATP 模式开展。对于在线影像间的配准, 都选择以互信息为基础的刚性配准。而对于图像配准的操作, 即为已在线Monaco计划系统实施。在配准感兴趣上, 将保证靶区位置作为优先选择, 对在线分次相对应的配准误差予以记录。以特定体积电离室(0.6 cm3), 对模体靶区中心相对应的点剂量进行测量, 且与计划系统中的实际值进行对比。
1.6 计划验证 以ArcCheck MR 开展计划的伽马通过率分析。设置伽马通过率标准3%/2 mm。选定计算网格(3 mm), 对相应模体的三维剂量分布进行计算, 且与ArcCheck MR 测定的实际值进行对比。如果伽马通过率分析与临床标准相符, 便可开展模体实际治疗。对于实际治疗, 选择与模拟定位相同的运动模式, 生成在线计划, 实施照射。
1.7 观察指标 分析MRI 导航和自由呼吸状态下图像质量和扫描时间差异、计划验证情况, 对比两组各运动模式下的配准误差、实际测量与ATP 计算剂量。
1.8 统计学方法 采用MedCalc15.2.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差(±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验。剂量体积参数与标准误差均采用中位数(四分位间距)[M(Q3-Q1)]表示, 采用非参数Wilcoxon 秩和检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 图像质量和扫描时间差异 MRI 导航扫描时间与自由呼吸状态相比可延长95 s。以模体为对象, 开展了18 次模拟, MRI 导航扫描时间与自由呼吸状态相比可延长65 s。监控模体相对应的运动幅度、周期与实际模体之间的一致性相关系数是0.98。实际动态监控相对应的冠状位、矢状位与轴位的靶区运动范围都没有大于PTV 范围。通过将自由状态下的MRT2扫描图像与Nav-MRI 对比, 得知Nav-MRI 有着更高的清晰度,更少的伪影, 此现象在冠状位、矢状位上有着更突出的表现, 能够更清晰显示肿瘤。
2.2 计划验证 选择最小阈值10%, 与3%/2 mm 伽马通过率标准开展伽马通过率分析, 把ArcCheck MR 所测结果与计划系统剂量分布进行对比, 全部计划相对应的伽马通过率都>95%。两组对比差异无统计学意义(Z=0.417, P>0.05)。
2.3 两组各运动模式下的配准误差对比 通过对60 次的模体摆位数据进行分析, 得知摆位都是肉眼手动摆位。模体摆放数据显示:在X、Y、Z 方向上, 观察组的中位配准误差均小于对照组, 差异具有统计学意义(P<0.05);患者摆放数据显示:在X、Y、Z 方向上, 观察组中位配准误差小于对照组, 且Y方向更明显,差异具有统计学意义(P<0.05)。见表2。

表2 两组各运动模式下的配准误差对比[M(Q3-Q1), cm]
2.4 两组不同运动模式下实际测量剂量与ATP计算剂量对比 两组模体实验的实际测量剂量与计划系统对比差异无统计学意义(P>0.05)。观察组肿瘤部分的中位差值为0.025 Gy, ATP 计算剂量与实际测量剂量对比差异无统计学意义(P>0.05)。对照组中位差值为0.075 Gy,ATP 计算剂量与实际测量剂量对比差异无统计学意义(P>0.05)。见表3。
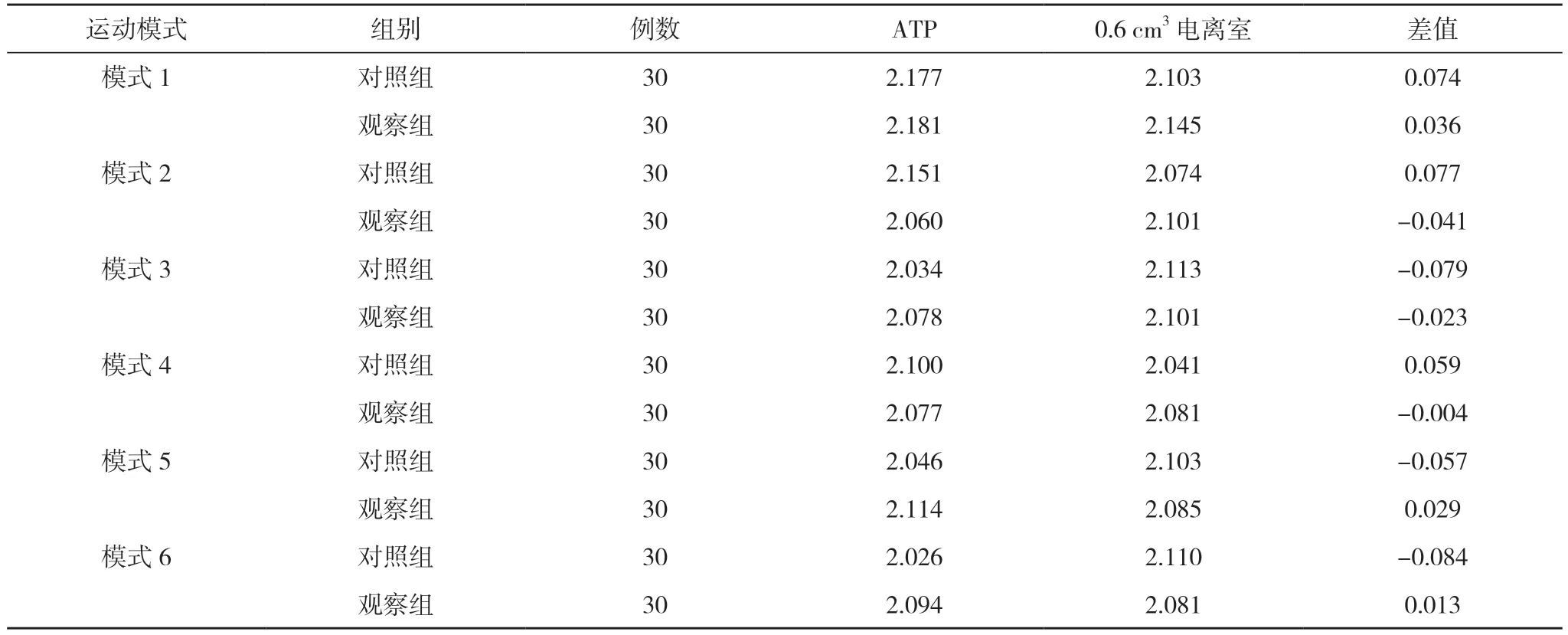
表3 两组不同运动模式下实际测量剂量与ATP 计算剂量差值(M, Gy)
3 讨论
本文探讨了一种以MRI 引导为基础的腹部肿瘤放疗流程, 其中, 把MR 导航图像当作在线影像, 从而获得所需图像, 促进在线参考图像质量提升。减少运动所导致肿瘤靶区变化, 使治疗流程变得更加规范, 促进配准误差减小以及治疗精度的提高[7]。
需要指出的是, 在MRI 辅助放疗中, 所遇到的最突出难题即为多模态影像配准, 其中包含的多模态影像即为CT 与MR 影像[8]。有报道指出, 即便为颅脑处的肿瘤, CT 与MRI 之间的配准误差仍达到了2 mm。另有研究发现, 加速器的存在同样会对磁体结构造成影响, 进而会对磁场均匀性造成影响, 使所得图像发生畸变[9]。虽然unity 所采取的是压片磁体方式, 可以将磁场不均匀所导致的图像畸变情况给予补偿, 但仍会出现图像畸变状况, 从而会对图像的配准精度造成不利影响[10]。从上可知, 于MRI 引导放疗过程中, 多模态影像配准对于放疗精度起到关键性作用[11]。
MRI 引导放疗时, 特别是腹部肿瘤, 时常会出现较大的分次间图像变化及配准误差, 另外, 还难以对靶区进行清晰辨别[12]。为将此类问题有效解决掉, 本文探讨了以MRI 引导为基础下的Nav-MRI 流程, 结果得知, 对于模体而言, 选择相同的摆位方式, 对于常规流程相对应的配准误差均值来讲, 于X 方向上, 能够达到2.84 mm, 而Y、Z 方向分别可达到5.44、1.44 mm,而通过选用本文所探讨的流程, 可使配准误差得到有效降低, X、Y、Z 方向的配准误差分别为1.79、2.44、0.99 mm。在研究患者时也有此趋势。从上可知, 本文所探讨的流程, 有助于配准误差的减小, 促进患者治疗流程在可靠性、重复性上的提高。
针对腹部肿瘤来讲, 传统的SBRT 在定义靶区上,多用的是内部靶体积(ITV), 其不足之处是会使肿瘤照射体积增大, 而较大的靶体积又会损伤正常组织[13]。而通过主动屏气系统的应用, 有助于治疗靶区大小的降低, 但对患者的依从性有着较高的要求。采取压腹方式, 也能够较少呼吸所造成的影响, 但会限制头脚方向的活动。MRI 引导放疗乃是一种在线图像引导放疗模式, 由于其没有电离辐射, 而且在软组织对比度上也较高, 故有助于以上问题的解决[14]。但MRI 也有不足,如存在较长的采集时间等。此外, 因MRI 操作方式、时间相比CT 采集, 存在着较大的差异, 非常容易导致这两种模态影像在具体的运动方式上出现不一致情况,从而引发配准误差[15]。以定位CT 为基础的最大密度投影与对靶区的分时相勾画, 可促进运动模式描述的丰富化, 减轻运动的影响, 但这样与MRI 采集影像之间开展精准配准, 以及与运动模式之间的匹配, 仍有问题存在[16]。
MRI 影像与CT 相比, 存在着较高的软组织对比度, 但如果存在磁场, 那么会影响到散射电子运动路径, 从而对剂量沉积造成影响。有研究强调, 在胰腺癌放疗中, 对于皮肤最大点相应剂量的改变, 最大能够达到21%, 而鼻咽肿瘤于空腔处, 最大剂量改变<2%。以上发现, 磁场影响着器官, 且多位于大的空腔处, 或者是组织交界处[17,18]。为分析两种流程在剂量沉积方面的差异, 本文开展了试验, 结果得知, 观察组肿瘤部分的中位差值为0.025 Gy, ATP 计算剂量与实际测量剂量对比差异无统计学意义(P>0.05)。对照组中位差值为0.075 Gy, ATP 计算剂量与实际测量剂量对比差异无统计学意义(P>0.05)。故对于本文所探讨的算法来讲, 在磁场环境下, 可以满足剂量优化需求, 促进肿瘤照射精度的提高。
综上所述, 针对腹部肿瘤患者, 在各种运动模式下, 以MRI 导航项为基础的图像引导放疗, 图像稳定性较好, 配准误差较小, 应用可行性较高。
