克雷伯菌P3生产灵菌红素的工艺研究
2024-01-15王坤阳李梦温少红焦绪栋
王坤阳 李梦 温少红 焦绪栋

摘要 [目的]为了提高灵菌红素产率,对实验室分离保存的一株产酸克雷伯菌(Klebsiella oxytoca)P3产灵菌红素的发酵条件进行优化。[方法]利用液相色谱-质谱联用技术(LC-MS)分析提取物成分和相对分子质量,通过摇瓶培养对克雷伯菌P3的发酵条件(温度、pH、NaCl浓度、诱导糖)进行研究。[结果]发酵培养产生的红色素经过LC-MS分析证明为灵菌红素,相对分子质量为324.27。确定克雷伯菌P3产灵菌红素的最佳发酵条件为24 ℃、pH 7.2~8.0、NaCl浓度0.05%~0.10%,2%果糖诱导。[结论]克雷伯菌P3的发酵产物为灵菌红素,优化后灵菌红素的产量为90~130 mg/L。
关键词 产酸克雷伯菌;灵菌红素;工艺条件优化
中图分类号 TQ920.6 文献标识码 A 文章编号 0517-6611(2024)01-0168-04
doi:10.3969/j.issn.0517-6611.2024.01.037
开放科学(资源服务)标识码(OSID):
Process Study on the Production of Prodigiosin by Klebsiella P3
WANG Kun-yang1,2,LI Meng1,2,WEN Shao-hong1 et al
(1.School of Life Sciences, Yantai University, Yantai, Shandong 264005;2. Yantai Coastal Zone Institute, Chinese Academy of Sciences, Yantai, Shandong 264003)
Abstract [Objective]In order to improve the yield of prodigiosin, the fermentation conditions of a strain of Klebsiella oxytoca P3 isolated and preserved in the laboratory to produce prodigiosin were optimized. [Method]The composition and molecular weight of the extract were analyzed by liquid chromatography-mass spectrometry (LC-MS), and the fermentation conditions (temperature, pH, NaCl concentration, inducing sugar) of P3 were studied by shaking flask culture. [Result]The red pigment produced by fermentation culture was proved to be prodigiosin by LC-MS analysis, with a molecular weight of 324.27.The optimum fermentation conditions for P3 production of prodigiosin were determined as follows:24 ℃, pH 7.2-8.0, NaCl concentration 0.05%-0.10%, 2% fructose induction. [Conclusion]The fermentation product of Klebsiella P3 was prodigiosin, and the optimized yield of prodigiosin was 90-130 mg/L.
Key words Klebsiella oxytoca;Prodigiosin;Process condition optimization
作者簡介 王坤阳(1996—),男,山东临沂人,硕士研究生,研究方向:生物资源利用。*通信作者,高级工程师,博士,从事生物医药与医养健康产品开发等研究。
收稿日期 2023-02-10
灵菌红素(prodigiosin,PG)是一类具有三吡咯环骨架结构的天然红色素家族的总称,分子式C20H25N3O,最早于黏质沙雷氏菌中被发现[1]。灵菌红素是由微生物代谢产生的一种红色素,它存在于微生物细胞的细胞壁内,难溶于水且对光反应敏感,易溶于甲醇、乙醚、乙醇、丙酮和氯仿等有机溶剂,颜色会随着溶液体系pH的改变而变化[2]。研究发现灵菌红素具有抗细菌、抗真菌[3]、抗原生动物[4]等活性,同时也有较强的免疫抑制和抗肿瘤活性[5]以及除藻活性[6],因此受到广泛关注。
灵菌红素的制备主要有化学合成和生物发酵2种方法。20世纪60年代,Rapoport等[7]首次描述了灵菌红素化学合成的全过程,但该化学合成途径复杂,反应步骤多、产率低,大规模制备一直未能实现[8]。灵菌红素的生产目前以微生物发酵法为主,研究内容包括发酵培养基的优化、发酵参数的优化以及对菌种和基因的改造等[9]。生物发酵法对环境友好,制备条件温和,具备易于工业化生产的优势[10]。优质菌株缺乏、发酵周期长、产品得率低、生产成本高、纯化分离过程复杂等问题仍然是制约灵菌红素规模应用的瓶颈。该研究对一株实验室分离保存的产红色素的克雷伯菌P3进行发酵培养,提取并确认其所产的色素,在此基础上,对该菌的培养温度、pH、NaCl浓度、诱导剂类型等进行优化,以期为灵菌红素的产业化开发提供了条件。
1 材料与方法
1.1 试验菌株
该试验所用菌株为烟台海岸带区域土壤中筛选获得的一株红色素产生菌P3,该菌为产酸克雷伯菌(Klebsiella oxytoca),于2013年6月24日在中国微生物菌种保藏管理委员会普通微生物中心CGMCC保藏,保藏编号为CGMCC No.7816。
1.2 培养基
LB液体培养基:酵母粉5 g,胰蛋白胨10 g,NaCl 10 g,用去离子水定容至1 L,121 ℃灭菌30 min;固体培养基在此基础上加12 g琼脂粉。TSB液体培养基:TSB培养基固体30 g,加适量去离子水煮沸溶解,定容至1 L,121 ℃高温灭菌30 min;固体培养基在此基础上加12 g琼脂粉。无机盐培养基:NaCl 1 g,KH2PO4 1 g,K2HPO4 3 g,NH4HO3 2 g,NH4Cl 1 g,MgSO4 1 g,用去离子水定容至1 L,调节pH 7.0~7.4,121 ℃灭菌30 min。马铃薯液体培养基(PDA):葡萄糖20 g,马铃薯200 g,加入去离子水定容至1 L,121 ℃灭菌30 min;固体培养基在此基础上加15~20 g琼脂粉。
1.3 菌种鉴定
将克雷伯菌P3在LB固体培养基上划线分离培养,观察平板上菌落形态,并在显微镜下观察记录其细胞形态。采用CTAB法提取基因组DNA,以此为模板进行PCR扩增16S rDNA基因,测序结果利用Blast与已报道的序列做对比。
1.4 菌种发酵
种子液在28 ℃、140 r/min摇床培养24 h后,按1%接种量转接于无机盐培养基中,摇瓶培养24 h,观察发酵液的颜色变化,继续发酵至48 h。取24 h的发酵液在有光与避光条件下分别放置4 h,观察发酵液颜色变化。
1.5 产物的分离提取与分析鉴定
1.5.1
提取色素。按1%接种量吸取种子液转接于无机盐培养基中,摇瓶培养24 h,将发酵液分装于50 mL离心管中离心,回收上清并用等体积的乙酸乙酯萃取,沉淀加入20 mL丙酮充分振荡,离心提取2次;在圆底烧瓶中加入乙酸乙酯与丙酮的回收液于50 ℃旋蒸至恒重,称量。将干燥粗提物分别溶于50 mL甲醇溶液和100 mL DMSO溶液中。
1.5.2
酸碱法定性分析提取物成分。取溶于甲醇溶液的样品,向其中分别滴加盐酸和氢氧化钠,观察其在酸性和碱性条件下的颜色变化。
1.5.3
紫外吸收光谱分析提取物成分。分别取2 μL溶于甲醇溶液及DMSO溶液中的产物粗品,绘制2种样品的吸收光谱曲线,分析其光谱特征。
1.5.4
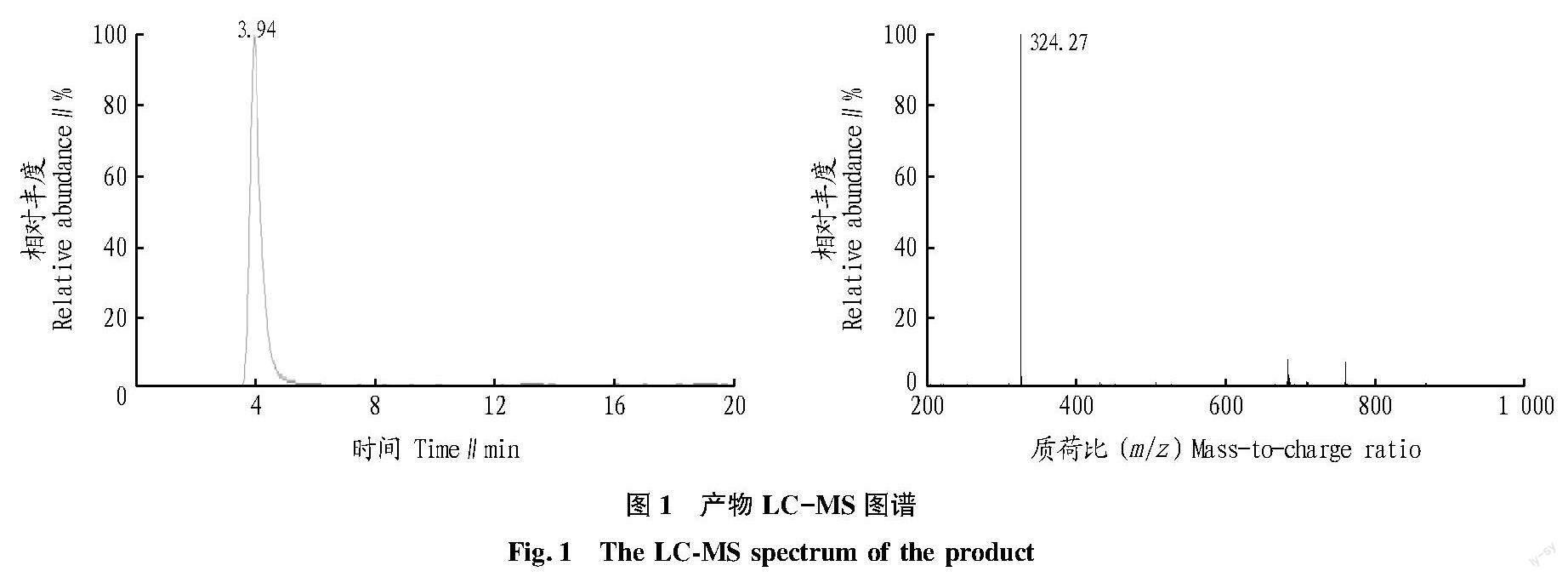
液相色谱-质谱联用(LC-MS)分析提取物成分。取10 μL溶于甲醇溶液的样品进行LC-MS分析。色谱条件:Agilent 1200型液相色谱仪;色谱柱为Agilent Zorbax SB-C18(50.0 mm×2.1 mm,1.8 μm),流动相为甲醇∶0.1%甲酸水溶液(70∶30),分析时间10 min;柱温25 ℃;流速0.35 mL/min。质谱条件:AgilentG6220A飞行时间质谱仪;离子化方式为ESI(+);质量扫描范围m/z 110~1 000;毛细管电压4 000 V;雾化气压力206 844 Pa;干燥氣流速度10 L/min;干燥温度350 ℃;碎片电压180 V;选择参比液作实时的质量数矫正。
1.6 克雷伯菌P3发酵条件优化
1.6.1 克雷伯菌P3生长与产物产量的关系。将克雷伯菌P3的种子液按1%接种量转接于装有无机盐培养基的250 mL三角瓶中,2%果糖诱导,28 ℃、130~140 r/min摇瓶发酵培养,从培养4 h开始,每隔2 h测定发酵液的吸光度。在600 nm处测定克雷伯菌P3的生物量,537 nm处测定灵菌红素产量,利用比色法取吸光度并绘制灵菌红素产量与菌体生长曲线。
1.6.2
温度对克雷伯菌P3生长及产物产量的影响。将克雷伯菌P3的种子液按1%接种量转接于装有无机盐培养基的250 mL三角瓶中,2%果糖诱导,分别于20、24、28、32、36 ℃摇床中发酵培养,在色素生产的最佳点测定其吸光度并记录。
1.6.3
pH对克雷伯菌P3生长及产物产量的影响。配制pH分别为4.0、6.0、7.2、8.0、10.0的无机盐培养基,将克雷伯菌P3的种子液按1%接种量转接于装有不同pH无机盐培养基的250 mL三角瓶中,2%果糖诱导,于24 ℃摇床中发酵培养,在色素生产的最佳点测定其吸光度并记录。
1.6.4
NaCl浓度对克雷伯菌P3生长及产物产量的影响。配制NaCl浓度分别为0、0.05%、0.10%、0.20%的无机盐培养基,将克雷伯菌P3的种子液按1%接种量转接于装有不同NaCl浓度无机盐培养基的250 mL三角瓶中,2%果糖诱导,于24 ℃摇床中发酵培养,在色素生产的最佳点测定其吸光度并记录。
1.6.5
糖诱导对克雷伯菌P3生长及产物产量的影响。将克雷伯菌P3的种子液按1%接种量转接于分装好的无机盐培养基中,分别用2%果糖、蔗糖、葡萄糖诱导,于24 ℃摇床中发酵培养,在色素生产的最佳点测定其吸光度并记录。
1.7 产物抑菌试验
采用滤纸片法测定产物的抑菌能力。分别将金黄色葡萄球菌、甲型副伤寒沙门菌、铜绿假单胞菌接种到LB液体培养基中,摇瓶培养24 h,分别取适量菌体均匀涂布到LB固体培养基上;取溶于甲醇溶液与DMSO溶液中的样品各2 mL,放入灭好菌的滤纸片,充分浸润后沥干液体,无菌条件下放置到上述涂布菌株的固体培养基上,甲醇溶液与DMSO溶液作为空白对照,37 ℃培养24 h,观察有无抑菌圈及测量抑菌圈的大小。
2 结果与分析
2.1 菌种鉴定
该菌菌落在LB培养基上呈红色,规则的圆形,表面湿润,革兰氏染色阴性;该菌株16S rDNA基因序列提交至GenBank,登录号为KF657724;采用NCBI数据库在线程序BLAST分析,与已知微生物的16S rDNA基因序列比对并结合显微鉴定结果,确定该菌为一株产酸克雷伯菌。
2.2 菌种发酵
在发酵0~24 h,发酵液颜色由无色变为红色;继续发酵至48 h,颜色逐渐变浅。分析原因可能是作为代谢副产物,色素随细菌的生长不断积累,细菌生长至稳定期后,随着培养基中营养成分的消耗,色素的产量趋于稳定;到达衰退期后,由于培养基中的营养成分消耗殆尽,细菌为了维持自身生存,一方面减少了色素的生产,另一方面可能对色素进行了降解利用。发酵24 h后光照条件下放置4 h,发酵液没有明显变化。
2.3 产物的分离提取与分析鉴定
发酵液24 ℃、150 r/min摇床培养24 h后,离心后取发酵液,分别用乙酸乙酯与丙酮萃取旋蒸至恒重,混合后冷冻干燥得到的粗产物产量为70~90 mg/L。
2.3.1
色素酸碱法定性分析。甲醇溶液中的色素粗品出现了酸性条件下红色、碱性条件下橙黄色的特征反应。与冯苗等[2]报道的文献一致,初步判断该色素中可能含有灵菌红素。
2.3.2 色素紫外吸收光谱分析。对该色素粗品的甲醇溶液和DMSO溶液分别进行紫外-可见吸收光谱扫描,发现该色素在甲醇溶液中的特征吸收峰出现在537 nm处,在DMSO溶液中的特征吸收峰出现在480 nm左右。与报道中灵菌红素在酸性条件下特征吸收峰位于535~540 nm,碱性条件下位于466~480 nm的结果基本一致[11]。推测该色素成分主要为灵菌红素。
2.3.3
色素LC-MS分析。通过LC-MS分析(图1)显示,该色素在二级色谱中形成单一峰,显示成分较为单一;质谱图显示该色素的相对分子量为324.27。通过LC-MS分析,产物可以得到离子碎片为m/z 309、m/z 252和m/z 221等。
2.4 克雷伯菌P3发酵条件优化
2.4.1 菌体生长与产物产量的关系。以时间为横坐标、吸光度为纵坐标绘制灵菌红素(PG)产量和菌体生长曲线,如图2所示,其中OD600代表菌体生长曲线,OD537代表PG产量。从图2可以看出,克雷伯菌P3发酵所产灵菌红素产量及生物量均呈现先增加后稳定再下降的趋势,在20 h达到较高水平,24 h达到高峰,最佳色素生产时间为20 h。
2.4.2
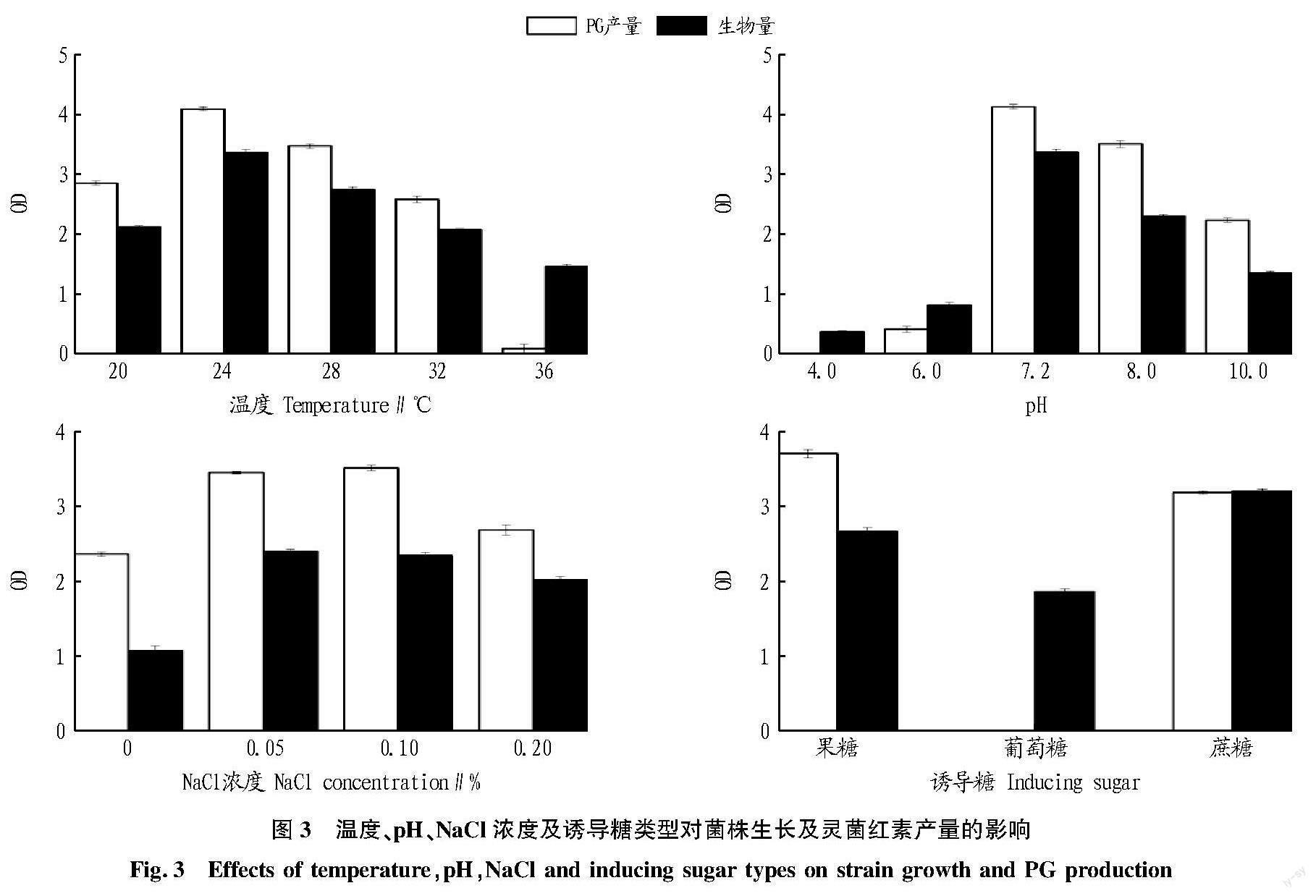
温度对菌株生长及产物产量的影响。从图3可以看
出,在20 ℃时,生物量及灵菌红素产量均较低,随着温度升高呈上升趋势,超过24 ℃时生物量及灵菌红素产量都开始下降。由此可见,克雷伯菌P3最佳培养温度为24 ℃。
2.4.3
pH对菌株生长及产物产量的影响。从图3可以看出,不同pH对灵菌红素产量与菌体生长有较大影响。pH为4.0时,不产色素,菌体生物量稍有增加;pH为6.0时,克雷
伯菌P3开始生长并产生色素;pH为7.2时生物量和色素生
产达到高峰,pH继续增大,灵菌红素产量和生物量都开始下降,生产灵菌红素最佳pH为7.2~8.0。
2.4.4
NaCl浓度对菌株生长及灵菌红素产量的影响。从图3可以看出,克雷伯菌P3在不同NaCl浓度梯度下均可增加生物量并产生灵菌红素。克雷伯菌P3在NaCl浓度为0时,菌体生物量和灵菌红素产量相对较低;在NaCl浓度为0.05%时,菌体生物量和灵菌红素产量都达到较高水平,但NaCl浓度达到0.20%时菌体生物量及灵菌红素产量都降低。克雷伯菌P3最适宜增加生物量并产生灵菌红素的NaCl浓度为0.05%~0.10%。
2.4.5
诱导糖类型对菌株生长及灵菌红素产量的影响。从图3可以看出,克雷伯菌P3在果糖和蔗糖存在条件下菌体生物量和灵菌红素产量均较高,但是果糖效果更佳;在葡萄糖诱导下并不产色素。
综上所述,克雷伯菌P3利用改良的无机盐培养基发酵培养,NaCl浓度为0.05%~0.10%。发酵条件最终确定为24 ℃培养20 h,pH维持在7.2~8.0,利用2%果糖为诱导糖,发酵结束后萃取蒸馏,冷冻干燥后得到的灵菌红素粗品产量为90~130 mg/L。
2.5 抑菌试验
产物仅在溶于DMSO溶液中时对金黄色葡萄球菌、甲型副伤寒沙门菌、铜绿假单胞菌有抑菌活性,抑菌圈直径分别为8、7、7 mm。
3 讨论与结论
自灵菌红素被发现以来,诸多研究人员围绕灵菌红素的产生菌的获取及发酵制备开展了一系列工作。倪亮等[12]经优化后的培养基摇瓶发酵,培养34 h后灵菌红素产量达到317.23 mg/L;Kavitha等[13]采用响应面法统计模型筛选最佳培养条件,摇瓶培养48 h得到灵菌红素的浓度为789 mg/L;李颖等[14]通过从土壤中筛选得到一株黏质沙雷菌,利用小型发酵罐进行发酵14 h,灵菌红素产量最大值可达到1 212.7 mg/L;Cang等[15]以一株可以利用乙醇的S.marcescens S389为出发菌株,摇瓶培养48 h,产量提高到2.95 g/L;Bae等[16]以Serratia sp.KH-95為出发菌株,利用反应器扩大发酵生产灵菌红素,得到了灵菌红素产量为13.1 g/L。灵菌红素的微生物生产通常是通过液体发酵培养,也有一些研究者采用固态发酵培养。例如,De Araújo等[17]通过固体培养基,在28 ℃下发酵S.marcescens获得了49.5 mg/mL的灵菌红素产量。
靈菌红素是一种暗红色的色素,并随着溶液体系的酸碱度而变化,在酸性环境下呈现红色,在碱性或中性环境下呈橙黄色,在酸性环境下会更稳定。灵菌红素在不同pH条件下呈现特有的吸收波长,酸性条件下在535~540 nm有特征吸收峰,碱性条件下在466~480 nm有特征吸收峰。该试验对提取物进行波长扫描,在甲醇溶液中的特征吸收峰出现在537 nm处,在DMSO溶液中的特征吸收峰出现在480 nm左右。在LC-MS分析中,色素提取物相对分子质量为324.27,离子碎片为m/z 309、m/z 252和m/z 221等,与Lee等[18]的研究结果基本一致,确定克雷伯菌P3菌株产的红色素为灵菌红素。对克雷伯菌P3产灵菌红素的发酵条件进行优化,确定较优的发酵条件为无机盐培养基,温度24 ℃,培养时间20 h,pH为7.2~8.0,2%果糖诱导,NaCl浓度0.05%~0.10%,优化后灵菌红素产量为90~130 mg/L。对灵菌红素进行抑菌试验,发现产物溶于DMSO溶液时对金黄色葡萄球菌、甲型副伤寒沙门菌、铜绿假单胞菌3株菌出现抑菌效果。
该试验通过改变菌株的培养基与培养条件,使得灵菌红素的产量得到提高,并初步研究了所得灵菌红素的抗菌性能,但是对此灵菌红素的其他功能研究鲜见报道,灵菌红素的抗癌性能、化妆品领域及食品领域都是现在研究的热点,该试验提供了一种生产灵菌红素的方法,可为以后的研究提供方法及思路。
参考文献
[1]洪伟,孙浩浩,薛正莲.粘质沙雷氏菌YW-3-10灵菌红素发酵条件优化[J].赣南师范大学学报,2022,43(3):85-90.
[2]冯苗,朱坤福,田延军,等.灵菌红素的研究进展[J].中国酿造,2021,40(10):19-28.
[3]ALIJANI Z,AMINI J,ASHENGROPH M,et al.Antifungal activity of Serratia rubidaea Mar61-01 purified prodigiosin against Colletotrichum nymphaeae,the causal agent of strawberry anthracnose[J].Journal of plant growth regulation,2022,41(2):585-595.
[4]EHRENKAUFER G,LI P Y,STEBBINS E E,et al.Identification of anisomycin,prodigiosin and obatoclax as compounds with broad-spectrum anti-parasitic activity[J].PLoS neglected tropical diseases,2020,14(3):1-21.
[5]LUONG V T,LE THANH N S,TUYEN D T,et al.Prodigiosin purification from Serratia marcescens M10 and its antitumor activities[J].Vietnam journal of biotechnology,2021,19(2):289-299.
[6]ZHANG H J,WANG H,ZHENG W,et al.Toxic effects of prodigiosin secreted by Hahella sp.KA22 on harmful alga Phaeocystis globosa[J].Frontiers in microbiology,2017,8:1-12.
[7]RAPOPORT H,HOLDEN K G.The synthesis of prodigiosin[J].Journal of the American chemical society,1962,84(4):635-642.
[8]葛明,冯佳,李莹,等.粘质沙雷氏菌高产发酵灵菌红素的工艺优化及抗病毒活性[J].中国烟草科学,2022,43(3):20-25.
[9]SHAIKH Z.Biosynthesis of prodigiosin and its applications[J].IOSR journal of pharmacy and biological sciences,2016,11(6):1-28.
[10]尤忠毓,王玉洁,孙诗清,等.微生物发酵法生产灵菌红素研究进展[J].生物工程学报,2016,32(10):1332-1347.
[11]LEWIS S M,CORPE W A.Prodigiosin-producing bacteria from marine sources[J].Applied microbiology,1964,12(1):13-17.
[12]倪亮,张森,郭盛,等.苦参种子深加工过程油脂类副产物发酵产灵菌红素的研究[J].生物技术通报,2020,36(5):130-138.
[13]KAVITHA R,DAMODHARAN N.Statistical optimization of prodigiosin production by plackett-burman design for bacteria isolated from Indian marine soil[J].Journal of Pure and applied microbiology,2021,15(3):1517-1526.
[14]李颖,邓毛程,李静,等.灵菌红素产生菌鉴定与基础发酵条件的研究[J].广东轻工职业技术学院学报,2020,19(4):1-6.
[15]CANG S,SANADA M,JOHDO O,et al.High production of prodigiosin by Serratia marcescens grown on ethanol[J].Biotechnology letters,2000,22:1761-1765.
[16]BAE J,MOON H,OH KK,et al.A novel bioreactor with an internal adsorbent for integrated fermentation and recovery of prodigiosin-like pigment produced from Serratia sp.KH-95[J].Biotechnology letters,2001,23(16):1315-1319.
[17]DE ARAU'JO H W C,FUKUSHIMA K,TAKAKI G M C,et al.Prodigiosin production by Serratia marcescens UCP 1549 using renewable-resources as a low cost substrate[J].Molecules,2010,15(10):6931-6940.
[18]LEE J S,KIM Y S,PARK S,et al.Exceptional production of both prodigiosin and cycloprodigiosin as major metabolic constituents by a novel marine bacterium,Zooshikella rubidus S1-1[J].Applied and environmental microbiology,2011,77(14):4967-4973.
