涮辣和昆明皱皮椒Kas生物信息学及表达分析
2024-01-15周慧丹李孟娟吴睿李平平张芮豪吕俊恒邓明华
周慧丹 李孟娟 吴睿 李平平 张芮豪 吕俊恒 邓明华







摘要 [目的]探究涮辣與昆明皱皮椒3-氧酰基[酰基载体蛋白]还原酶(3-oxoacyl-[acyl-carrier-protein]synthase,Kas)的差异。[方法]特异性扩增了Kas,并进行了生物信息学分析。利用荧光定量 PCR 及酶活性测定方法测定了不同发育时期、不同环境及6种外源因子处理下 Kas 表达量及酶活性。[结果]扩增得到的涮辣和昆明皱皮椒 Kas 基因均为 1 467 bp,编码 488个氨基酸。Kas为脂溶性、亲水性的稳定蛋白,无信号肽与跨膜结构,主要定位于质膜。在不同发育阶段,2种辣椒 Kas 表达水平与酶活性的趋势均为先升高后急剧降低,且在大部分发育阶段均表现为露地栽培高于大棚栽培;同一环境条件下,涮辣 Kas 表达与酶活性整体高于昆明皱皮椒;且不同外源物质在一定时间内可影响涮辣 Kas 的表达,其中MeJA和SA处理对Kas表达量影响较大。[结论]涮辣与昆明皱皮椒 Kas 基因和蛋白特性相似,但存在差异,在辣椒生长发育、环境和外源物质响应方面有重要功能。
关键词 涮辣;昆明皱皮椒;3-氧酰基[酰基载体蛋白]还原酶(Kas);生物信息学
中图分类号 Q943.2 文献标识码 A 文章编号 0517-6611(2024)01-0090-08
doi:10.3969/j.issn.0517-6611.2024.01.019
开放科学(资源服务)标识码(OSID):
Bioinformatics and Expression Analysis of 3-oxoacyl-[acyl-carrier-protein]Synthase (Kas) from Capsicum chinense and C. annuum
ZHOU Hui-dan, LI Meng-juan, WU Rui et al
(College of Landscape and Horticulture, Yunnan Agricultural University, Kunming, Yunnan 650201)
Abstract [Objective]To investigate the difference of 3-oxoacyl-[acyl-carrier-protein]synthase (Kas) between Capsicum chinense and C. annuum
. [Method]Kas was specifically amplified and bioinformatic analysis was performed.Kas expression and enzyme activity were determined by quantitative PCR and enzyme activity assay under different development stages, different environments and six exogenous factors. [Result]The Kas gene of Capsicum chinense and C. annuum was 1 467 bp, encoding 488 amino acids. Kas is a lipopolysaccharide, hydrophilic and stable protein with no signal peptide and transmembrane structure, which is mainly located in the plasma membrane. At different developmental stages, Kas expression level and enzyme activity of both kinds of capsicum were increased first and then decreased sharply, and in most developmental stages, they were higher in open field than in greenhouse cultivation. Under the same environmental conditions, Kas expression and enzyme activity in Capsicum chinense were higher than those in C.annuum. In addition, different exogenous substances could affect Kas expression in Capsicum chinense in a certain period of time, among which MeJA and SA treatments had a greater effect on Kas expression. [Conclusion]The Kas gene and protein characteristics were similar but different between Capsicum chinense and C. annuum,which had important functions in pepper growth and development, environment and foreign substance response.
Key words Capsicum chinense;C.annuum;3-oxoacyl-[Acyl-carrier-protein]synthase (Kas);Bioinformatics
基金项目 国家自然科学基金项目(32160708);云南省科技计划项目(202102AE090005,202205AR070001)。
作者简介 周慧丹(1998—),女,云南昆明人,硕士研究生,研究方向:蔬菜遗传育种。
*通信作者,教授,博士,从事园艺植物生物学研究。
收稿日期 2023-02-06
辣椒(Capsicum annuum L.)为茄科辣椒属的一年生或者有限多年生的草本植物。辣椒在全世界种植广泛,我国是辣椒的生产大国,种植历史已有300余年。辣椒是維生素和色素的来源之一,常被用作蔬菜、香料[1]。涮辣是云南省特有的种质资源,主要分布于云南省的德宏、保山和西双版纳等地,喜温耐热,成熟果实色泽艳丽鲜红,最主要的是其辣度可与墨西哥的魔鬼椒以及印度的断魂椒相媲美,做菜时可在汤里涮涮,整锅汤就会有辣味,故取名为“涮辣”[2-4]。辣椒的特点是味道辛辣,这是由于存在一组被称为辣椒素的化合物,该类物质主要在辣椒属果实的胎盘中特异合成[5]。这些次生代谢物具有一系列的生物活性和工业应用,例如,辣椒素对于植物保护抵御一些食草动物、昆虫和微生物是重要的,并且可以作为鸟类传播种子的选择剂[6-7]。辣椒素类物质具有多种药理作用,已被用于制造个人化学防御装置以及用于缓解关节炎、疱疹或肿瘤切除术后疼痛的护垫和乳膏等[8-12]。辣椒素类物质只在辣椒属中合成和积累,研究辣椒中辣椒素的形成机制,对于提高辣椒素产量具有重要意义。
辣椒素主要在辣椒果实的胎盘组织中合成[13],并在开花后10~20 d开始积累,20~40 d增加,达到最大值后递减[14]。辣椒素是通过源自类苯丙酸途径的香草胺及源自支链脂肪酸途径的一系列支链脂肪酸部分缩合而成的。苯丙氨酸是苯丙素生物合成的主要前体,而缬氨酸或亮氨酸是支链脂肪酸合成的前体底物,最终用于辣椒素生物合成[15]。由于植物的遗传组成不同,辣椒果实可以表现出不同程度的辣味,但是辣味也依赖于果实的发育阶段和辣椒生长的环境条件[16-17]。在辣椒素生物合成途径中,3-氧酰基(酰基载体蛋白)还原酶(Kas)位于脂肪酸合成支链上。Kas 与酰基转运蛋白酶(Acl)和 ACP-酰基硫酯酶(FatA)组成了脂肪酸合酶(FAS)复合体,催化脂肪链的延伸[18]。Aluru等[19]从辛辣型辣椒品种Habanero果实的胎座中筛选到8个编码辣椒素生物合成活性物质的cDNA克隆,并发现其中3-酮酯酰-ACP合成酶基因(Kas)、依赖磷酸吡哆醛的转氨酶基因(pAmt),乙酰辅酶A转移酶基因(4A1)是胎座特异表达基因。Del等[20]基于基因沉默(VIGS)法沉默Comt、pAmt和Kas基因,发现沉默后的辣椒果实中辣椒素积累减少,由此证实了辣椒素的积累与Kas等基因的表达相关。利用病毒介导的基因沉默技术研究了Comt、pAmt 和Kas基因表达水平与辣椒素的积累量关系。任何一个基因Comt、pAmt 和 Kas的沉默都会导致辣椒素含量的急剧下降。雷建军等[21]获得了5个辣椒转录因子,同时利用基因沉默等技术解释了pAMT、Kas等基因对辣椒素含量的正向指导作用。辣椒素的合成积累与环境条件也密切相关,有研究表明,在干旱、高温、光照条件下辣椒素类物质的积累增加[22-25]。Medina-Lara等[26]研究表明,氮肥显著增加了辣椒的生长和果实产量,同时辣椒素含量也维持在较高水平。Tewksbury等[27]在对野生辣椒调查中指出,总辣椒素含量随着海拔的升高而显著增加。大量研究表明,一定浓度的外源激素处理能显著提高辣椒果实中辣椒素类物质的积累。较低浓度的水杨酸和茉莉酸甲酯喷施有利于辣椒素和二氢辣椒素的积累[28],脱落酸处理能显著提高辣椒素的含量,并在各时期都与对照有显著差异[29]。
涮辣的辣椒素含量极高,达19.814 8 mg/g,二氢辣椒素含量6.107 4 mg/g,辣度级别超过10级,且涮辣辣度为昆明皱皮椒的42.4倍[30]。笔者选取辣椒素积累差异较大的2个云南本地特色品种:涮辣和昆明皱皮椒作为试验材料,研究辣椒素的合成。鉴于Kas在辣椒素生物合成方面的重要作用,且目前国内关于涮辣辣椒素合成与Kas酶的研究较少,为进一步探究涮辣辣椒素积累高的原因,以昆明皱皮椒为参照,从涮辣和皱皮椒中分离并鉴定了2条Kas基因,运用生物信息学方法分析Kas特性;利用qPCR方法测定了不同发育时期、环境条件下Kas表达水平,旨在探究涮辣与昆明皱皮椒Kas基因和酶的差异,与不同发育时期、环境条件和外源物质处理下Kas表达规律,并为解释Kas在云南特色涮辣辣椒素积累方面提供理论借鉴与参考。
1 材料与方法
1.1 材料
涮辣和昆明皱皮椒都来自云南农业大学园林园
艺学院番茄辣椒实验室,在后山露天和大棚2种环境条件下栽培。以花后每10 d为1个发育时期,选择7个发育时期的辣椒果实为试验材料,分别提取2种辣椒的RNA,再反转录为cDNA后进行Kas基因克隆,以下Kas 1为涮辣Kas,Kas 2为昆明皱皮椒Kas。
1.2 方法
1.2.1 Kas基因的分离与鉴定。
在NCBI数据库下载已有的CaKas基因序列,并根据序列设计引物(表1),委托北京擎科生物技术有限公司合成。使用北京华越洋生物技术有限公司的RNA提取试剂盒提取涮辣和昆明皱皮椒的总RNA,利用YEASEN公司的反转录试剂盒合成第一链cDNA。以cDNA为模板,使用上述引物进行PCR特异性扩增,凝胶电泳检测后回收特异性PCR产物送北京擎科生物有限公司测序,得到目的片段序列。
1.2.2 涮辣和昆明皱皮椒的Kas基因特性及蛋白特性分析。
按照表2所列方法对涮辣及昆明皱皮椒的Kas基因、蛋白特性进行分析。
1.2.3 不同发育时期涮辣与昆明皱皮椒的 Kas 表达水平测定。
利用 Primer 6 设计 qRT-PCR 引物(表 1),对大棚和露天种植的涮辣和昆明皱皮椒以 10 d 为 1 个发育时期,共对果实 7 个发育时期的 Kas 表达水平进行测定,设置3个生物学重复。采用上述方法合成 cDNA。荧光定量 PCR 反应总体系 20 μL:SYBR Premix Ex Taq Ⅱ,10.0 μL,上、下游引物各 0.4 μL,cDNA 模板 2.0 μL,ddH2O 7.2 μL,在 Eppendorf 熒光定量 PCR 仪上进行反应。试验采用相对定量的方法,以 ACTIN 基因为内参,使用 2-△△CT方法计算相对表达量。
1.2.4 不同发育时期涮辣与昆明皱皮椒的Kas酶活性测定。使用植物(Plant)3-氧酰基-酰基载体蛋白还原酶(3-ACPR)ELISA检测试剂盒进行测定,具体步骤按照试剂盒说明书进行。
1.2.5 6种不同外源因子处理涮辣及其Kas表达水平测定。
采集涮辣花后 30 d 果实,用脱落酸(ABA,0.5 mmol/L)、赤霉素(GA3,0.5 mmol/L)、过氧化氢(H2O2,30%水溶液)、茉莉酸甲酯(MeJA,0.1 mmol/L)、水杨酸(SA,0.1 mmol/L)和褪黑素(MT,0.1 mmol/L)6 种外源物质分别对果实胎座进行不同时间处理(0、3、6、12、15 h),其中 0 h 为未处理样品,以内参基因 ACTIN作为校正,测定 Kas 表达水平。
2 结果与分析
2.1 涮辣和昆明皱皮椒的Kas基因特性
2.1.1 Kas基因碱基序列对比。
以涮辣、昆明皱皮椒cDNA为模板进行Kas基因RT-PCR特异性扩增,对产物进行凝胶电泳验证后测序。测序结果经BLAST验证,涮辣Kas与NCBI 数据库中Kas(GeneID:107864098)基因序列同一性为 98.91%,皱皮椒Kas高达99.39%。开放阅读框预测显示:涮辣和昆明皱皮椒Kas基因均由1 467 个碱基组成,编码488个氨基酸残基。与昆明皱皮椒相比,涮辣Kas存在7个SNP位点:68(T to G),192(T to C),571(A to G),745(G to T),774(G to T),975(G to A),1 221(T to C)。如图1,氨基酸序列上存在3个SNP位点 23(V to G),191(T to A),249(A to S),其他碱基突变为同义突变。利用NCBI进行保守结构域预测发现,涮辣和昆明皱皮椒Kas基因的氨基酸序列在27~488这一位置上均有一段相同的结构域。
2.1.2 辣椒及其他常见茄科植物Kas上游顺式元件预测。
选择包含辣椒在内共5种茄科植物Kas基因进行上游顺式元件预测,对预测到的顺式元件进行筛选后,共得到 584 个顺式元件,其中辣椒(Capsicum annuum)93 个,番茄(Solanum lycopersicum)109 个,野生二倍体烟草(Nicotiana attenuate)83 个,烟草(Nicotiana tabacum)153 个,马铃薯(Solanum tuberosum)146 个(图 2)。预测到的顺势元件按类型可分为核心元件:-30转录起始位点、启动子和增强子区;植物激素响应元件:MeJA、GA、ABA、SA、Auxin响应元件;环境因子响应元件:光、低温、厌氧诱导响应元件;MYB结合位点:干旱诱导结合位点和MYBHv1结合位点。在辣椒中除核心元件外,还有32个其他元件。包括环境因子响应元件:12个光响应元件,6个厌氧诱导响应元件,3个低温响应元件;植物激素响应元件:MeJA、GA响应元件各2个,SA、ABA响应元件各1个;MYB结合位点:4个干旱诱导结合位点和1个MYBHv1结合位点。
2.2 涮辣与昆明皱皮椒Kas的蛋白特性
2.2.1 不同物种 Kas 蛋白保守结构。
选取包括茄科、十字花科、豆科、旋花科、锦葵科、茜草科和蔷薇科7科共 45 条 Kas 氨基酸序列进行保守 motif 分析,结果(图 3)显示:共得到 19 个显著保守的motif,其中,包括涮辣与昆明皱皮椒在内的所有植物都含有10、6、4、7、1、9、14、3、11、5、15、8、2不同保守motif。由此可推测,以上13个保守motif是Kas蛋白结构的重要组成部分,且是保证不同物种之间Kas功能相似的决定性结构。
2.2.2 涮辣与昆明皱皮椒 Kas 理化性质及亚细胞定位预测。
蛋白理化性质预测结果显示:涮辣与昆明皱皮椒Kas蛋白分子式分别为C2302H3666N644O704S22和C2306H3674N644O704S22,相对分子量分别为52 333.64和52 389.75,理论等电点(PI)均为7.98,均为脂溶性、亲水性的稳定蛋白。 BUSCA 预测结果显示,涮辣与昆明皱皮椒 Kas 定位在质膜上的确定性为 0.700。
2.2.3 涮辣与昆明皱皮椒的 Kas 蛋白二级结构。
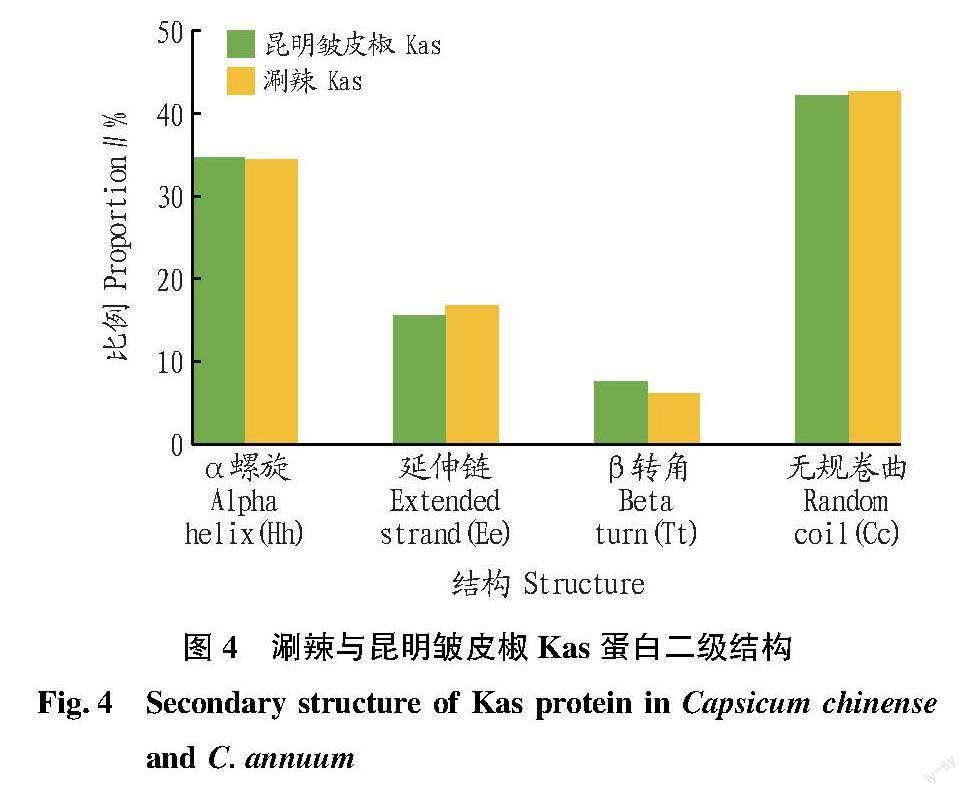
对2种辣椒Kas蛋白的二级结构进行了预测,结果显示:涮辣和昆明皱皮椒Kas蛋白均含有α螺旋、延伸链、β转角和无规卷曲4种二级结构,其中α螺旋和无规卷曲占主要部分(涮辣77.05%;昆明皱皮椒76.84%),涮辣Kas蛋白中无规卷曲和延伸链多于昆明皱皮椒,而α螺旋和β转角少于昆明皱皮椒(图4)。
2.2.4 涮辣与昆明皱皮椒Kas蛋白的三级结构。
利用 I-TASSER 预测 pAMT 三级结构模型,其中C 值代表模型置信度,范围为-5~2 ,得分越高代表模型越可靠。涮辣共构建出5个模型,其中C值最高为-0.83(图5A);昆明皱皮椒也构建出5个模型,其中最高得分为-0.53(图5D)。同时对Kas配体结合位点进行预测,其中C值为预测置信度,范围在0~1,C值越大代表准确度越高。涮辣Kas预测C值为0.43,配体名称为CER,结合位点残基为183、184、238、239、273、277、278、379、415、472、473、474(图5B);昆明皱皮椒配体结合位点得分为0.51,配体名称也为CER,结合位点残基为183、184、238、239、274、277、278、379、415、472、473、474(图5E)。然后对Kas Enzyme Commission numbers(EC)和酶活性位点进行预测,其 CscoreEC值在 0~1,值越大代表 EC 值置信度越高。涮辣Kas CscoreEC最高为0.314,EC号为2.3.1.86,无活性位点残基(图5C);昆明皱皮椒CscoreEC最高为0.414,EC号为2.3.1.41,活性位点残基为473、475、477(图5F)。
2.2.5 涮辣与昆明皱皮椒 Kas 蛋白信号肽、跨膜结构与磷酸化位点预测。
SignalP-5.0与TMHMM Server v.2.0预测结果显示,涮辣和昆明皱皮椒的Kas均无跨膜结构和信号肽。运用NetPhos 3.1 Server对涮辣与昆明皱皮椒Kas蛋白磷酸化位点进行预测,同时对预测位点在0~1进行打分,预测位点可信度随得分从0.5到1.0增加而增大,涮辣Kas评分≥0.5的磷酸化位点有63个,昆明皱皮椒有67个。以不同磷酸化类型来分,涮辣与昆明皱皮椒Kas都有13种Y型,而S型和T型存在差异,其中涮辣有36个S型,14个T型;昆明皱皮椒有39个S型,15个T型(图6)。
2.2.6 不同物种Kas系统发育树构建。
以选取的包括涮辣和昆明皱皮椒在内共45条Kas序列构建进化树(图7),结果表明:不同Kas序列在系统发育上按照茄科、十字花科、豆科、旋花科、锦葵科、茜草科和蔷薇科7个不同的科聚为四大类群。其中,茄科植物中Kas又分出众多亚支。涮辣和昆明皱皮椒Kas与同科同属的C.chinense(AAC78479.1)和C.annuum(KAF3663893.1)在系统发育上亲缘关系最近,与C.baccatum(PHT57835.1)最远;不同属中,与茄属的亲缘关系最近;不同科中,与茜草科最近,与豆科亲缘关系最远。
2.3 涮辣与昆明皱皮椒Kas基因表达及酶活性
2.3.1 不同环境条件下涮辣与昆明皱皮椒Kas基因表达。
Kas基因的表达在材料和环境间的差异十分显著。Kas基因在涮辣和昆明皱皮椒果实发育过程中的变化趋势基本一致,都是在果实发育前期(1~20 d)维持在一个较低的表达水平,但不断升高;在果实发育中期(30~50 d)维持在一个非常高的水平,其中在50 d达到最高值,是0 d的130倍左右;在果实发育的后期(60~70 d)维持在一个较低水平,且不断下降,但表达水平显著高于果实发育前期。在同一环境条件下,涮辣的表达水平要高于昆明皱皮椒;在同一材料中,大棚表达水平要显著低于露地表达水平(图8)。
2.3.2 在果实不同发育阶段和环境条件下Kas酶活性差异。
Kas酶活性在涮辣和昆明皱皮椒果实发育过程中的变化趋势基本一致,即在果实发育前期(0~20 d)维持在较低水平;在果实发育中期(30~50 d)维持在较高水平,并在花后50 d达到最高值;在果实发育后期(60~70 d),维持在较低水平,且不断下降。对同一材料果实同一发育阶段而言,大棚环境下Kas酶活性要低于露地环境。Kas 酶活性在不同材料间差异显著。在果实发育初期,涮辣和昆明皱皮椒Kas酶活性均处于较低水平,但涮辣Kas酶活性要高于昆明皱皮椒;在果实发育中期,涮辣Kas酶活性要显著高于昆明皱皮椒,且在花后40 d差异达到最大;在果实发育后期,涮辣Kas酶活性仍高于昆明皱皮椒(图9)。
2.4 不同外源物质处理对涮辣Kas基因表达的影响
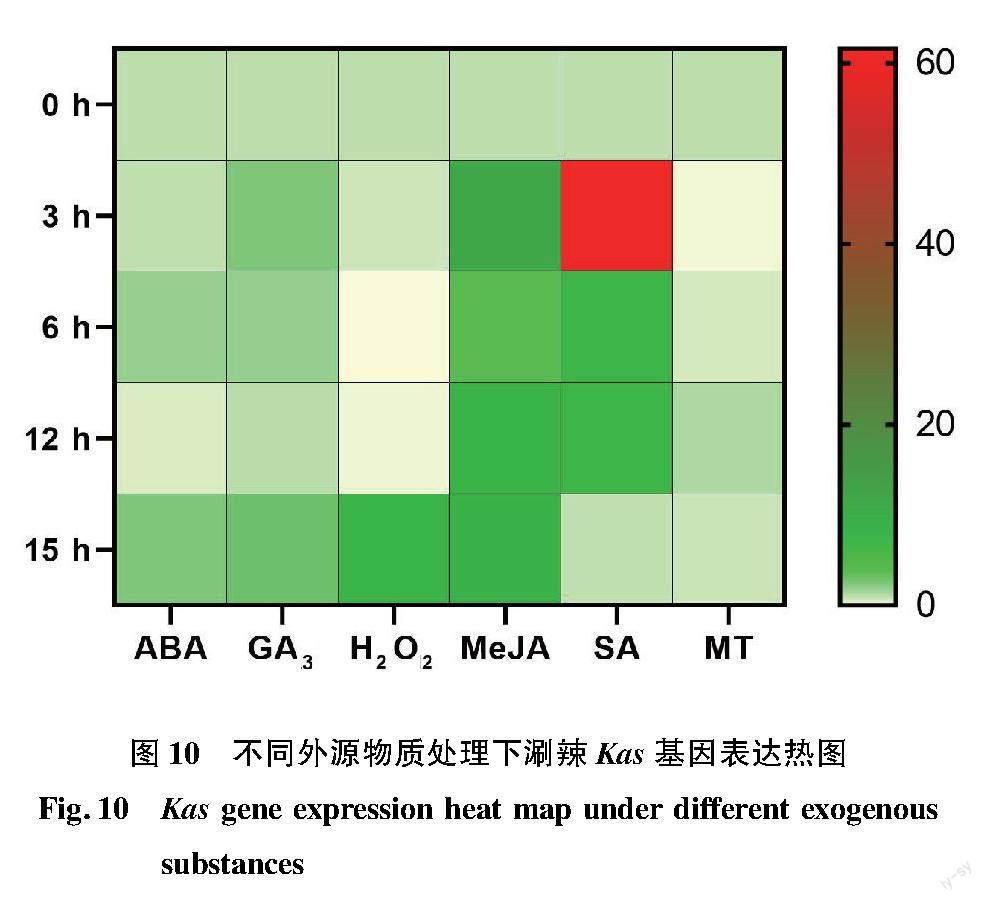
整体上看,Kas基因的表达量对MeJA和SA处理的反应最为明显。实时荧光定量结果表明,Kas基因的表达量在ABA处理下随处理时长的变化而变化,整体呈上升趋势,在3 h略微下降,6 h迅速上升,随后在12 h急速下降,15 h又上升;GA3处理下随处理时间的延长呈上升—下降—升高的变化趋势,其中15 h的表达水平最高;在H2O2处理下呈先下降后上升的变化趋势,其中15 h的表达水平最高,在3~6 h持续下降,12~15 h上升;MeJA处理下呈上升—下降—上升的趋势,其中3 h表达水平最高,于6 h迅速下降,于12 h继续上升,15 h变化趋于平缓;在SA处理下随处理时间的延长呈先上升后下降趋势,其中3 h表达水平最高,从6 h开始持续下降;在MT处理下随处理时间的延长呈下降—上升—下降的趋势,在3 h下降,6~12 h上升,在12 h的表达水平最高,于15 h再次下降(图10)。
3 讨论
3.1 2种辣椒的pAMT基因及蛋白结构差异影响辣椒素合成
辣椒素生物合成经过由苯丙氨酸途径形成香草胺或经支链脂肪酸途径,由缬氨酸或亮氨酸形成支链脂肪酸,最终香草胺和支链脂肪酸合成辣椒素,而Kas催化脂肪链的延伸。阮文渊等[31]扩增得到辣椒Kas基因DNA序列,研究结果表明,Kas主要在胎座上表达并影响辣椒素的合成。该研究利用基因克隆方法,从涮辣与昆明皱皮椒中分离并鑒定了二者的Kas基因。2种辣椒的Kas长度为1 467 bp,各自编码488个氨基酸残基。以昆明皱皮椒作为参考,发现尽管二者序列大小相同,但在涮辣Kas中存在7个SNP位点,最终导致形成3个氨基酸残基SNP位点。因此,涮辣Kas的突变可能是其产生高含量辣椒素的正向突变。
通过对不同物种Kas氨基酸序列保守motif分析,在一定程度上反映了Kas有较高的保守性,但部分物种Kas包含特有motif,也说明不同物种对Kas蛋白功能的需求存在差异。同时,不同辣椒Kas蛋白保守结构间的差异可能是辣椒素生物合成产生差异的重要原因。涮辣Kas基因的突变导致二者蛋白的二级和三级结构也发生了改变。相对于昆明皱皮椒二级结构,涮辣Kas蛋白含较少的β转角和α螺旋以及较多的无规卷曲、延伸链。预测的涮辣和昆明皱皮椒Kas的三级结构模型结果显示,2种辣椒的Kas配体名称均为CER,但二者配体结合位点存在不同,涮辣配体结合位点残基为183、184、238、239、273、277、278、379、415、472、473、474;昆明皱皮椒结合位点残基为183、184、238、239、274、277、278、379、415、472、473、474。同时预测的涮辣EC号为2.3.1.86,无活性位点残基;昆明皱皮椒EC号为2.3.1.41,活性位点残基为473、475、477。Kas活性位点的差异,可能导致了涮辣和昆明皱皮椒Kas在底物和反应特性的不同,进而影响辣椒素的合成。总而言之,Kas基因突变引起的蛋白结构差异是影响涮辣与昆明皱皮椒辣椒素含量的重要原因。
3.2 Kas参与环境、外源因子对辣椒的调控,且影响辣椒素积累
通过NCBI公共数据库,下载了包括辣椒在内的5条茄科植物Kas上游2 500 bp序列,并对其顺式元件进行了预测。结果表明,辣椒Kas基因的表达调控受到SA、MeJA等植物激素、光及低温的调控。通过对涮辣果实胎座进行6种外源植物激素处理后发现,SA、MeJA等外源物质在一定时间内影响涮辣Kas基因表达,同时这些结果在前人报道中也得了验证[32-34]。基于qPCR技术对涮辣和昆明皺皮椒Kas表达水平进行了测定和分析,结果表明,Kas基因的表达在不同环境和材料间差异显著,均呈先升高再急剧下降趋势。许多研究也发现,辣椒素含量随果实发育阶段呈现先升高后降低的趋势,且辣味程度与Kas表达呈正相关[35-39]。进一步解释了辣椒发育过程中辣椒素积累与Kas的关系。该研究中,对同一材料果实同一发育阶段而言,大棚环境下Kas酶活性和表达均低于露地环境,故推测露地与大棚2种不同的栽培条件下环境因子的差异对Kas酶活性及表达有影响,如低温等因素可能诱导辣椒Kas较高表达,以产生较多次生代谢物质来抵御环境胁迫。因此,环境因素、发育时期和外源因子可通过调控Kas的表达来影响辣椒中辣椒素的积累。在同一栽培环境下,涮辣Kas的酶活性和表达均高于昆明皱皮椒,推测涮辣Kas基因的高表达可能是其辣椒素含量极高的原因之一。
4 结论
特异性扩增得到涮辣和昆明皱皮椒Kas基因,生物信息学分析表明,涮辣与昆明皱皮椒Kas基因和Kas蛋白存在差异,在进化关系上具有保守性。同时Kas在涮辣和昆明皱皮椒生长发育过程中有重要功能,并且参与外源物质的调控。
参考文献
[1]唐胜球,董小英.辣椒素的生理功能及应用前景[J].粮油食品科技,2002,10(6):25-27.
[2]邓明华,文锦芬.云南涮辣的生物学特征及其栽培技术要点[J].辣椒杂志,2008,6(1):19-20.
[3]顾晓振,郑宇峰,张正海,等.云南地方辣椒品种涮辣和雀辣的植物学分类[J].植物遗传资源学报,2016,17(5):809-814.
[4]杨照辉,熊荔芳.不同栽培环境下涮涮辣生理性状研究[J].现代农业科技,2019(4):53-55,61.
[5]邓明华.辣椒色素与辣椒素的遗传与分子调控机制研究进展[J].湖南生态科学学报,2019,6(2):43-51.
[6]TEWKSBURY J J,NABHAN G P.Directed deterrence by capsaicin in chillies[J].Nature,2001,412(6845):403-404.
[7]LEVEY D J,TEWKSBURY J J,CIPOLLINI M L,et al.A field test of the directed deterrence hypothesis in two species of wild chili[J].Oecologia,2006,150(1):61-68.
[8]OCHOA-ALEJO N,RAMIREZ-MALAGON R.In vitro chili pepper biotechnology[J].Vitro Cell Dev Biol Plant,2001,37(6):701-729.
[9]MEGHVANSI M K,SIDDIQUI S,KHAN M H,et al.Naga chilli:A potential source of capsaicinoids with broad-spectrum ethnopharmacological applications[J].J Ethnopharmacol,2010,132(1):1-14.
[10]KHAN F A,MAHMOOD T,ALI M,et al.Pharmacological importance of an ethnobotanical plant:Capsicum annuum L.[J].Nat Prod Res,2014,28(16):1267-1274.
[11]SRINIVASAN K.Biological activities of red pepper(Capsicum annuum)and its pungent principle capsaicin:A review[J].Crit Rev Food Sci Nutr,2016,56(9):1488-1500.
[12]ANTONIO A S,WIEDEMANN L S M,VEIGA JUNIOR V F.The genus Capsicum:A phytochemical review of bioactive secondary metabolites[J].RSC Adv,2018,8(45):25767-25784.
[13]刘熠,刘峰,邹学校.辣椒素类物质生物合成及相关调控基因研究进展[J].湖南农业科学,2020(9):109-111.
[14]ARCE-RODRGUEZ M L,OCHOA-ALEJO N.An R2R3-MYB transcription factor regulates capsaicinoid biosynthesis[J].Plant Physiol,2017,174(3):1359-1370.
[15]AZA-GONZLEZ C,NU'EZ-PALENIUS H G,OCHOA-ALEJO N.Molecular biology of capsaicinoid biosynthesis in chili pepper(Capsicum spp.)[J].Plant Cell Rep,2011,30(5):695-706.
[16]IWAI K,SUZUKI T,FUJIWAKE H.Formation and accumulation of pungent principle of hot pepper fruits,capsaicin and its analogues,in Capsicum annuun var.annuun cv. Karayatsubusa at different growth stages after flowering[J].Agric Biol Chem,1979,43(12):2493-2498.
[17]GURUNG T,TECHAWONGSTIEN S,SURIHARN B,et al.Impact of environments on the accumulation of capsaicinoids in Capsicum spp.[J].HortScience,2011,46(12):1576-1581.
[18]CHAPA-OLIVER A M,MEJA-TENIENTE L.Capsaicin:From plants to a cancer-suppressing agent[J].Molecules,2016,21(8):1-14.
[19]ALURU M R,MAZOUREK M,LANDRY L G,et al.Differential expression offatty acid synthase genes, Acl, Fat and Kas, in Capsicum fruit[J].J Exp Bot,2003,54(388):1655-1664.
[20]DEL ROSARIO ABRAHAM-JUREZ M,DEL CARMEN ROCHA-GRANADOS M,LPEZ M G,et al.Virus-induced silencing of Comt,pAmt and Kas genes results in a reduction of capsaicinoid accumulation in chili pepper fruits[J].Planta,2008,227(3):681-695.
[21]雷建軍,朱张生,孙彬妹,等.辣椒素类物质生物合成及其分子生物学机理研究进展[J].园艺学报,2018,45(9):1739-1749.
[22]WANG J,LIU Y,TANG B Q,et al.Genome-wide identification and capsaicinoid biosynthesis-related expression analysis of the R2R3-MYB gene family in Capsicum annuum L.[J].Front Genet,2020,11:1-12.
[23]ESTRADA B,POMAR F,DAZ J,et al.Pungency level in fruits of the Padrón pepper with different water supply[J].Sci Hortic,1999,81(4):385-396.
[24]HAVKIN-FRENKEL D,PODSTOLSKI A,KNORR D.Effect of light on vanillin precursors formation by in vitro cultures of Vanilla planifolia[J].Plant Cell Tissue Organ Cult,1996,45(2):133-136.
[25]RUIZ-LAU N,MEDINA-LARA F,MINERO-GARCA Y,et al.Water deficit affects the accumulation of capsaicinoids in fruits of Capsicum chinense Jacq.[J].HortScience,2011,46(3):487-492.
[26]MEDINA-LARA F,ECHEVARRA-MACHADO I,PACHECO-ARJONA R,et al.Influence of nitrogen and potassium fertilization on fruiting and capsaicin content in Habanero pepper(Capsicum chinense Jacq.)[J].HortScience,2008,43(5):1549-1554.
[27]TEWKSBURY J J,MANCHEGO C,HAAK D C,et al.Where did the chili get its spice? Biogeography of capsaicinoid production in ancestral wild chili species[J].Chem Ecol,2006,32(3):547-564.
[28]张子昕.极辣辣椒资源鉴定及辣味基因的表达谱分析[D].海口:海南大学,2015.
[29]李维.脱落酸与镉处理对辣椒果实中辣椒素的调控研究[D].长沙:湖南农业大学,2009.
[30]张祥,刘雨婷,张婧柔,等.涮辣与昆明皱皮椒pAMT生物信息学及表达分析[J/OL].分子植物育种,2021-09-24[2022-12-04].https:∥kns.cnki.net/kcms/detail/46.1068.s.20210923.1600.009.html.
[31]阮文渊,贾承国,李彦磊,等.辣椒中辣椒素生物合成途径基因Kas克隆及表达研究[J].东北农业大学学报,2011,42(1):103-108.
[32]张子昕,黄祖梅,成善汉,等.SA和MeJA处理对‘鬼椒王’果实胎座辣椒素类物质含量的影响[J].热带作物学报,2015,36(10):1791-1795.
[33]彭琼,童建华,黄志刚,等.茉莉酸甲酯和苯丙氨酸对辣椒果实品质的影响[J].植物生理学报,2012,48(7):654-658.
[34]GUTIRREZ-CARBAJAL M G,MONFORTE-GONZLEZ M,LMIRANDA-HAM M D L,et al.Induction of capsaicinoid synthesis in Capsicum chinense cell cultures by salicylic acid or methyl jasmonate[J].Biol Plant,2010,54(3):430-434.
[35]KIM M,KIM S,KIM S,et al.Isolation of cDNA clones differentially accumulated in the placenta of pungent pepper by suppression subtractive hybridization[J].Mol Cells,2001,11(2):213-219.
[36]ZHANG Z X,ZHAO S N,LIU G F,et al.Discovery of putative capsaicin biosynthetic genes by RNA-Seq and digital gene expression analysis of pepper[J].Sci Rep,2016,6:1-14.
[37]FAYOS O,DE AGUIAR A C,JIMNEZ-CANTIZANO A,et al.Ontogenetic variation of individual and total capsaicinoids in Malagueta peppers(Capsicum frutescens)during fruit maturation[J].Molecules,2017,22(5):1-12.
[38]KONDO F,HATAKEYAMA K,SAKAI A,et al.The pungent-variable sweet chili pepper ‘Shishito’ (Capsicum annuum)provides insights regarding the relationship between pungency,the number of seeds,and gene expression involving capsaicinoid biosynthesis[J].Mol Genet Genom,2021,296(3):591-603.
[39]邵貴芳,王姣,赵凯,等.云南涮辣辣椒素积累与物质代谢关系的研究[J].辣椒杂志,2016,14(4):22-26.
