热休克蛋白70结合蛋白1诱导星形胶质细胞内源性突变亨廷顿蛋白积聚
2024-01-12彭希覃禹森严丽静亮
彭希,覃禹森,严丽,静亮
亨廷顿病(Huntington’s disease,HD)中,选择性神经元丢失首先发生于纹状体的棘状神经元,然后随疾病的进展波及其他脑区[1]。棘状神经元受皮质神经元的谷氨酸能轴突支配,因此易受到谷氨酸介导兴奋性毒性影响[2]。神经系统的大多数细胞是支持神经元生存的胶质细胞,其中星形胶质细胞是神经胶质细胞的主要类型[3]。星形胶质细胞能够表达谷氨酸转运体,主动摄取细胞外和突触间隙的谷氨酸以防止其神经毒性[4,5]。生理状态下,星形胶质细胞能够从神经内分泌角度维持正常的神经元功能。HD 中,突变亨廷顿蛋白(mutant Huntingtin,mHTT)过表达于神经元并产生年龄依赖的神经病理性损伤[6]。以上现象引出一个关键问题,即星形胶质细胞内源性表达mHTT 是否产生病理性损伤。
当前HD 小鼠模型在研究星形胶质细胞内源性mHTT作用方面存在局限性,多为mHTT选择性在神经元中过表达,或在神经系统中广泛表达[7]。我们在前期研究中构建了星形胶质细胞中特异性表达mHTT N’端片段的转基因小鼠胶质纤维酸性蛋白(glia fibrillary acidic protein,GFAP)-HD[8]。尽管该小鼠mHTT的表达水平较低,但依然可以表现出年龄依赖的HD病理特点。本研究选用该模型探讨星形胶质细胞在HD病理性进展中的作用。
我们的前期研究发现,热休克蛋白70结合蛋白1(heat shock protein 70 binding protein 1,HspBP1)通过抑制神经元泛素化功能诱导mHTT 积聚。同时,HspBP1 在神经元和神经胶质细胞中存在差异性表达[9]。该发现引出新的假设,即星形胶质细胞中HspBP1的低水平表达能否解释其较少出现mHTT 积聚和功能障碍。因此,我们利用腺相关病毒(Adeno associated virus,AAV)转导技术在4 月龄GFAP-HD 小鼠纹状体星形胶质细胞中过表达HspBP1,结果显示星形胶质细胞短期内即出现mHTT 积聚以及年龄依赖的运动功能障碍。因此HspBP1诱导星形胶质细胞中mHTT增加可能是HD病理性损伤的关键因素。
1 材料与方法
1.1 主要试剂与材料
1.1.1 主要试剂 小鼠抗亨廷顿蛋白抗体(mEM48)由本实验室制备并保存。兔抗NeuN(ABN78)、兔抗GFAP(AB5804)购于Millipore 公司,兔抗HspBP1(HPA071444)、小鼠抗 Vinculin(V9131)购于Sigma-Aldrich公司;HRP和AlexaFluor 488/594标记的抗鼠、抗兔IgG 购于Jackson 实验室;DAPI、DAB 试剂盒(D4418)购于Sigma-Aldrich公司;
1.1.2 质粒、病毒 我们在pAAV-GFAP104-mCherry载体(Addgene)的EcoRI 和XbaI 克隆位点中插入HspBP1 cDNA 以获得pAAV-GFAP-HspBP1 质粒。同时利用相同的方法插入GFP cDNA 以获得对照组pAAV-GFAP-GFP 质粒。以上2 种AAV 克隆均通过AAV9 包装载体制备,并由Emory 大学病毒载体中心(Virus Vector Core)制备和扩增。AAV-GFAP-HspBP1和AAV-GFAP-GFP的滴度分别为8.8×1013vg/mL、2.8×1014vg/mL。
1.1.3 实验动物 GFAP-HD 转基因小鼠在星形胶质细胞内特异性表达mHTT。C57BL/6J(野生型)小鼠由本实验室保存。实验小鼠均保存于Emory大学无菌级动物实验中心,并根据Emory 大学动物管理委员会指南饲养和维护。本研究中全部动物实验均由Emory大学动物资源部批准。
1.2 方法
1.2.1 立体定位注射 实验用小鼠经2.5%异氟醚麻醉后,将头部固定在Kopf立体定位框架(1900型)中,该框架配有数字机械手、UMP3-1型注射泵和10-μL汉密尔顿微量注射器,使用33 G针头进行注射。手术过程中给予美洛昔康(5 mg/kg)镇痛。以前囟设置为坐标0点;选取以下坐标定位胼胝体:X=±1.5 mm、Y=-0.55 mm、Z=-1.0 mm;纹状体:X=±2.0 mm、Y=-0.55 mm、Z=-3.5 mm。注射前使用PBS 将病毒滴度校正为1.0×1014vg/mL,病毒溶液的注射速度为0.2 μL/min,每次注射后留针5 min 以减少提针后病毒溶液沿针道扩散。手术结束后,将小鼠转移到37 ℃温控加热垫上,每隔15 分钟监测1 次,直到完全苏醒。注射完毕后每日检测小鼠状态,必要时给予美洛昔康(5 mg/kg/d)镇痛。注射4周后,腹腔注射戊巴比妥(200 mg/kg)处死小鼠,分离脑组织进行后续实验。
1.2.2 免疫组织化学和免疫荧光染色 取小鼠新鲜脑组织,4%多聚甲醛4 ℃固定过夜后,使用30%蔗糖4 ℃脱水48 h。-20 ℃将脑组织切片成20 μm。漂片法使用0.3%Triton X-100 在37 ℃破膜15 min,用0.01 M 的柠檬酸钠在95 ℃孵育15 min行抗原修复。4%胎牛血清37 ℃封闭抗原1 h,PBS 振荡洗涤3 次后,4 ℃孵育一抗过夜。37 ℃孵育二抗1 h。免疫组织化学染色通过DAB 试剂盒显色。免疫荧光染色37 ℃DAPI 染色10 min。以上结果均使用Zeiss Axiovert 200 MOT显微镜进行观察。
1.2.3 Western Blot 取新鲜小鼠脑组织,RIPA 裂解30 min。期间超声处理3 次,30 s/次。经BCA 法滴定蛋白质含量。将等量蛋白质电泳和转膜后,4 ℃一抗孵育过夜。PBS洗涤3次后,二抗37 ℃孵育1 h。PBS洗涤3次后,用ECL溶液(KwikQuant)显色。以上图像使用KwikQuant软件采集。
1.2.4 行为学实验 随机选择2 月龄的野生型和GFAP-HD 小鼠,每种基因型使用12 只小鼠(雌雄各半)。每种基因型小鼠随机分为AAV-GFAP-GFP 和AAV-GFAP-HspBP1 组后分别于双侧纹状体立体定位注射AAV-GFAP-GFP 或AAV-GFAP-HspBP1。注射2周后开始行为学实验准备。实验动物连续训练3天后开始正式测试。每次测试均重复3 次,取平均值进行统计学分析。分别进行旋转杆、平衡木和握力实验检测小鼠运动功能。旋转杆实验中,小鼠连续3 天在旋转棒(Rotamex 4/8,Columbus Instruments International)上以5 rpm 的速度进行预训练,10 min/次。实验小鼠训练3 d 后开始正式测试:将旋转杆的速度设置为5 rpm,以0.1 rpm/s 的速度递增,记录3 次小鼠落地时间。平衡木测试中,平衡木为长1 m,宽6 mm的木条,置于距离桌面上方50 cm 处的2 根木杆上。平衡木的一侧放置黑盒用作测量终点。如前所述,3 次预训练后,正式实验中通过计时器测量小鼠穿过平衡木中点所需的时间[10]。握力测试通过握力测量仪(Ametek Chatillon)直接测量。每次行为学实验前测量小鼠体质量。每隔1月进行1次上述检测。所有行为学实验均按照美国国立卫生研究院的指南进行,并得到Emory大学动物管理委员会批准。
1.3 统计学处理
采用GraphPad Prism7 软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验或单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 GFAP-HD小鼠星形胶质细胞中表达mHTT
前期研究发现,mHTT在HD小鼠星形胶质细胞中表达时较少出现神经元特异性积聚现象[11,12]。GFAP-HD 转基因小鼠模型为本实验室前期构建的特异性在GFAP 启动子控制下表达mHTT 的动物模型。GFAP启动子是一种星形胶质细胞特异性启动子,能够驱动星形胶质细胞表达各种基因[13,14]。本模型中使用的mHTT基因为编码N’端208个氨基酸且携带160个谷氨酰胺(Q)的cDNA片段,该片段已被证实具有较强毒性[15]。为验证转基因mHTT-160Q 在星形胶质细胞中的表达,我们采用4月龄GFAP-HD小鼠进行立体定位注射,注射4周后纹状体区脑片进行免疫组化染色,结果提示GFAP-HD 转基因小鼠的纹状体中mHTT 表达水平极低,且未见到mHTT 的积聚,见图1。该结果反映了mHTT在星形胶质细胞中的表达和积聚受到限制。
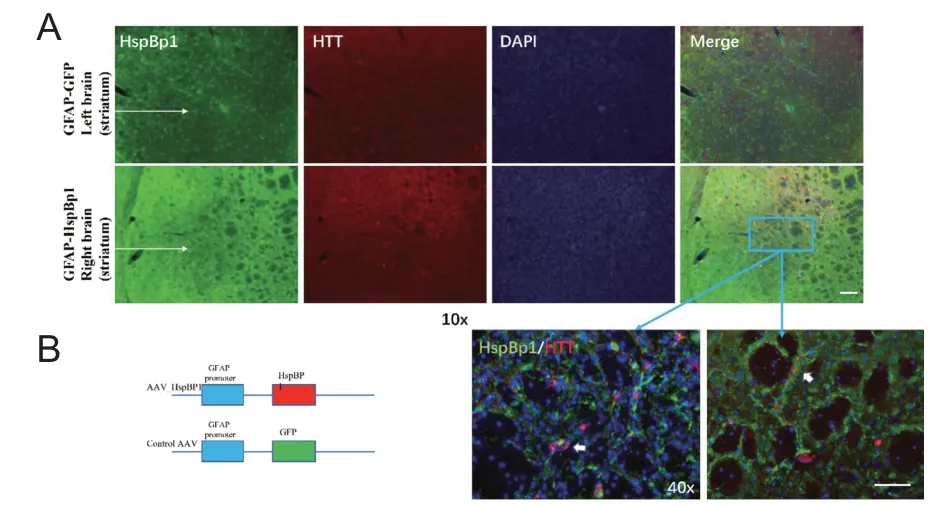
图1 HspBP1增加纹状体星形胶质细胞中mHTT表达和积聚
2.2 GFAP-HD小鼠星形胶质细胞中过表达HspBP1诱导mHTT积聚
为了检测HspBP1 过表达的体内效应,我们在GFAP-HD小鼠的右侧纹状体进行AAV-GFAP-HspBP1的立体定位注射。作为对照,AAV-GFAP-GFP被注射到左侧纹状体(图2A)。Western blotting显示AAV病毒能有效地转导HspBP1(图2B)。免疫组化染色显示注射的脑区(皮质、胼胝体和纹状体)均显示出明显的HspBP1抗体染色(图2A)。更重要的是,免疫荧光染色显示AAV-GFAP-HspBP1 感染后,纹状体星形胶质细胞中mHTT的表达明显增加并且出现核内积聚(图1)。前期研究中,我们从GFAP-HD小鼠脑组织中分离星形胶质细胞进行原代培养,感染AAV-GFAP-HspBP1后,GFAP和mHTT的免疫荧光共染色证实mHTT在星形胶质细胞中的积聚[16]。以上现象在皮质和胼胝体内得到证实(图3)。同时,GFAP-HD 小鼠在AAV-GFAP-HspBP1注射后没有出现NeuN 及GFAP 的变化(图2C)。该结果提示,神经元内不表达mHTT时,仅增加mHTT在星形胶质细胞中的积聚并不会产生严重的星形胶质细胞活化和神经元损伤。
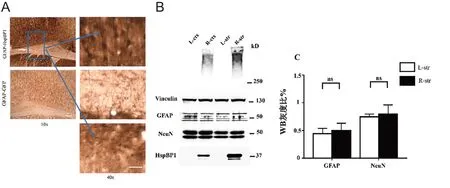
图2 星形胶质细胞中过表达HspBP1

图3 HspBP1增加皮质和胼胝体星形胶质细胞中mHTT表达和积聚
2.3 GFAP-HD小鼠星形胶质细胞中过表达HspBP1诱导神经病理性改变
前期研究表明,GFAP-HD 小鼠在没有神经元内mHTT积聚的情况下依然能够出现年龄依赖性运动功能障碍,但该现象在小鼠13 个月大之前并不明显[8]。因此,GFAP-HD小鼠的运动障碍表型可能是由星形胶质细胞内mHTT积聚引起的。为了探讨增加星形胶质细胞中HspBP1 表达能否加速GFAP-HD 小鼠表型,我们将AAV-GFAP-HspBP1注入2月龄GFAP-HD和野生型小鼠的双侧纹状体后监测其运动功能,对照组为AAV-GFAP-GFP 注射的GFAP-HD 和野生型小鼠。纹状体对于运动协调功能非常重要,改变mHTT 在纹状体中的表达可以影响HD 小鼠的运动功能[17]。我们观察到与注射AAV-GFAP-GFP 的对照组相比,注射AAV-GFAP-HspBP1的GFAP-HD小鼠出现更早(5-6月龄)的转杆和平衡木以及握力下降。同时,注射AAVGFAP-HspBP1 的GFAP-HD 和野生型小鼠之间无明显差异。不同小鼠组间体质量未见明显差异,见图4。

图4 HspBP1诱导星形胶质细胞神经病理性损伤,导致运动功能障碍
3 讨论
早期研究表明,星形胶质细胞摄取谷氨酸的能力对于防治谷氨酸兴奋性神经毒性起重要作用。HD 中星形胶质细胞过表达mHTT 可以影响多种细胞功能,如基因转录、神经递质重摄取、膜通道活性和神经营养因子释放[18,19],进而诱导严重的病理性损伤[20,21]。我们早期的研究表明,mHTT 可以影响星形胶质细胞对谷氨酸的摄取。然而,星形胶质细胞内源性mHTT 过表达能否直接诱导神经病理性表型目前仍有待研究。这对于验证星形胶质细胞在HD 中的致病作用尤为重要。
前期研究发现,mHTT在HD小鼠星形胶质细胞中较少出现过表达或积聚[7,11]。GFAP-HD 转基因小鼠能够在星形胶质细胞中特异性表达mHTT,但mHTT 阳性细胞数目较少提示mHTT在星形胶质细胞中的表达受到限制。前期研究中我们同时比较了不同年龄阶段GFAP-HD小鼠星形胶质细胞mHTT表达水平,结果显示随年龄增加,mHTT 在星形胶质细胞的细胞质和细胞核中分布并形成聚集体,该现象在野生型小鼠星形胶质细胞中未见。因此,我们推测调控HD 星形胶质细胞过表达mHTT可能加速病理性损伤。
HspBP1 在星形胶质细胞表达水平远低于神经元,使其可能成为星形胶质细胞清除mHTT 的关键因素[9,22]。本研究的结果证实了以上假设。GFAP-HD 星形胶质细胞中HspBP1 的过表达加速了mHTT 的积聚。GFAP-HD 小鼠的年龄依赖性神经表型为体重减轻、运动功能障碍和驼背外观[8]。一旦GFAP-HD 小鼠表现出明显的运动缺陷,它们的行为表型就会逐渐恶化,并通常在出现严重症状后1~2 周死亡。我们在2月龄时将AAV-GFAP-HspBP1 或AAV-GFAP-GFP 病毒注入野生型和GFAP-HD 小鼠的两侧纹状体后监测其运动功能。结果显示过表达GFAP-HspBP1 的GFAP-HD 小鼠出现更早的运动协调能力(转杆、平衡木和握力)下降,但是并未观察到体重减轻。同时免疫染色未见明显的神经元损伤或星形胶质细胞活化。该结果提示过表达HspBP1 能够诱导星形胶质细胞mHTT 积聚加速年龄依赖性运动功能障碍;但mHTT在神经元和星形胶质细胞中共同表达是神经元显著变性的必需条件。
本研究首次证实HspBP1 能够通过促进星形胶质细胞内源性mHTT积聚介导HD 病理性损伤。该结果提示维持星形胶质细胞正常功能对于治疗HD具有重要意义。
致谢:本文部分工作在美国Emory大学李晓江教授实验室完成。
